УДК 612.82.015.3:615.322
КЛИНИКО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ НЕЙРОТРОПНОГО ДЕЙСТВИЯ ВОДНОГО ЭКСТРАКТА ТРУТОВОГО ГРИБА ЧАГИ
©2005 г. Переверзева Е. В. 1, Шиманец С. В. 1, Антипенко А. А. 2 , Гаркун Ю. С. 2, Рожнова Л. Э. 2 , Авад А. 1, ПашкевичС. Г. 2 , Кандыбо Т. С. 2, Переверзев В. А. 1, Кульчицкий В. А. 2
В модельных экспериментах на срезах гиппокампа крыс установлено наличие выраженной нейротропной активности у водного экстракта трутового гриба чаги. Она заключается в угнетении образования возбуждающих постсинаптических потенциалов в stratum radiatum области CA1 гиппокампа. В экспериментах “in vivo” установлено достоверное уменьшение длительности латентного периода рефлекса отдергивания хвоста у крыс опытной группы. В исследованиях на больных людях с язвой желудка и/или 12-перстной кишки установлено, что водный экстракт чаги (в виде препарата “Бефунгин") обладает достаточно стойким стимулирующим действием на умственную работоспособность и может быть рекомендован для более широкого использования, в том числе, в качестве средства для коррекции побочных (седативных) эффектов блокаторов Н2-гистаминовых рецепторов. Это действие чаги может быть обусловлено ее влиянием на активность структур гиппокампа.
В течение 50 лет (с 50-х годов прошедшего столетия) в гастроэнтерологии и онкологии применяется водный экстракт трутового гриба чаги (Inonotus obliquus /Pers./ Pilat. f. sterilis). В качестве лекарственных средств из Inonotus obliquus в России и Белоруссии зарегистрированы сам гриб чага (включая плодовые тела и порошок из них) и препараты из него: “Бефунгин” (Befunginum) – водный экстракт, и “Гастрофунгин” - спиртовая настойка на 70%-ном этиловом спирте [8, 9]. В настоящее время их используют в гастроэнтерологии для лечения больных гастритами, при дискинезиях желудочно-кишечного тракта с явлениями атонии, при язве желудка и двенадцатиперстной кишки, а также в онкологической практике как симптоматическое и общетонизирующее средство [8, 9].
Известно, что водный экстракт чаги оказывает выраженное нейротропное (ноотропное) влияние: увеличивает объем кратковременной памяти, ускоряет процессы научения и пропускную способность зрительного анализатора, уменьшает длительность латентного периода и моторного времени сложной сенсомоторной реакции здоровых испытуемых [10, 11, 13]. Рядом исследователей [5, 9] установлено, что введение водного экстракта чаги животным вызывает у них (в частности, у кроликов) повышение температуры головного мозга, увеличение потребления кислорода, улучшение усвоения навязанного ритма возбуждения в коре больших полушарий, а также повышает их (в частности, мышей) устойчивость к гипоксии. Однако целенаправленного, комплексного изучения нейротропных эффектов трутового гриба чаги не проводилось. Особенности нейротропного действия водного экстракта чаги до сих пор остаются не выясненными. В связи с этим представляло научный и практический интерес изучение клинико-физиологических особенностей нейротропного действия водного экстракта чаги у человека и животных. Их выявление в условиях “in vitro” и “in vivo” и явилось целью нашего исследования.
Материалы и методы исследования. Исследования на людях проведены с участием 17-и больных язвой желудка или 12-перстной кишки мужского пола в возрасте от 22-х до 59-и лет при среднем возрасте в опытной группе 39,6 лет, а в контрольной группе — 35,3 года (разница не достоверна /p>0,05/). Диагноз язвенной болезни устанавливался на основании клинико-анамнестических данных и лабораторно-инструментальных методов исследования. При обследовании больных наряду с обязательными общеклиническими исследованиями проводились: фиброгастродуоденоскопия с биопсией, уреазный тест, исследование секреторной функции желудка. Обследование позволяло провести дифференциальную диагностику и исключить сопутствующие заболевания у пациентов, принятых в опытную и контрольную группы. Медикаментозная терапия проводилась согласно протокола лечения, утвержденного в 6-ой клинической больнице г. Минска для гастроэнтерологического отделения. Все больные контрольной и опытной группы получали блокатор гистаминовых Н2-рецепторов 2-го поколения ранитидин (фирменное название препарата “Гистак”) в дозе по 0,15 г два раза в сутки утром и вечером в сочетании с антацидом алмолом (1 дозированная ложка х 4 раза в сутки). Больным опытной группы, кроме того, назначался бефунгин в дозе 4,5 мл в сутки при разведении теплой кипяченной водой до 100 мл; принимался внутрь в 3 приема (утром, в обед и вечером) за 30 минут до еды.
Нейротропная активность водного экстракта чаги (препарат “Бефунгин”) определялась по изменению показателей умственной работоспособности (высших интегративных функций мозга) больных людей, измеряемых с помощью комплекса приборов “ПФК-01”. Тестирование каждого больного проводили 4 раза: при поступлении, а также на 7-й, 14-й, 21-й дни лечения. Отдельные пациенты прошли последнее обследование на фоне амбулаторного приема препаратов. Всего проведено 76 комплексных исследований психофизиологических характеристик больных (из них 68 — в динамике). Каждое тестирование (комплексное исследование) включало в себя определение следующих показателей: объем кратковременной зрительной памяти на двузначные числа; внимание и пропускная способность зрительного анализатора (ПСЗА) в корректурном тесте с кольцами Ландольта; мышление по результатам решения простых арифметических примеров с однозначными числами; скорость и точность простой и сложной сенсомоторных реакций [2, 6, 7].
Опыты in vitro проведены на 7 срезах гиппокампа трех-четырех недельных крысят. Животных декапитировали, извлекали головной мозг и быстро помещали его в охлажденный до 3 ° С раствор искусственной цереброспинальной жидкости (ИЦЖ). После начала инкубации удаляли мозжечок и области мозга, прилежащие к гиппокампу. Толщина срезов гиппокампа не превышала 450 мкм. Срезы инкубировали в течение 30 мин при комнатной температуре в растворе ИЦЖ, который насыщали карбогеном (95% O2 и 5% CO2). Установка для регистрации электрической активности нейронов гиппокампа [3, 4] состоит из: камеры, в которой в растворе ИЦЖ находится срез мозга (гиппокампа); системы перфузии, благодаря которой осуществляется смена растворов в камере; системы оксигенирования, насыщающей раствор карбогеном; системы терморегуляции, поддерживающей с помощью элемента Пельтье заданную температуру в камере; системы регистрации и электрической стимуляции.
Вызванные ответы регистрировали с помощью игольчатого платино-иридиевого микроэлектрода с размером неизолированной области около 50 мкм. Регистрирующий микроэлектрод размещался внеклеточно в слое stratum radiatum СА1, что позволяло проводить мониторинг постсинаптических потенциалов между телами нейронов и апикальными дендритами СА1 области. Внеклеточную стимуляцию подпороговыми импульсами осуществляли через монополярный платино-иридиевый микроэлектрод с размером неизолированной области около 100 мкм. Поскольку стимуляция осуществлялась подпороговыми импульсами, то основной вклад в формирование вызванных ответов вносил полевой возбуждающий постсинаптический потенциал (пВПСП). Стимулирующий микроэлектрод размещали в слое stratum rаdiatum на границе областей СА1- СА3. Такое расположение позволяло локально активировать коллатерали Шаффера. С целью нивелирования передачи по коллатералям Шаффера ритмической активности от гигантских пирамидных нейронов СА3 области предварительно осуществляли рассечение ткани мозга на границе областей СА1- СА3. Каждый стимулирующий импульс включал отрицательную и положительную фазы (амплитудой 50 мкА и длительностью 300 мкс). Обычно в исходном состоянии наносили 10- 50 парных стимулов, с межстимульным интервалом в 50 мс и интервалом между парой стимулов в 3 с. Затем на фоне продолжающейся стимуляции, начинали перфузию экстракта трутовых грибов (раствор чаги от 10 мкг/мл до 1000 мкг/мл).
В хронических экспериментах in vivo на белых крысах самцах массой тела 260- 300 г оценивали изменения длительности латентного периода рефлекса отдергивания хвоста (РОХ), уровня артериального давления (Ад) крови и глубокой температуры тела опытных и контрольных животных на первые и седьмые сутки эксперимента. Опытным крысам (n=7) в поилки вместо воды поместили
приготовленный водный раствор трутового гриба чаги (1 мл раствора чаги на 100 мл питьевой воды), животным контрольной группы (n=5) в питьевую воду чага не добавлялась. Всех животных содержали в стандартных условиях вивария (температура воздуха 21± 1° С) при свободном доступе к воде/раствору чаги и пище, 12/12-часовом ритме освещения и темноты. Ежесуточное уменьшение объема питьевой воды в поилках в расчете на одну крысу составило 11-13 мл. Это позволило рассчитать ежесуточное потребление экстракта трутового гриба, составившее от 1.1 до 1.3 мг на одно экспериментальное животное.За три недели до эксперимента всех крыс адаптировали к экспериментальным условиям (хендлинг в течение двух-трех дней, затем 9–10 тренировок по 2–4 ч в специальных боксах, в которых животные могли совершать движения вокруг оси и небольшие в ростро-каудальном направлении) [1, 15]. Для нивелирования возможных влияний циркадианных ритмов на регистрируемые показатели наблюдения осуществляли в фиксированное время (9.30–12.00 утра). Регистрацию физиологических показателей у животных проводили в термостатах при температуре 29.9 oС (термонейтральные условия для крыс [15]).
Соматический ноцицептивный рефлекс оценивали по величине латентного периода реакции отдергивания хвоста крыс в ответ на термический ноцицептивный стимул (погружение хвоста в воду (49° С) на две трети его длины). Для оценки глубокой температуры тела через анальное отверстие на глубину 9–10 см в толстую кишку вводили термопару (электротермометр фирмы “Physitemp”, США). Уровень артериального давления регистрировали “манжеточным” способом в регионе хвостовой артерии. Для этого сравнивалось изменение оптической плотности поверхностных тканей хвоста в инфракрасных лучах до и после пережатия хвостовой артерии с помощью пневмоманжеты, соединенной с датчиком давления. В качестве излучателя использовали инфракрасный светодиод АЛ-107, в качестве фотоприемника – фотодиод ФД-256 (Беларусь). Измерения РОХ и Ад регистрировали трижды.
Статистическую обработку данных проводили с использованием t-критерия Стьюдента и программы вариационной статистики ANOVA. Различия считали значимыми при Р< 0.05. На рисунках и в тексте результаты представлены в виде M± m.
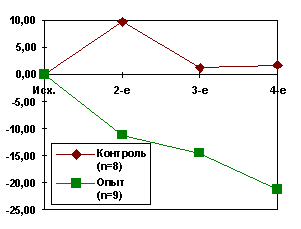
Результаты и их обсуждение. Исследования на людях показали, что через 2 недели от начала приема бефунгина у больных при 3-ем и 4-ом тестированиях было зарегистрировано повышение умственной деятельности: уменьшалось число ошибок (на 2 - 4 единицы; р< 0,05) в тестах “простая и сложная сенсомоторные реакции”; увеличивался объем кратковременной зрительной памяти на двузначные числа (на 12,5 - 17,5%, р< 0,02); улучшалось внимание за счет снижения числа ошибок (на 3,6 - 4,1 %, р< 0,05) и увеличения количества прокорректированных колец Ландольта. Это свидетельствовало об улучшении пропускной способности зрительного анализатора на 0,11 - 0,16 бит/с (р< 0,02) у пациентов опытной группы. У больных контрольной группы вышеперечисленные показатели умственной работоспособности (УР) в динамике лечения по сравнению с исходным уровнем не изменялись или даже повышались. Сумма ошибок по всем использованным тестам наиболее полно характеризует качество умственной работы. По этому показателю нами также была выявлена положительная динамика у больных опытной группы: снижалось общее число ошибок как по отношению к исходному уровню, так и к аналогичному показателю пациентов из контрольной группы, не получавших водный экстракт чаги (рис. 1).

Рис. 1.
Динамика умственной работо-способности больных (по изменению суммы ошибок [D е СО] к исходному ее значению) в опытной и контрольной группах.
Пояснения:
1. — различия достоверны по отношению к исходному уровню (p< 0,02);
2. — различия достоверны по отношению к контролю (p< 0,05);
3. n — число больных в группе.
Анализируя результаты исследований высших интегративных функций мозга (ВИФМ) больных людей необходимо включить в сферу своего внимания препараты протокола лечения, на фоне которых проявлял свое стимулирующее действие бефунгин. Как уже указывалось, протокол включал в себя препарат “Гистак”, который мог оказать [2, 8] — и оказал — системное действие на организм пациентов.
В наших исследованиях мы выявили у части больных выраженное влияние гистака на ВИФМ. Так, анализируя динамику психофизиологических показателей больных контрольной группы, мы выявили 2 подгруппы. Показатели УР по сумме ошибок, нарастая в одной подгруппе и снижаясь в другой, к 4-ому исследованию (21-му дню приема препаратов протокола лечения) достигают достоверной разницы, т.е. у части пациентов УР еще снижается, несмотря на позитивную динамику эндоскопической картины. Эти результаты согласуются с имеющимися в литературе [2, 8, 9] многочисленными данными о проявлении побочного действия Н2-гистаминовых блокаторов. Известно, что препараты этой группы широко назначаются больным для длительного многонедельного приема. Так, по данным Катцунга (1998), количество продаж Н2-гистаминовых блокаторов в мире по сравнению с лекарствами других групп стоит на 1-ом месте и сумма от их реализации достигла 4-х миллиардов долларов США в год. Учитывая побочные эффекты действия этих препаратов в виде угнетения внимания, памяти и других показателей УР, вероятно, необходимо их контролировать соответствующими методиками, так как, например, в наших исследованиях побочные эффекты гистака субъективно и на клиническом уровне не проявлялись. Особенно, актуальным контроль УР становится в условиях амбулаторного лечения пациентов Н2-гистаминовыми блокаторами, которое практикуется шире с каждым годом. Нередко это касается пациентов, специфика труда которых требует высокого уровня всех аспектов УР при длительной и напряженной деятельности. Помимо контроля над указанными аспектами состояния пациентов, представляется целесообразным применение в протоколе лечения препаратов, коррегирующих побочное действие Н2-гистаминовых блокаторов на ВИФМ.
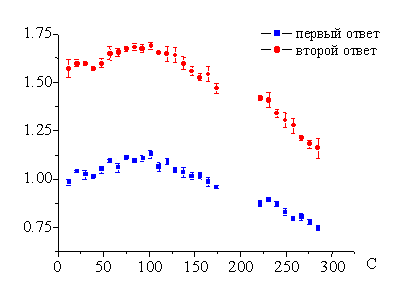
Рис. 2.
Особенности возбуждающих постсинаптических потенциалов в СА1 области гиппокампа при парной стимуляции коллатералей Шаффера в условиях перфузии срезов гиппокампа раствором чаги (1000 мкг/мл).
Обозначения: По вертикали представлены искусственно выбранные единицы, полученные в результате нормирования амплитуды вызванных ответов в условиях перфузии срезов раствором чаги на амплитуду ответов в исходном состоянии. По горизонтали представлено время наблюдения в секундах
Водный экстракт чаги (в виде препарата “Бефунгин”), разрешенный к применению в гастроэнтерологии и применяющийся в составе схем лечения язвы желудка и/или 12-перстной кишки, обладает достаточно стойким стимулирующим действием на УР и может быть рекомендован для более широкого использования в том числе в качестве средства для коррекции побочных (седативных) эффектов блокаторов Н2-гистаминовых рецепторов.
Учитывая важную роль нейронов гиппокампа [14] в механизмах памяти, внимания и реализации других ВИФМ в опытах in vitro изучалось влияние водного экстракта чаги на электрическую активность изолированных структур гиппокампа крыс. Как видно из графика, представлено на рис. 2, через 40-45 с после начала перфузии срезов гиппокампа раствором чаги в концентрации 1000 мкг/мл происходит небольшое увеличение амплитуды ВПСП в ответ на оба парных стимула. Начиная со второй минуты перфузии (см. рис. 2, рис 3), амплитуда ВПСП в ответ на парную стимуляцию коллатералей Шаффера начинает прогрессивно уменьшаться. Снижение амплитуды продолжается в течение двух-десяти мин даже после прекращения перфузии срезов раствором чаги (во всех экспериментах продолжительность перфузии составляла три минуты).
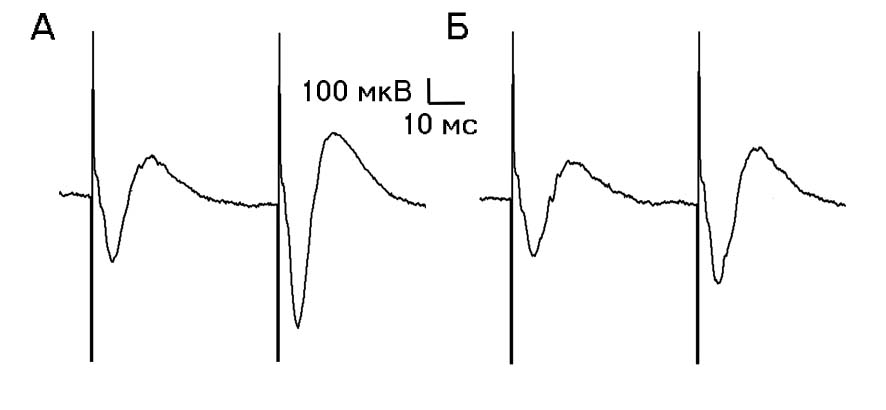
Рис. 3.
Изменение амплитуды полевых возбуждающих постсинаптических потенциалов при действии чаги в концентрации 1000 мкг/мл. А - до
перфузии раствора чаги, Б – на 180 с перфузии раствора чаги.
При уменьшении концентрации раствора чаги до 10-100 мкг/мл выявляется картина лишь прогрессивного уменьшения амплитуды ВПСП. Так, как представлено на рис. 4, снижение амплитуды ВПСП в ответ на парную стимуляцию коллатералей Шаффера отмечалось на протяжении всего периода перфузии срезов гиппокампа раствором чаги в концентрации 100 мкг/мл. Полученные в опытах in vitro результаты подтверждают ранее высказанное предположение [9, 12] о наличии выраженных нейротропных эффектов экстрактов этого трутового гриба. Поскольку доминирующим эффектом в модельных экспериментах на срезах гиппокампа было создание условий на пре- и постсинаптическом уровне, затрудняющих формирование ВПСП, то можно заключить о несомненном модулирующем влиянии водных экстрактов чаги на синаптические процессы на уровне гиппокампа.
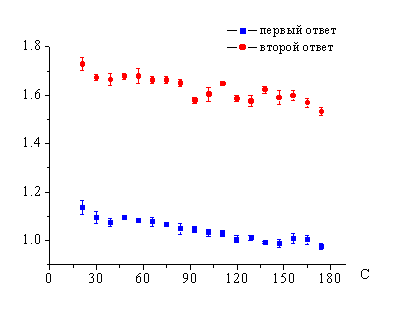
Рис. 4.
Особенности возбуждающих постсинаптических потенциалов в СА1 области гиппокампа при парной стимуляции коллатералей Шаффера в условиях перфузии срезов гиппокампа раствором чаги (100 мкг/мл).
Обозначения: По вертикали представлены искусственно выбранные единицы, полученные в результате нормирования амплитуды вызванных ответов в условиях перфузии срезов раствором чаги на амплитуду ответов в исходном состоянии. По горизонтали представлено время наблюдения в секундах
Затруднение формирования ВПСП в stratum radiatum области CA1 гиппокампа, вызываемое экстрактом чаги, может способствовать тому, что в его активности будут преобладать более медленные электрические ритмы (тета-ритм). Тета-ритм [14] отражает участие структур гиппокампа в ориентировочном рефлексе, реакциях настораживания, повышения внимания, процессах памяти, в динамике обучения. Результаты этих исследований “in vitro” согласуются с данными об улучшении под влиянием чаги усвоения навязанного ритма возбуждения нейронами новой коры [5] и их реципроктных отношениях с электрической ритмикой гиппокампа [14]; о предупреждении или ослаблении угнетения поведенческой активности (ориентировочного рефлекса) у подвергнутых иммобилизационному стрессу животных [9, 12]; о повышении внимания (пропускной способности зрительного анализатора) и умственной работоспособности здорового [10, 11, 13] и больного (рис. 1) человека в динамике обучения (повторных тестирований). Полученные данные дают основание полагать, что в повышении внимания, увеличении объема кратковременной и усилении процессов долговременной памяти в условиях применения водных экстрактов чаги важная роль может принадлежать их модулирующему влиянию на синаптические процессы на уровне гиппокампа.
В хронических экспериментах на белых крысах самцах (n=12) показано, что между исходными измерениями функциональных показателей и данными, полученными на седьмые сутки исследования, изменений уровня артериального давления и глубокой температуры тела не обнаружено. В отношении латентного периода рефлекса отдергивания хвоста крыс выявлено его снижение на 7-е сутки наблюдения у группы животных, получавших водный раствор чаги по сравнению с группой крыс, которым в питьевую воду экстракт трутовых грибов не добавлялся. В частности, длительность РОХ в группе крыс, получавших раствор чаги, составляла 3.7?0.2 с /р<0,02/, а в группе контрольных животных – 5.3?0.5 с. Уменьшение латентного периода РОХ позволяет судить об активирующим влиянии экстракта трутового гриба чаги на процессы, протекающие в ЦНС крыс и осуществляющие контроль защитных механизмов организма. Уменьшение под влиянием чаги длительности латентных периодов (но уже сложной сенсомоторной реакции) выявлено нами [11-13] и в исследовании на людях. Наблюдаемое повышение активности нейронов сопровождается увеличением потребления мозгом кислорода и его температуры [5, 9]. В тоже время более раннее и более адекватное включение защитных механизмов приводит к выраженному стресспротекторному, в том числе и антигипоксическому, действию экстрактов чаги [9]. Важная роль в этом может принадлежать структурам гиппокампа, выраженное модулирующее действие на которые оказывает водный экстракт чаги.
Особый интерес представляют данные о двухфазном влиянии больших концентраций водных экстрактов чаги (1 мг/мл или 1000 мкг/мл) на формирование ВПСП (сначала увеличение, а затем угнетение). Можно предполагать, что гипералгезивный эффект чаги по уменьшению длительности РОХ сопряжен с угнетением возможности формирования ВПСП в структурах гиппокампа, в то время как 1-я фаза действия чаги (увеличение амплитуды ВПСП) может сопровождаться гипоалгезией. Это наблюдают в клинике [8, 11], назначая гастроэнтерологическим и онкологическим больным водные экстракты чаги в больших дозах до 1-3 стаканов настоя в день (2500 – 7500 мг/сутки).
Таким образом, полученные данные подтверждают имеющиеся в научной литературе сведения о способности водных экстрактов чаги оказывать выраженное нейротропное действие и дают основание говорить о возможности участия в этом процессе структур гиппокампа, а также зависимости их активности от воздействующей концентрации экстрагированных веществ применяемого препарата.
Работа выполнена в рамках проекта Государственной программы прикладных исследований “Биоанализ и диагностика” (№ госрегистрации 2004/24-87).
Литература
Е.V. Pereverzeva1, s.v. Shimanets1, A.A. Antipenko2, Yu.S.Garkun2, L.E. Roznova2, А. Awad1, S.G. Pashkenich2, T.S. Kandibo2, V.A. Pereverzev1, V.A. Kulchitsky2
NEURONAL ACTIVITY CLINICAL PHYSIOLOGYCAL PERCULIARITIES UNDER THE INFLUENCE OF WATER EXTRACTS INONOTUS OBLIQUUS SPONGY FUNGUS
1
Belarusian State Medical University, Minsk, Belarus2
Institute of Physiology National Academy of Sciences, Minsk, Belarus
1
Белорусский государственный медицинский университет, Минск2
Институт физиологии НАН Беларуси, МинскПоступила в редакцию 9.03.2005.