
ВЕСТНИК СМОЛЕНСКОЙ ГОСУДАРСТВЕННОЙ МЕДИЦИНСКОЙ АКАДЕМИИ 2005. No 3.
1920-2005

СМОЛЕНСК 2005
Вестник Смоленской медицинской академии. Медико-биологический выпуск.
Редакторы выпуска В. А. Правдивцев, Н. Ф. Фаращук.
Смоленск: Изд-во СГМА, 2005. – №3, 100 с.
Электронные версии избранных работ настоящего выпуска журнала, отмеченных *, размещены в Интернете на web-сайте: www//smolensk.ru/user/SGMA – “Математическая морфология и системология”.
Главный редактор
В. Г. ПЛЕШКОВ
Редакционная коллегия:
Р. С. Богачев, А. И. Борохов, М. Н. Гомончук, Е. И. Зайцева, А. Н. Иванян, С. А. Касумьян, Л. В. Козлова, С. Б. Козлов, В. А. Милягин, О. В. Молотков, Л. П. Нарезкина (отв. секретарь), С. C. Никулина, В. А. Правдивцев, А. С. Соловьев, Н. Ф. Фаращук, А. Г. Шаргородский
Адрес редакции – 214019, Россия, Смоленск, ул. Крупской, 28, тел. (0812) 55-02-75,
Факс: (0812) 52-01-51, E-mail: admuusgma@sci.smolensk.ru
Вестник Смоленской медицинской академии, 2005, № 3
УДК 612.82.015.3:615.322
КЛИНИКО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ НЕЙРОТРОПНОГО ДЕЙСТВИЯ ВОДНОГО ЭКСТРАКТА ТРУТОВОГО ГРИБА ЧАГИ
Е. В. Переверзева1, С. В. Шиманец1, А. А. Антипенко2, Ю. С. Гаркун2, Л. Э. Рожнова2, А. Авад1, С. Г. Пашкевич2, Т. С. Кандыбо2, В. А. Переверзев1 , В. А. Кульчицкий2
1
Белорусский государственный медицинский университет, Минск2
Институт физиологии НАН Беларуси, Минск
В модельных экспериментах на срезах гиппокампа крыс установлено наличие выраженной нейротропной активности у водного экстракта трутового гриба чаги. Она заключается в угнетении образования возбуждающих постсинаптических потенциалов в stratum radiatum области CA1 гиппокампа. В экспериментах “in vivo” установлено достоверное уменьшение длительности латентного периода рефлекса отдергивания хвоста у крыс опытной группы. В исследованиях на больных людях с язвой желудка и/или 12-перстной кишки установлено, что водный экстракт чаги (в виде препарата “Бефунгин") обладает достаточно стойким стимулирующим действием на умственную работоспособность и может быть рекомендован для более широкого использования, в том числе, в качестве средства для коррекции побочных (седативных) эффектов блокаторов Н2-гистаминовых рецепторов. Это действие чаги может быть обусловлено ее влиянием на активность структур гиппокампа
.В течение 50 лет (с 50-х годов прошедшего столетия) в гастроэнтерологии и онкологии применяется водный экстракт трутового гриба чаги (Inonotus obliquus /Pers./ Pilat. f. sterilis). В качестве лекарственных средств из Inonotus obliquus в России и Белоруссии зарегистрированы сам гриб чага (включая плодовые тела и порошок из них) и препараты из него: “Бефунгин” (Befunginum) – водный экстракт, и “Гастрофунгин” - спиртовая настойка на 70%-ном этиловом спирте [8, 9]. В настоящее время их используют в гастроэнтерологии для лечения больных гастритами, при дискинезиях желудочно-кишечного тракта с явлениями атонии, при язве желудка и двенадцатиперстной кишки, а также в онкологической практике как симптоматическое и общетонизирующее средство [8, 9].
Известно, что водный экстракт чаги оказывает выраженное нейротропное (ноотропное) влияние: увеличивает объем кратковременной памяти, ускоряет процессы научения и пропускную способность зрительного анализатора, уменьшает длительность латентного периода и моторного времени сложной сенсомоторной реакции здоровых испытуемых [10, 11, 13]. Рядом исследователей [5, 9] установлено, что введение водного экстракта чаги животным вызывает у них (в частности, у кроликов) повышение температуры
головного мозга, увеличение потребления кислорода, улучшение усвоения навязанного ритма возбуждения в коре больших полушарий, а также повышает их (в частности, мышей) устойчивость к гипоксии. Однако целенаправленного, комплексного изучения нейротропных эффектов трутового гриба чаги не проводилось. Особенности нейротропного действия водного экстракта чаги до сих пор остаются не выясненными. В связи с этим представляло научный и практический интерес изучение клинико-физиологических особенностей нейротропного действия водного экстракта чаги у человека и животных. Их выявление в условиях “in vitro” и “in vivo” и явилось целью нашего исследования.Материалы и методы исследования. Исследования на людях проведены с участием 17-и больных язвой желудка или 12-перстной кишки мужского пола в возрасте от 22-х до 59-и лет при среднем возрасте в опытной группе 39,6 лет, а в контрольной группе — 35,3 года (разница не достоверна /p>0,05/). Диагноз язвенной болезни устанавливался на основании клинико-анамнестических данных и
лабораторно-инструментальных методов исследования. При обследовании больных наряду с обязательными общеклиническими исследованиями проводились: фиброгастродуоденоскопия с биопсией, уреазный тест, исследование секреторной функции желудка. Обследование позволяло провести дифференциальную диагностику и исключить сопутствующие заболевания у пациентов, принятых в опытную и контрольную группы. Медикаментозная терапия проводилась согласно протокола лечения, утвержденного в 6-ой клинической больнице г. Минска для гастроэнтерологического отделения. Все больные контрольной и опытной группы получали блокатор гистаминовых Н2-рецепторов 2-го поколения ранитидин (фирменное название препарата “Гистак”) в дозе по 0,15 г два раза в сутки утром и вечером в сочетании с антацидом алмолом (1 дозированная ложка х 4 раза в сутки). Больным опытной группы, кроме того, назначался бефунгин в дозе 4,5 мл в сутки при разведении теплой кипяченной водой до 100 мл; принимался внутрь в 3 приема (утром, в обед и вечером) за 30 минут до еды.Нейротропная активность водного экстракта чаги (препарат “Бефунгин”) определялась по изменению показателей умственной работоспособности (высших интегративных функций мозга) больных людей, измеряемых с помощью комплекса приборов “ПФК-01”. Тестирование каждого больного проводили 4 раза: при поступлении, а также на 7-й, 14-й, 21-й дни лечения. Отдельные пациенты прошли последнее обследование на фоне амбулаторного приема препаратов. Всего проведено 76 комплексных исследований психофизиологических характеристик больных (из них 68 — в динамике). Каждое тестирование (комплексное исследование) включало в себя определение следующих показателей: объем кратковременной зрительной памяти на двузначные числа; внимание и пропускная способность зрительного анализатора (ПСЗА
) в корректурном тесте с кольцами Ландольта; мышление по результатам решения простых арифметических примеров с однозначными числами; скорость и точность простой и сложной сенсомоторных реакций [2, 6, 7].Опыты in vitro проведены на 7 срезах гиппокампа трех-четырех недельных крысят. Животных декапитировали, извлекали головной мозг и быстро помещали его в охлажденный до 3
° С раствор искусственной цереброспинальной жидкости (ИЦЖ). После начала инкубации удаляли мозжечок и области мозга, прилежащие к гиппокампу. Толщина срезов гиппокампа не превышала 450 мкм. Срезы инкубировали в течение 30 мин при комнатной температуре в растворе ИЦЖ, который насыщали карбогеном (95% O2 и 5% CO2). Установка для регистрации электрической активности нейронов гиппокампа [3, 4] состоит из: камеры, в которой в растворе ИЦЖ находится срез мозга (гиппокампа); системы перфузии, благодаря которой осуществляется смена растворов в камере; системы оксигенирования, насыщающей раствор карбогеном; системы терморегуляции, поддерживающей с помощью элемента Пельтье заданную температуру в камере; системы регистрации и электрической стимуляции.Вызванные ответы регистрировали с помощью игольчатого платино-иридиевого микроэлектрода с размером неизолированной области около 50 мкм. Регистрирующий микроэлектрод размещался внеклеточно в слое stratum radiatum СА1, что позволяло проводить мониторинг постсинаптических потенциалов между телами нейронов и апикальными дендритами СА1 области. Внеклеточную стимуляцию подпороговыми импульсами осуществляли через монополярный платино-иридиевый микроэлектрод с размером неизолированной области около 100 мкм. Поскольку стимуляция осуществлялась подпороговыми импульсами, то основной вклад в формирование вызванных ответов вносил полевой возбуждающий постсинаптический потенциал (пВПСП). Стимулирующий микроэлектрод размещали в слое stratum rаdiatum на границе областей СА1
- СА3. Такое расположение позволяло локально активировать коллатерали Шаффера. С целью нивелирования передачи по коллатералям Шаффера ритмической активности от гигантских пирамидных нейронов СА3 области предварительно осуществляли рассечение ткани мозга на границе областей СА1- СА3. Каждый стимулирующий импульс включал отрицательную и положительную фазы (амплитудой 50 мкА и длительностью 300 мкс). Обычно в исходном состоянии наносили 10- 50 парных стимулов, с межстимульным интервалом в 50 мс и интервалом между парой стимулов в 3 с. Затем на фоне продолжающейся стимуляции, начинали перфузию экстракта трутовых грибов (раствор чаги от 10 мкг/мл до 1000 мкг/мл).В хронических экспериментах in vivo на белых крысах самцах массой тела 260
- 300 г оценивали изменения длительности латентного периода рефлекса отдергивания хвоста (РОХ), уровня артериального давления (Ад) крови и глубокой температуры тела опытных и контрольных животных на первые и седьмые сутки эксперимента. Опытным крысам (n=7) в поилки вместо воды поместили приготовленный водный раствор трутового гриба чаги (1 мл раствора чаги на 100 мл питьевой воды), животным контрольной группы (n=5) в питьевую воду чага не добавлялась. Всех животных содержали в стандартных условиях вивария (температура воздуха 21± 1° С) при свободном доступе к воде/раствору чаги и пище, 12/12-часовом ритме освещения и темноты. Ежесуточное уменьшение объема питьевой воды в поилках в расчете на одну крысу составило 11-13 мл. Это позволило рассчитать ежесуточное потребление экстракта трутового гриба, составившее от 1.1 до 1.3 мг на одно экспериментальное животное.За три недели до эксперимента всех крыс адаптировали к экспериментальным условиям (хендлинг в течение двух-трех дней, затем 9–10 тренировок по 2–4 ч в специальных боксах, в которых животные могли совершать движения вокруг оси и небольшие в ростро-каудальном направлении) [1, 15]. Для нивелирования возможных влияний циркадианных ритмов на регистрируемые показатели наблюдения осуществляли в фиксированное время (9.30–12.00 утра). Регистрацию физиологических показателей у животных проводили в термостатах при температуре 29.9
oС (термонейтральные условия для крыс [15]).Соматический ноцицептивный рефлекс оценивали по величине латентного периода реакции отдергивания хвоста крыс в ответ на термический ноцицептивный стимул (погружение хвоста в воду (49° С) на две трети его длины). Для оценки глубокой температуры тела через анальное отверстие
на глубину 9–10 см в толстую кишку вводили термопару (электротермометр фирмы “Physitemp”, США). Уровень артериального давления регистрировали “манжеточным” способом в регионе хвостовой артерии. Для этого сравнивалось изменение оптической плотности поверхностных тканей хвоста в инфракрасных лучах до и после пережатия хвостовой артерии с помощью пневмоманжеты, соединенной с датчиком давления. В качестве излучателя использовали инфракрасный светодиод АЛ-107, в качестве фотоприемника – фотодиод ФД-256 (Беларусь). Измерения РОХ и Ад регистрировали трижды.Статистическую обработку данных проводили с использованием t-критерия Стьюдента и программы вариационной статистики ANOVA. Различия считали значимыми при Р
< 0.05. На рисунках и в тексте результаты представлены в виде M± m.Результаты и их обсуждение. Исследования на людях показали, что через 2 недели от начала приема бефунгина у больных при 3-ем и 4-ом тестированиях было зарегистрировано повышение умственной деятельности: уменьшалось число ошибок (на 2-4 единицы; р
< 0,05) в тестах “простая и сложная сенсомоторные реакции”; увеличивался объем кратковременной зрительной памяти на двузначные числа (на 12,5 - 17,5%, р< 0,02); улучшалось внимание за счет снижения числа ошибок (на 3,6 - 4,1 %, р< 0,05) и увеличения количества прокорректированных колец Ландольта. Это свидетельствовало об улучшении пропускной способности зрительного анализатора на 0,11 - 0,16 бит/с (р< 0,02) у пациентов опытной группы. У больных контрольной группы вышеперечисленные показатели умственной работоспособности (УР) в динамике лечения по сравнению с исходным уровнем не изменялись или даже повышались. Сумма ошибок по всем использованным тестам наиболее полно характеризует качество умственной работы. По этому показателю нами также была выявлена положительная динамика у больных опытной группы: снижалось общее число ошибок как по отношению к исходному уровню, так и к аналогичному показателю пациентов из контрольной группы, не получавших водный экстракт чаги (рис. 1).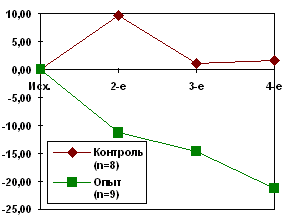
Рис. 1. Динамика умственной работоспособности больных (по изменению суммы ошибок [
D е СО] к исходному ее значению) в опытной и контрольной группах.Пояснения:
1. — различия достоверны по отношению к исходному уровню (p
< 0,02);2. — различия достоверны по отношению к контролю (p
< 0,05);3. n — число больных в группе.
Анализируя результаты исследований высших интегративных функций мозга (ВИФМ) больных людей необходимо включить в сферу своего внимания препараты протокола лечения, на фоне которых проявлял свое стимулирующее действие бефунгин. Как уже указывалось, протокол включал в себя препарат “Гистак”, который мог оказать [2, 8] — и оказал — системное действие на организм пациентов.
В наших исследованиях мы выявили у части больных выраженное влияние гистака на ВИФМ. Так, анализируя динамику психофизиологических показателей больных контрольной группы, мы выявили 2 подгруппы. Показатели УР по сумме ошибок, нарастая в одной подгруппе и снижаясь в другой, к 4-ому исследованию (21-му дню приема препаратов протокола лечения) достигают достоверной разницы, т.е. у части пациентов УР еще снижается, несмотря на позитивную динамику эндоскопической картины. Эти результаты согласуются с имеющимися в литературе [2, 8, 9] многочисленными данными о проявлении побочного действия Н
2-гистаминовых блокаторов. Известно, что препараты этой группы широко назначаются больным для длительного многонедельного приема. Так, по данным Катцунга (1998), количество продаж Н2-гистаминовых блокаторов в мире по сравнению с лекарствами других групп стоит на 1-ом месте и сумма от их реализации достигла 4-х миллиардов долларов США в год. Учитывая побочные эффекты действия этих препаратов в виде угнетения внимания, памяти и других показателей УР, вероятно, необходимо их контролировать соответствующими методиками, так как, например, в наших исследованиях побочные эффекты гистака субъективно и на клиническом уровне не проявлялись. Особенно, актуальным контроль УР становится в условиях амбулаторного лечения пациентов Н2-гистаминовыми блокаторами, которое практикуется шире с каждым годом. Нередко это касается пациентов, специфика труда которых требует высокого уровня всех аспектов УР при длительной и напряженной деятельности. Помимо контроля над указанными аспектами состояния пациентов, представляется целесообразным применение в протоколе лечения препаратов, коррегирующих побочное действие Н2-гистаминовых блокаторов на ВИФМ.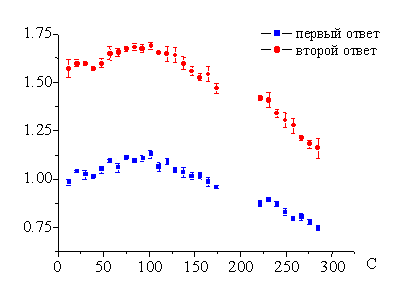
Рис. 2. Особенности возбуждающих постсинаптических потенциалов в СА1 области гиппокампа при парной стимуляции коллатералей Шаффера в условиях перфузии срезов гиппокампа раствором чаги (1000 мкг/мл).
Обозначения: По вертикали представлены искусственно выбранные единицы, полученные в результате нормирования амплитуды вызванных ответов в условиях перфузии срезов раствором чаги на амплитуду ответов в исходном состоянии. По горизонтали представлено время наблюдения в секундах
Водный экстракт чаги (в виде препарата “Бефунгин”), разрешенный к применению в гастроэнтерологии и применяющийся в составе схем лечения язвы желудка и/или 12-перстной кишки, обладает достаточно стойким стимулирующим действием на УР и может быть рекомендован для более широкого использования в том числе в качестве средства для коррекции побочных (седативных) эффектов блокаторов Н
2-гистаминовых рецепторов.Учитывая важную роль нейронов гиппокампа [14] в механизмах памяти, внимания и реализации других ВИФМ в опытах in vitro изучалось влияние водного экстракта чаги на электрическую активность изолированных структур гиппокампа крыс. Как видно из графика, представлено на рис. 2, через 40-45 с после начала перфузии срезов гиппокампа раствором чаги в концентрации 1000 мкг/мл происходит небольшое увеличение амплитуды ВПСП в ответ на оба парных стимула. Начиная со второй минуты перфузии (см. рис. 2, рис 3), амплитуда ВПСП в ответ на парную стимуляцию коллатералей Шаффера начинает прогрессивно уменьшаться. Снижение амплитуды продолжается в течение двух-десяти мин даже после прекращения перфузии срезов раствором чаги (во всех экспериментах продолжительность перфузии составляла три минуты).
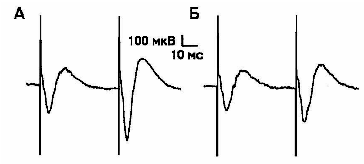
Рис. 3. Изменение амплитуды полевых возбуждающих постсинаптических потенциалов при действии чаги в концентрации 1000 мкг/мл. А – до перфузии раствора чаги, Б – на 180 с перфузии раствора чаги.
При уменьшении концентрации раствора чаги до 10-100 мкг/мл выявляется картина лишь прогрессивного уменьшения амплитуды ВПСП. Так, как представлено на рис. 4, снижение амплитуды ВПСП в ответ на парную стимуляцию коллатералей Шаффера отмечалось на протяжении всего периода перфузии срезов гиппокампа раствором чаги в концентрации 100 мкг/мл. Полученные в опытах in vitro результаты подтверждают ранее высказанное предположение [9, 12] о наличии выраженных нейротропных эффектов экстрактов этого трутового гриба. Поскольку доминирующим эффектом в модельных экспериментах на срезах гиппокампа было создание условий на пре- и постсинаптическом уровне, затрудняющих формирование ВПСП, то можно заключить о несомненном модулирующем влиянии водных экстрактов чаги на синаптические процессы на уровне гиппокампа.
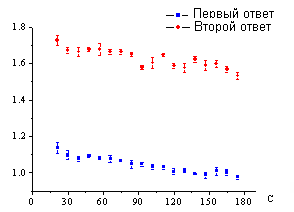
Рис. 4. Особенности возбуждающих постсинаптических потенциалов в СА1 области гиппокампа при парной стимуляции коллатералей Шаффера в условиях перфузии срезов гиппокампа раствором чаги (100 мкг/мл).
Обозначения: По вертикали представлены искусственно выбранные единицы, полученные в результате нормирования амплитуды вызванных ответов в условиях перфузии срезов раствором чаги на амплитуду ответов в исходном состоянии. По горизонтали представлено время наблюдения в секундах
Затруднение формирования ВПСП в stratum radiatum области CA1 гиппокампа, вызываемое экстрактом чаги, может способствовать тому, что в его активности будут преобладать более медленные электрические ритмы (тета-ритм). Тета-ритм [14] отражает участие структур гиппокампа в ориентировочном рефлексе, реакциях настораживания, повышения внимания, процессах памяти, в динамике обучения. Результаты этих исследований “in vitro” согласуются с данными об улучшении под влиянием чаги усвоения навязанного ритма возбуждения нейронами новой коры [5] и их реципроктных отношениях с электрической ритмикой гиппокампа [14]; о предупреждении или ослаблении угнетения поведенческой активности (ориентировочного рефлекса) у подвергнутых иммобилизационному стрессу животных [9, 12]; о повышении внимания (пропускной способности зрительного анализатора) и умственной работоспособности здорового [10, 11, 13] и больного (рис. 1) человека в динамике обучения (повторных тестирований). Полученные данные дают основание полагать, что в повышении внимания, увеличении объема кратковременной и усилении процессов долговременной памяти в условиях применения водных экстрактов чаги важная роль может
принадлежать их модулирующему влиянию на синаптические процессы на уровне гиппокампа.В хронических экспериментах на белых крысах самцах (n=12) показано, что между исходными измерениями функциональных показателей и данными, полученными на седьмые сутки исследования, изменений уровня артериального давления и глубокой температуры тела не обнаружено. В отношении латентного периода рефлекса отдергивания хвоста крыс выявлено его снижение на 7-е сутки наблюдения у группы животных, получавших водный раствор чаги по сравнению с группой крыс, которым в питьевую воду экстракт трутовых грибов не добавлялся. В частности, длительность РОХ в группе крыс, получавших раствор чаги, составляла 3.7?0.2 с /р<0,02/, а в группе контрольных животных – 5.3?0.5 с. Уменьшение латентного периода РОХ позволяет судить об активирующим влиянии экстракта трутового гриба чаги на процессы, протекающие в ЦНС крыс и осуществляющие контроль защитных механизмов организма. Уменьшение под влиянием чаги длительности латентных периодов (но уже сложной сенсомоторной реакции) выявлено нами [11-13] и в исследовании на людях. Наблюдаемое повышение активности нейронов сопровождается увеличением потребления мозгом кислорода и его температуры [5, 9]. В тоже время более раннее и более адекватное включение защитных механизмов приводит к выраженному стресспротекторному, в том числе и антигипоксическому, действию экстрактов чаги [9]. Важная роль в этом может принадлежать структурам гиппокампа, выраженное модулирующее действие на которые оказывает водный экстракт
чаги.Особый интерес представляют данные о двухфазном влиянии больших концентраций водных экстрактов чаги (1 мг/мл или 1000 мкг/мл) на формирование ВПСП (сначала увеличение, а затем угнетение). Можно предполагать, что гипералгезивный эффект чаги по уменьшению длительности РОХ сопряжен с угнетением возможности формирования ВПСП в структурах гиппокампа, в то время как 1-я фаза действия чаги (увеличение амплитуды ВПСП) может сопровождаться гипоалгезией. Это наблюдают в клинике [8, 11], назначая гастроэнтерологическим и онкологическим больным водные экстракты чаги в больших дозах до 1-3 стаканов настоя в день (2500 – 7500 мг/сутки).
Таким образом, полученные данные подтверждают имеющиеся в научной литературе сведения о способности водных экстрактов чаги оказывать выраженное нейротропное действие и дают основание говорить о возможности участия в этом процессе структур гиппокампа, а также зависимости их активности от воздействующей концентрации экстрагированных веществ применяемого препарата.
Работа выполнена в рамках проекта Государственной программы прикладных исследований “Биоанализ и диагностика” (№ госрегистрации 2004/24-87).
Литература
Антипенко А. А., Песоцкая Я. А // Проблемы интеграции функций в физиологии и медицине (к 100-летнему юбилею присуждения Нобелевской премии академику И.П. Павлову): сб. статей под ред. В. Н. Гурина и К. В. Судакова.– Минск. 2004.– С. 32– 33..
УДК 612.127.2+612.111.111.13
ВОЗМОЖНОСТЬ ФАРМАКОЛОГИЧЕСКОЙ КОРРЕКЦИИ КИСЛОРОДТРАНСПОРТНОЙ ФУНКЦИИ КРОВИ
В. В. Зинчук, О. А. Балбатун, Н. В. Зинчук
Гродненский государственный медицинский университет, Беларусь
Целью данной работы является изучение эффекта верапамила, амлодипина, лозартана на сродство гемоглобина к кислороду и деформируемость эритроцитов. Лозартан, как и верапамил, повышал сродство гемоглобина к кислороду, а амлодипин, наоборот, уменьшал. Инкубация крови с верапамилом не изменяла значение индекса деформируемости эритроцитов, а амлодипин и лозартан увеличивали на 25,8 % (р<0,05) и 19,4 % (р<0,02), соответственно, что отражает улучшение микрореологических свойств крови. Проведенные исследования позволили установить возможность изменения кислородсвязующих свойств крови путем фармакологической коррекции данными препаратами, что важно
для формирования адекватного кислородного потока в ткани.Кислородтранспортная функция крови (КТФ) обеспечивает оксигенацию тканей. Среди различных её составляющих важными являются сродство гемоглобина к кислороду (СГК) и деформируемость эритроцитов, нарушение которых лежит в генезе многих патологических процессов. СГК является важным фактором, определяющим доставку кислорода в ткани [5]. Одним из перспективных направлений решения проблемы фармакотерапии гипоксических состояний является разработка методов неингаляционной оксигенотерапии, основанной на регуляции сродства гемоглобина к кислороду [2]. Его изменение является важным фактором компенсации кислородной недостаточности при различных патологических состояниях, а также лежит в основе процессов адаптации к гипоксии. По-видимому, увеличение р50 выше физиологических значений благоприятствует оптимальному транспорту кислорода к тканям в условиях нормоксии или умеренной гипоксии. Показан эффект антагонистов кальция на кислородсвязующие свойства крови [2]. В связи с изложенным представляется важным поиск и разработка различных фармакологических и иных путей коррекции КТФ крови для улучшения кислородного обеспечения тканей.
Цель данной работы заключается в изучении эффекта верапамила, амлодипина, лозартана на СГК и деформируемость эритроцитов.
Материал и методы исследования. Для забора смешанной венозной крови кроликам, в условиях наркоза через v. jugularis externa в правое предсердие вводили катетер и фиксировали его несколькими узловыми швами. Исследуемые пробы крови забирались в предварительно охлажденный и промытый гепарином шприц (50 ED на мл). Влияние фармакологических препаратов на КТФ крови проводили в опытах in vitro. К пробе крови (объем 5 мл) добавляли в каждой отдельной серии 0,1 мл 0,9% раствора NaCl, содержащего верапамил в дозе 400,0 нг/мл, амлодипин в дозе 50,0 нг/мл, лозартан в дозе 50,0 нг/мл, либо только 0,1 мл 0,9% раствора NaCl (контроль), после чего проводили инкубацию образцов крови в водянной бане при температуре 37°С в течение 120 минут.
Величины рО2, рСО2 и рН в исследуемых пробах крови определялись при температуре 37°С с помощью микрогазоанализатора ABL-ЗЗО фирмы "Radiometer". Сродство гемоглобина к кислороду оценивалось по показателю р50, определяемого методом "смешивания" в модификации P. Scheid, M. Меуег [7]. Положение кривой диссоциации оксигемоглобина рассчитывали по полученным значениям р50, используя уравнение Хилла. Применялся эктацитометрический метод оценки деформируемости эритроцитов, основанный на оценке изменения дифракционного паттерна, образующегося после прохождения монохроматических когерентных световых лучей (?=850 нм) через ламинарный поток суспензии эритроцитов в термостатируемх условиях [4]. Уменьшение индекса деформируемости эритроцитов при измерении данным способом отражает ухудшение способности эритроцитов к деформации. Полученные данные статистически обрабатывались общепринятым методом вариационной статистики с использованием критерия Стьюдента.
Результаты и их обсуждение. Проведенные исследования КТФ крови при фармакологической коррекции выявили следующий характер ее изменений (таблица). Исходная величина р50станд имела значение 30,31±0,53 мм рт. ст. Верапамил уменьшал величину р50, до 26,02±0,52 (р<0,05) мм рт. ст. Амлодипин, наоборот, уменьшал сродство гемоглобина к кислороду (р50 возрастал до 32,68±0,77, р<0,02). Положение соответствующих кривых диссоциаций оксигемоглобина приведено на рисунке. Лозартан, как и верапамил повышал сродство гемоглобина к кислороду (р50станд уменьшалось до 27,79±0,72, р<0,02). Исходная величина индекса деформируемости эритроцитов была 0,3±0,016. Инкубация крови с верапамилом не изменяла его значение, а амлодипин и лозартан увеличивали на 25,8 % (р<0,05) и 19,4 % (р<0,02), соответственно, что отражает улучшение микрореологических свойств крови.
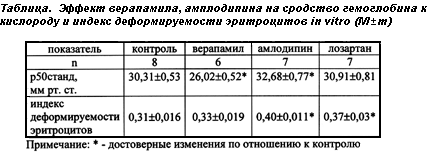
Анализируя полученные данные, следует отметить возможность изменения КТФ в опытах in vitro, механизмы реализации которых, очевидно, основаны на активизации внутриэритроцитарной системы регуляции кислородсвязующих свойств крови. Ее особенности показали тесную взаимосвязь мембранной организации клетки, ее метаболизма, физико-химических параметров внутренней среды и их кислородсвязующих свойств, отражая, таким образом, интегративную деятельность клеток
красной крови при действии на них всей суммы вне- и внутриэритроцитарных возмущений [1]. По-видимому, сдвиги сродства гемоглобина к кислороду при фармакологической коррекции опосредуются путем изменения активности (большей или меньшей) автономной системы регуляции. Важным фактором в поддержании стационарного состояния эритроцитов, возможно, является циркулирующий в крови г/АМФ, который при активации в тканях аденилатциклазной системы поступает в кровоток и может стимулировать гликолитические процессы в эритроцитах.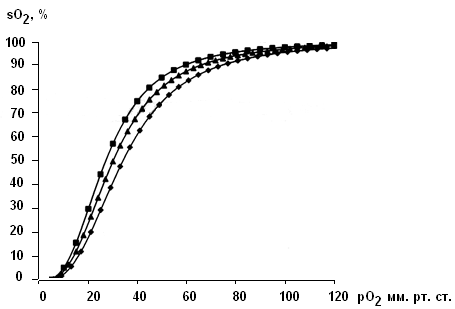
Рис. Кривые диссоциации оксигемоглобина при инкубации крови с амлодипином (¦) и верапамилом (¦). Контроль (^)
Иерархически зависимая в силу своей относительности от условий циркуляции крови, определяемых более высокими уровнями регуляции системы транспорта кислорода, внутриэритроцитарная автономная система обеспечивает адаптивное поведение кислородсвязующих свойств крови в отдельных органах, при перестройке характера функционирования системы транспорта кислорода на различных ее уровнях. Представленные данные об адаптивности поведения кислородсвязующих свойств крови отражают ее функционирование в условиях целого организма и являются убедительным аргументом в пользу правильности логического и конструктивного построения автономной системы регуляции свойств крови. Также следует учитывать, что КТФ крови участвует в поддержании прооксидантно-антиоксидантного равновесия в организме при окислительном стрессе.
Нормальные эритроциты способны значительно деформироваться, не меняя при этом своего объёма и площади поверхности [3]. Эта особенность движения эритроцитов в потоке имеет чрезвычайно важное значение для поддержания оптимальности процессов диффузии газов. Показано, что при улучшении способности эритроцитов к деформации повышается перенос в ткани кислорода, а при ухудшении – поступление кислорода в ткани снижается, тканевое рО
2 падает [6]. Деформируемость эритроцитов участвует в формировании адекватного потока кислорода в ткани в соответствии с их потребностью в нем, а его ухудшение содействует перераспределению использования кислорода с оксидазного пути на оксигеназный.Проведенные исследования позволили установить возможность изменения кислородсвязующих свойств крови, и прежде всего, путем фармакологической коррекции данными препаратами КТФ, что очень важно для формирования адекватного кислородного потока в ткани и может быть использовано для разработки основных путей воздействия на кислородный режим организма.
Литература
УДК 831-616 005. 98 + 615. 015
Сравнительное действие атипичных нейролептиков клозапина и сульпирида на развитие токсического и компрессионного отека-набухания головного мозга
И.А. Платонов, Т.А. Андреева
Смоленская государственная медицинская академия
Отек-набухание головного мозга (ОНГМ) является многокомпонентным процессом, в котором участвуют практически все морфофункциональные системы организма.
Повышение эффективности фармакотерапии данного патологического процесса - одна из актуальных проблем современной медицины. В спектре противоотечного действия препаратов, применяемых для коррекции ОНГМ, существенным является их влияние на нейромедиаторные и иммунные процессы. По данным литературы таким действием обладают типичные нейролептики [5]. В тоже время в литературе отсутствуют данные по изучению влияния атипичных нейролептиков на формирование ОНГМ. Атипичные нейролептики также способны влиять на нейромедиаторные и иммунные процессы в головном мозге, но по спектру действия они отличаются от типичных нейролептиков. Кроме того, препараты этой фармакологической группы вызывают значительно меньшие нейросоматические осложнения по сравнению с типичными нейролептиками [1, 5, 7]. В связи с этим представляет интерес исследовать противоотечную активность атипичных нейролептиков при моделировании ОНГМ.
Целью исследования явилось изучение противоотечной активности атипичных нейролептиков клозапина (азалептина) и сульпирида на моделях токсического (ТОНГМ) и компрессонного (КОНГМ) ОНГМ.
Таблица 1. Изменение физических параметров (влажность и плотность) мозговой ткани под влиянием клозаина и сульпирида при развитии ТОНГМ (n=10 |
|||||||
словия экспери- |
п/ш моз- |
Содержание
общей воды |
Плотность
мозговой ткани |
||||
мента |
Га |
Sx |
± Mx |
Р |
Sx |
± Mx |
Р |
Интакт- |
Л |
78.435 |
0.12275 |
1.0428 |
0.00013 |
||
ные |
П |
78.244 |
0.18981 |
> 0.05 |
1.0427 |
0.00015 |
>0.05 |
ТОНГМ |
Л |
79.737 * |
0.08891 |
1.0387 * |
0.00026 |
||
(модель) |
П |
79.878 * |
0.20254 |
>0.05 |
1.0388 * |
0.00024 |
>0.05 |
На фоне действия клозапина: |
|||||||
1 мг/кг |
Л |
80.337 * |
0.2699 |
1.0397 * |
0.00015 |
||
П |
80.597 * |
0.2955 |
>0.05 |
1.0396 * |
0.00014 |
>0.05 |
|
2.5 мг/кг |
Л |
79.915 * |
0.1372 |
1.0397 * |
0.00011 |
||
П |
80.247 * |
0.2998 |
>0.05 |
1.0397 * |
0.00016 |
>0.05 |
|
5 мг/кг |
Л |
78.804 |
0.1550 |
1.0401 |
0.00012 |
||
П |
79.064 |
0.2115 |
>0.05 |
1.0400 |
0.00074 |
>0.05 |
|
7.5 мг/кг |
Л |
79.639 * |
0.3146 |
1.0400 |
0.00024 |
||
П |
79.998 * |
0.2979 |
>0.05 |
1.0405 |
0.00015 |
>0.05 |
|
На фоне действия сульпирида: |
|||||||
7.5 мг/кг |
Л |
80.954 * |
0.2841 |
1.0389 |
0.00018 |
||
П |
80.964 * |
0.2144 |
>0.05 |
1.0388 |
0.00020 |
>0.05 |
|
15 мг/кг |
Л |
79.141 * |
0.1990 |
1.0395 |
0.00016 |
||
П |
79.667 * |
0.2920 |
>0.05 |
1.0394 |
0.00016 |
>0.05 |
|
30 мг/кг |
Л |
80.791 * |
0.2363 |
1.0396 |
0.00015 |
||
П |
80.633 * |
0.3328 |
>0.05 |
1.0395 |
0.00026 |
>0.05 |
|
Примечание. Р - достоверность межполушарных различий.
* - достоверность различий с показателями интактных животных при р Ј 0.05.
Материалы и методы исследования. В работе использованы белые крысы линии Вистар обоего пола массой 140 – 200 г, содержащихся в обычных условиях вивария. Исследование проводили на моделях ОНГМ, предложенным Laborit, Weber [9]. Клозапин вводили внутрь, а сульпирид внутрибрюшинно за полтора часа до введения токсического фактора. При моделировании КОНГМ препараты вводились ежедневно в течение 7 суток. Состояния тканей головного мозга оценивали по физическим параметрам: влажности и плотности. Достоверными считались результаты при уровне значимости р
Ј 0.05 [8].Результаты и их обсуждение. Показатели содержания воды и плотности мозговой ткани
(табл. 1, 2) интактных животных и при формировании ТОНГМ и КОНГМ соответствуют литературным данным [2,3]. На модели ТОНГМ при введении клозапина в дозе 7.5 мг/кг показатели влажности мозговой ткани остаются повышенными (р< 0.05), а показатели плотности ткани мозга не отличаются от соответствующих показателей интактной группы (р> 0.05). В дозе 5 мг/кг (табл. 1) происходит нормализация показателей влажности и плотности ткани мозга (р< 0.05).Результаты и их обсуждение. Показатели содержания воды и плотности мозговой ткани (табл. 1, 2) При дальнейшем снижение дозы препарата до 2.5 мг/кг исследуемые физические параметры соизмеримы с соответствующими параметрами на модели ТОНГМ (р
> 0.05), а дозе 1 мг/кг влажность мозговой ткани достоверно еще более повышается, что свидетельствует о синергизме с действием эдематозного фактора. (р< 0.05). При введении клозапина в интервале исследованных доз (р> 0.05) межполушарная асимметрия по исследуемых физическим параметрам не выявлена. Таким образом, на основании проведенных исследований следует отметить, что на модели ТОНГМ клозапин в дозе 5 мг/кг обладает противоотечной активностью, а в дозе 1 мг/кг усиливает действие эдематозного фактора.При введении сульпирида в дозе 15 мг/кг ( табл. 1) показатели влажности и плотности ткани мозга не отличаются от соответствующих показателей на модели ТОНГМ (р
> 0.05). В дозах 7.5 и 30 мг/кг влажность ткани мозга достоверно повышается, а плотность снижается по сравнению с моделью (р< 0.05), что свидетельствует о синергизме с эдематозным фактором. При действии сульпирида в интервале исследованных доз межполушарная асимметрия по исследуемых физическим параметрам не выявлена (р> 0.05).На модели КОНГМ (табл. 2) клозапин обладает противоотечной активностью в дозе 2.5 мг/кг, так нормализует физические параметры мозговой ткани. В дозах 1 и 5 мг/кг препарат достоверно повышает влажность и снижает плотность ткани мозга, что соответствует показателям на модели КОНГМ. При действии клозапина межполушарная асимметрия по параметрам влажности выявлена только в дозе 2.5 мг/кг (р
< 0.05). Под влиянием сульпирида в дозах 2.5 и 7.5 мг/кг на модели КОНГМ наблюдается достоверное повышение влажности и снижение плотности ткани мозга по сравнению с моделью, что свидетельствует о синергизме с действием эдематозного фактора. При этом в дозе 2.5 мг/кг наблюдается межполушарная асимметрия (р< 0.05) по показателю влажности мозговой ткани.Анализ полученных данных показал, что особенностью противоотечного действия клозапина на исследованных моделях ОНГМ по показателю влажности мозговой ткани является наличие нелинейной зависимости “доза-эффект”. Показатели плотности ткани мозга при действии препарата на модели ТОНГМ изменяются прямолинейно, а на модели КОНГМ также нелинейно. Это свидетельствует о дозозависимом механизме действия препарата. Такая нелинейная зависимость отображается U-образной кривой. Точкой инверсии кривой “доза-эффект” является доза, оказывающая наибольшее противоотечное действие. Такой же тип зависимости установлен авторами для иммуномодулирующих препаратов пептидного строения, применяемых для коррекции ОНГМ [5,6] . Сходство данных эффектов по -видимому, является не случайным. Анализ литературных данных показал, что клозапин также обладает иммунотропной активностью [10]. Так, препарат повышает уровень интерлейкина-2 (ИЛ-2), который является одним из общих медиаторов клеток иммунной системы и клеток ткани мозга. В связи с этим, следует предположить иммунотропный компонент в противоотечном действии клозапина. По данным литературы препарат влияет на нейромедиаторные системы мозга: блокирует 5-НТ2а
- серотониновые в три раза активнее, чем D2- дофаминовые рецепторы. Такое соотношение нейромедиаторных механизмов действия клозапина беспечивает противоотечный эффект и минимальное количество соматических осложнений. Это подтверждается данными литературы о том, что при стимуляции серотониновых рецепторов имипрамином, не только не проявляют противоотечные свойства, но, и усиливается развитие ОНГМ [6]. В противоотечном действии клозапина играют определенную роль М-холиноблокирующее и ?-??реноблоктрующее действие препарата. В отличие от клозапина, сульпирид является атипичным нейролептиком с другим нейромедиаторным спектром действия. Для этого препарата характерна блокада всех типов дофаминовых и серотониновых рецепторов в равном соотношении. При этом препарат не обладает противоотечным действием, а, наоборот, усиливает влияние эдематозного фактора на обеих моделях ОНГМ. Таким образом, модуляция нейромедиаторных систем ведет к изменению иммунных реакций. Все перечисленные нейромедиаторные системы, на которые влияют исследованные препараты, вносят определенный вклад в функцию нейроиммунной системы. Такой механизм, в отличие от типичных нейролептиков, обусловлен селективной блокадой серотониновых рецепторов, что способствует не только изменению метаболических процессов в клетках нервной системы, но изменяет нейроиммунные реакции ткани головного мозга.
Таблица 2. Изменение физических параметров (влажность и плотность) мозговой ткани под влиянием клозапина и сульпирида при развитии КОНГМ (n=10). |
|||||||||
Условия экспери- |
п/ш моз- |
Содержание общей воды в % |
Плотность мозговой ткани |
||||||
мента |
га |
Sx |
± Mx |
Р |
Sx |
± Mx |
Р |
||
Интакт- |
Л |
78.435 |
0.1227 |
1.0428 |
0.0001 |
||||
ные |
П |
78.241 |
0.1898 |
> 0.05 |
1.0427 |
0.0001 |
>0.05 |
||
КОНГМ |
л |
79.425 * |
0.2001 |
1.0372 * |
0.0001 |
||||
(модель) |
п |
79.462 * |
0.2302 |
>0.05 |
1.0373 * |
0.0001 |
>0.05 |
||
На фоне действия клозапина: |
|||||||||
1 мг/кг |
л |
79.537 * |
0.3802 |
1.0393 * |
0.0002 |
||||
п |
80.159 * |
0.2281 |
>0.05 |
1.0392 * |
0.0001 |
>0.05 |
|||
2.5 мг/кг |
л |
78.014 |
0.3382 |
1.0400 |
0.0002 |
||||
п |
79.065 |
0.2590 |
< 0.05 |
1.0400 |
0.0002 |
>0.05 |
|||
5 мг/кг |
л |
79.753 * |
0.3103 |
1.0392 * |
0.0001 |
||||
п |
79.481 * |
0.5001 |
>0.05 |
1.0391 * |
0.0002 |
>0.05 |
|||
На фоне действия сульпирида: |
|||||||||
2.5 мг/кг |
л |
80.736 * |
0.3110 |
1.0380 * |
0.0002 |
||||
п |
80.119 * |
0.2250 |
< 0.05 |
1.0380 * |
0.0002 |
>0.05 |
|||
7.5 мг/кг |
л |
80.335 * |
0.3375 |
1.0393 * |
0.0002 |
||||
п |
80.204 * |
0.2671 |
>0.05 |
1.0392 * |
0.0001 |
>0.05 |
|||
Примечание: P - критический уровень достоверности межполушарных различий (95%)
* - достоверность различий с показателями интактных животных при p Ј 0.05.
Литература
УДК 612.017.1:
612.57Иммунология экзогенной гипертермии
А. С. Соловьёв, О. Д. Просцевич
Смоленская государственная медицинская академия
В работе представлены материалы многолетних исследований авторов по влиянию экзогенной гипертермии на функции иммунной системы.
Высокая температура внешней среды является неблагоприятным физическим фактором, который часто действует на организм человека в естественных условиях, обстановке специфического производства и приводит к нарушению состояния различных органов и систем [2].
Методы исследования
В опытах использовали мышей-гибридов первого поколения (СВА-С57В1/6)F1. Перегревание животных осуществлялось в тепловой камере при 43 – 44°С. Острое перегревание сводилось к однократному пребыванию животных в тепловой камере до ректальной температуры 42°С и стадии теплового удара (ректальная температура 43 – 43.5°С). Длительное прерывистое перегревание животных проводилось путем ежедневного пребывания мышей в камере в течение 20 мин. Животные подвергались тепловому воздействию 3, 5, 10, 20, 30, 40 дней. Ректальная температура при первом перегревании составляла в среднем 42°С. Для оценки клеточного иммунитета использовали определение пролиферативной активности клеток селезенки (КС) в ответ на стимуляцию аллоантигенами [1] и поликлональными Т-клеточными митогенами фитогемагглютинином (ФГА) и конканавалином А (КонА) [6]. Изучение гуморального иммунного ответа проводили при исследовании пролиферативной активности КС в ответ на стимуляцию В-клеточными митогенами липополисахаридом (ЛПС) и митогеном лаконоса (МЛ), а также числа антителообразующих клеток (АОК) в селезенке на 5-е сутки после введения антигена [8]. Регистрацию клеточного ответа осуществляли по включению 3Н-тимидина в ДНК пролиферирующих клеток с вычислением индекса стимуляции (ИС):
![]()
Серии опытов при исследовании пролиферативного ответа КС и числа АОК составляли 6-15 животных. Определение колониеобразующих функций стволовых кроветворных клеток костного мозга определяли методом экзогенного клонирования [9]. Активность естественных киллерных клеток (ЕКК) селезёнки, определяли в цитотоксическом тесте по высвобождению
51Cr из меченых клеток мышиной Т-клеточной лимфомы JAC-1 [4]. Фагоцитарную активность перитонеальных макрофагов определяли по отношению к золотистому стафилококку штамм 209 в условиях культуры клеток [5]. Учитывали процент участвующих в фагоцитозе макрофагов (фагоцитарное число — ФЧ), число бактерий, содержащихся в 1 макрофаге (фагоцитарный индекс — ФИ). Завершенность фагоцитоза определяли по убыли внутриклеточных бактерий через 90 мин после инкубации и выражали в процентах (индекс завершенности фагоцитоза — ИЗФ). Продукцию лимфоцитактивирующих факторов (ЛАФ) макрофагами определяли по способности супернатантов инкубированных клеток оказывать комитогенное действие на пролиферативную активность тимоцитов мышей, стимулированных субоптимальной дозой конканавалина А [7].
Результаты исследования
При остром перегревании животных до ректальной температуры 42°С наблюдалось повышение способности КС отвечать на стимуляцию аллоантигенами и Т-клеточными митогенами ФГА и КонА, а также митогеном лаконоса (табл.1). Повышалась функциональная активность перитонеальных макрофагов, на что указывало увеличение ФЧ, ФИ и секреции ЛАФ макрофагами при стимуляции клеток липополисахаридом (табл. 2).
Таблица 1. Пролиферативный ответ КС, число АОК, содержание колониеобразующих единиц селезёнки, активность естественных киллеров при остром перегревании (M ± m)
Показатель |
Серия опытов |
|||
Перегревание до 42° С |
Перегревание до теплового удара |
|||
контроль |
опыт |
контроль |
опыт |
|
Пролиферативный ответ на: |
||||
ФГА |
6.53±0.41 |
9.61±0.92* |
9.85±0.47 |
1.37±0.26* |
Кон А |
13.03±0.71 |
17.41±1.70* |
18.01±0.59 |
2.06±0.56* |
Аллоантигены |
37.00±4.78 |
71.89±13.35* |
58.72±19.24 |
6.09±4.15* |
ЛПС |
3.07±0.34 |
3.82±0.54 |
4.94±0.55 |
1.13±0.17* |
МЛ |
3.95±0.30 |
5.13±0.40 |
7.33±0.69 |
1.35±0.16* |
Число АОК на 106 КС |
433.6±22.3 |
462.8±40.1 |
383.0±56.7 |
209.1±23.9* |
КОЕ (с) |
16.45±1.01 |
16.63±0.77 |
16.45±1.01 |
9.09±0.45* |
ЕКК |
22.00±1.50 |
8.70±1.20* |
22.00±1.50 |
5.70±1.50* |
Примечание
. Здесь и в табл.3 данные о пролиферативной активности представлены в индексах стимуляции. Результаты экзогенного клонирования представлены количеством макроколоний на селезенку. Результаты активности ЕКК представлены в виде ИЦ (в %). * – различия достоверны по сравнению с контролем.Перегревание мышей до теплового удара сопровождалось резким подавлением пролиферативной активности КС в ответ на стимуляцию Т- и В-клеточными митогенами, аллоантигенами, цитотоксической активности ЕКК и уменьшением количества АОК в селезенке. Тепловой удар приводил к подавлению фагоцитарной активности макрофагов, снижались ФЧ, ФИ и ИЗФ. Депрессия функциональной активности клеточных популяций при тепловом ударе является в значительной степени результатом непосредственного цитотоксического действия высокой температуры на клетки.
Тепловой удар индуцирует продукцию макрофагами мышей лимфоцитактивирующих факторов, важнейшим компонентом которых является ИЛ-1. Этот эффект, по-видимому, опосредуется тепловым стрессом, поскольку различные виды стресса оказывают стимулирующее влияние на продукцию ЛАФ, в том числе интерлейкина-1, макрофагами [3].
Табл. 2. Фагоцитарная и ЛАФ-активность макрофагов при остром перегревании животных (M
± m)Показатель |
Перегревание до 42° С |
Перегревание до теплового удара |
|||
контроль |
опыт |
контроль |
опыт |
||
ФЧ |
90.88±0.58 (8) |
95.00±0.65* (8) |
88.62±0.98 (8) |
74.25±2.73* (8) |
|
ФИ |
2.99±0.09 (8) |
3.59±0.14* (8) |
2.94±0.09 (8) |
1.77±0.14* (8) |
|
ИЗФ |
38.9±4.14 (8) |
44.9±2.25 (8) |
38.0±4.37 (8) |
5.21±2.12* (8) |
|
Л А Ф |
Без стимуляции (ЛПС) |
2240±66.75 (7) |
2135±43.80 (7) |
2224±98.47 (8) |
3408±406.29* (8) |
После стимуляции (ЛПС) |
4635±120.3 (7) |
7106±186.76* (7) |
4606±143.45 (7) |
8557±464.28* (9) |
|
Примечание. Здесь и в табл.4 ФЧ – фагоцитарное число, ФИ – фагоцитарный индекс, ИЗФ – индекс завершенности фагоцитоза, ЛАФ-активность представлена в имп/мин, */ - различия достоверны по сравнению с контролем, в скобках – число животных в группе.
Длительное прерывистое перегревание животных характеризовалось изменением функциональной активности лимфоцитов и макрофагов, степень и направленность которого зависела от срока перегревания (табл.3, 4). Прерывистое перегревание мышей в течение 3 суток не приводило к явным нарушениям реакций клеточного и гуморального иммунитета. Однако выявлено подавление цитотоксической активности естественных киллеров, снижение ФЧ и ФИ.
Таблица 3. Пролиферативный ответ КС, число АОК, содержание колониеобразующих единиц селезёнки, активность ЕКК при длительном прерывистом перегревании (M ± m)
| Показатель | Срок исследований, сут. | |||||
| 3 | 5 | 10 | ||||
| контроль | Опыт | контроль | опыт | контроль | опыт | |
| Пролиферативный ответ ФГА | 11.17±1.08 | 14.67±1.61* | 4.88±0.66 | 7.85±1.81 | 11.85±1.66 | 6.83±1.45* |
| КонА | 10.79±0.93 | 12.56±1.09 | 11.38±1.52 | 13.49±1.84 | 22.34±2.22 | 12.49±1.93* |
| Аллоантигены | 14.72±2.42 | 20.48±4.37 | 12.85±3.97 | 19.27±3.29 | 54.16±9.47 | 28.59±7.47* |
| ЛПС | 2.82±0.29 | 3.17±0.30 | 3,17±0.36 | 3.36±0.35 | 3.71±0.18 | 1.62±0.15* |
| МЛ | 5.02±0.33 | 6.29±0.91 | 4.55±0.58 | 4.89±0.34 | 5.66±0.46 | 3.80±0.18* |
| Число АОК на 106 КС | 499.0±29.3 | 579.8±33.1 | 571.0±48.5 | 317.0±92.8* | 494.6±21.6 | З67.6±55.9* |
| КОЕ (с) | 20.30±1.29 | 21.00±1.06 | 20.30±1.29 | 18.8±1.34 | 16.18±0.87 | 16.60±1.21 |
| ЕКК | 22.00±1.50 | 7.20±1.50* | 22.00±1.50 | 8.70±1.50* | 22.00±1.50 | 16.80±2.10* |
| Показатель | 20 | 30 | 40 | |||
| контроль | Опыт | контроль | опыт | контроль | опыт | |
| Пролиферативный ответ ФГА | 5.68±0.33 | 4.52±0.31* | 6.94±1.33 | 5.40±0.50 | 13.83±2.19 | 13.69±2.24 |
| КонА | 17.45±1.12 | 12.25±1.50* | 13.68±1.37 | 8.48±0.84* | 25.49±3.58 | 21.06±3.82 |
| Аллоантигены | 30.70±5.40 | 15.07±4.81* | 39.58±8.43 | 9.17±4.10* | 55.35±20.04 | 48.97±15.48 |
| ЛПС | 3.49±0.28 | 2.29±0.31* | 3.41±0.25 | 2.51±0.24* | 6.04±0.83 | 4.63±0.75 |
| МЛ | 5.33±0.41 | 3.19±0.26* | 5.83±0.37 | 5.01±0.21* | 4.79±0.23 | 4.97±0.72 |
| Число АОК на 106 КС | 570.4±66.2 | 174.7±38.1* | 445.0±29.7 | 431.6±24.8 | 393.8±25.6 | 420.8±16.5 |
| КОЕ (с) | 16.18±0.87 | 15.40±0.92 | 15.50±1.09 | 16.75±1.09 | 15.50±1.09 | 16.30±0.86 |
| ЕКК | 22.00±1.50 | 20.60±1.70 | 22.00±1.50 | 21.40±0.50 | ||
Перегревание мышей в течение 5 суток сопровождалось уменьшением числа АОК в селезенке, подавлением цитотоксической активности ЕКК селезенки. 5 – дневное перегревание животных характеризовалось уменьшением ФЧ, ФИ и ИЗФ макрофагов, а также способности перитонеальных макрофагов продуцировать ЛАФ.
Влияние высокой внешней температуры на животных в течение 10 и 20 дней приводило к развитию выраженной иммуносупрессии, к депрессии фагоцитарной активности макрофагов, о чем свидетельствовало угнетение пролиферативной активности КС в ответ на стимуляцию митогенами и аллоантигенами, уменьшение числа АОК в селезенке, снижение ФЧ, ФИ и ИЗФ. Десяти- и двадцатидневное перегревание приводило к угнетению продукции ЛАФ перитонеальными макрофагами. Через 10 дней от начала перегревания оставалась сниженной литическая активность ЕКК селезенки животных.
Таблица. 4. Фагоцитарная и ЛАФ-активность макрофагов при длительном перегревании животных (М ± m)
Показатель |
Срок наблюдений, сут. |
|||||||
3 |
5 |
10 |
||||||
контроль |
Опыт |
контроль |
опыт |
контроль |
опыт |
|||
ФЧ |
91,25±0,53 (8) |
87,25 ± 1,51* (8) |
90,00 ± 0,38 (8) |
84,25 ± 0,79* (8) |
88,75 ± 0,37 (8) |
66,25 ±1,44* (8) |
||
ФИ |
2,69 ±0,05 (8) |
2,26 ±0,15* (8) |
2,79 ± 0,08 (8) |
1,62 ± 0,06* (8) |
2,69 ± 0,04 (8) |
1,00 ± 0,04* (8) |
||
ИЗФ |
44,7±2,2 (8) |
40,1 ± 4,4 (8) |
48,2 ± 2,38 (8) |
17,4 ± 3,69* (8) |
43,7±1,17 (8) |
18,7 ± 3,54* (8) |
||
Л А Ф |
Нестимулированные ЛПС |
2302±88.7 (8) |
2295±98.2 (8) |
2302±88.7 (8) |
2235±97.7 (8) |
2427±103 (8) |
2305±75.5 (8) |
|
| Стимулированные ЛПС | 4259±158 (7) |
3836±253 (8) |
4259±158 (7) |
2786±141* (8) |
4341±91 (8) |
2171±8* (8) |
||
Показатель |
20 |
30 |
40 |
|||||
контроль |
Опыт |
контроль |
опыт |
контроль |
опыт |
|||
ФЧ |
90,00 ±0,53 (8) |
80,75 ±0,84* (8) |
91,25 ±0,52 (8) |
88,50 ± 0,32* (8) |
89,00 ± 0,37 (8) |
87,75 ± 0,59 (8) |
||
ФИ |
2,58 ±0,09 (8) |
1,44 ±0,05* (8) |
2,94 ±0,17 (8) |
1,67 ± 0,08* (8) |
2,48 ± 0,05 (8) |
2,53 ± 0,12 (8) |
||
ИЗФ |
37,3 ± 1,02 (8) |
21,5 ± 1,52* (8) |
46,0 ± 3,03 (8) |
27,3 ± 3,27* (8) |
42,2 ± 1,98 (8) |
45,0 ± 3,13 (8) |
||
Л А Ф |
Нестимулированные ЛПС |
2427±103 (8) |
2292±67.5 (8) |
2259±91.5 (8) |
2117±184 (7) |
2259±184 (8) |
2340±113 (6) |
|
Стимулированные ЛПС |
4341±91 (8) |
2267±149* (8) |
4531±357 (7) |
3019±185* (8) |
4531±357 (7) |
4476±121 (6) |
||
Перегревание мышей в течение 30 дней сопровождалось восстановлением некоторых реакций иммунитета. Так не отмечалось изменений количества АОК в селезенке, восстанавливался пролиферативный ответ КС на стимуляцию ФТА, сохранялась на уровне контроля цитотоксическая активность ЕКК селезенки. В то же время через 30 дней от начала перегревания животных оставалась сниженной пролиферативная активность КС в ответ на стимуляцию аллоантигенами, КонА, ЛПС, митогеном лаконоса, фагоцитарная функция перитонеальных макрофагов и продукция ЛАФ макрофагами.
В процессе длительного прерывистого перегревания животных иммунологические реакции, функции перитонеальных макрофагов восстанавливались по мере адаптации животных к дозированному тепловому воздействию. Об этом свидетельствовало возвращение к норме пролиферативной активности клеток селезенки в ответ на стимуляцию В- и Т-клеточными митогенами, фагоцитарной активности макрофагов и способности их продуцировать лимфоцитактивирующие факторы, а также сохранение на уровне контроля числа АОК, цитотоксической активности ЕКК селезенки через 40 дней от начала перегревания.
Восстановление функций иммунной системы и системы мононуклеарных фагоцитов коррелировало по времени с уменьшением уровня гипертермии тканей организма, развивающейся при тепловом воздействии. Подъем ректальной температуры у животных при 40-дневном перегревании снижался в среднем на 2°С по сравнению с первым тепловым воздействием.
Таким образом, действие на организм высокой температуры внешней среды приводит к существенным изменениям иммунологических реакций и функции макрофагов. Наблюдаемые изменения следует рассматривать, по-видимому, как результат стрессорного воздействия перегревания на организм и как следствие непосредственного повреждающего
влияния гипертермии на ткани. Начальный период однократного воздействия теплового фактора характеризуется повышением функциональной активности лимфоцитов и макрофагов на фоне острой стресс-реакции, характеризующейся мобилизацией защитных сил организма. Более длительное действие тепла приводит к развитию теплового удара, сопровождающегося резким нарушением функции иммунокомпетентных клеток. В процессе длительного прерывистого перегревания формирование устойчивой долговременной адаптации животных к тепловому воздействию сопровождается восстановлением функций иммунной системы. В восстановлении иммунологических реакций организма в процессе тепловой адаптации определяющую роль играет, очевидно, сохранение функционирования стволовых кроветворных клеток костного мозга – предшественников иммуноцитов и значительное уменьшение степени гипертермии тканей при тепловой тренировке.Литература
УДК 616-001.8:615.355
ИЗМЕНЕНИЕ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА У ЖИВОТНЫХ НА ФОНЕ ВВЕДЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ЦИНКА (II) И N-АЦЕТИЛЦИСТЕИНА
А. В. Евсеев, В. А. Правдивцев, Д. В. Сосин, М. А. Евсеева, Л. А. Ковалёва, Н. М. Осипов
Смоленская государственная медицинская академия
На примере нового антигипоксанта
p Q-901 показано, что защитное действие комплексных соединений Zn(II) и N-ацетилцистеина при развитии экзогенной острой гипоксии у мышей сопровождается выраженным уменьшением величины стандартного энергетического обмена. В опытах на крысах показано, что антигипоксический эффект указанных веществ обусловлен их способностью оказывать угнетающее влияние на процессы окисления биологических субстратов в митохондриях.В комплексе мероприятий по выживанию в условиях дефицита кислорода, помимо средств индивидуальной защиты и предварительной гипоксической тренировки, используются лекарственные агенты, обладающие антигипоксическим действием [1,4]. Защитный эффект лекарственных веществ в условиях гипоксии нередко обусловлен изменением (как правило, понижением) энергетического статуса организма [7]. Ранее в опытах на мышах нами было показано, что вещества под шифром p Q-901 и p Q-1104, представляющее собой комплексные соединения Zn(II) и N-ацетилцистеина, при в/б введении в дозе 50 мг/кг повышают устойчивость животных к экзогенной острой гипоксии в 4-5 раз [2]. Антигипоксическое действие названных веществ сопровождалось существенным снижением ректальной температуры (на 7 – 8оС) что, вероятно, связано с уменьшением производства энергии в тканях [3].
Целью работы явилось: 1) изучение влияния нового антигипоксанта p Q-901 (комплексное соединение Zn(II) и N-ацетилцистеина) на величину стандартного энергетического обмена (СтЭО) у мышей; 2) поиск возможных механизмов защитного действия веществ этой группы при экзогенной острой гипоксии.
Материалы и методы исследования. Опыты выполнены на 20 белых лабораторных мышах-самцах массой 20-25 г и 28 белых лабораторных крысах-самцах массой 150-180 г. Потребление кислорода мышами контрольной и опытной групп оценивали по методу Холдена [7], адаптированному нами для решения поставленной задачи. Полученные данные использовали для расчета СтЭО по Крогу. За 30 мин до измерения СтЭО мышам опытной группы в/б вводили p Q-901 (50 мг/кг). У всех мышей измеряли ректальную температуру исходно и через 90 мин после введения p Q-901. В ходе эксперимента у мышей непрерывно регистрировали ЭКГ с помощью оригинальных электродов и усилителя биопотенциалов, сопряженного с лабораторной ЭВМ. Процессы окислительного фосфорилирования в митохондриях головного мозга изучали по стандартной методике, описанной в работе А. Н. Шарова [6]. После декапитации из мозговой ткани методом дифференциального центрифугирования выделяли митохондрии, в которых полярографически с помощью закрытого электрода Кларка, определяли состояние окислительного фосфорилирования. В качестве субстрата окисления использовали глутамат натрия. По данным полярограммы рассчитывали скорость дыхания митохондрий в различных метаболический состояниях (V0 – скорость окисления субстрата, V3 – скорость фосфорилирующего окисления, V4 – скорость окисления после фосфорилирования), скорость разобщенного дыхания (VДНФ). Также рассчитывали показатели, характеризующие сопряжение процессов окисления и фосфорилирования в митохондриях: дыхательный контроль по Ларди и Уэллману (ДКЛУ =V3/V0), дыхательный контроль по Чансу и Уильямсу (ДКЧУ =V3/V4), коэффициент АДФ/О, стимуляцию дыхания 2,4-динитрофенолом (ДНФ=VДНФ/V4), скорость фосфорилирования добавки АДФ (АДФ/t). Скорости дыхания митохондрий выражали в наног-атомах О2 за 1мин в расчете на 1 мг белка митохондрий. АДФ/t выражали в нмолях АДФ за 1 мин на 1 мг белка. Полученные данные обрабатывали с помощью пакета Statistica 6.0 с подсчетом критерия Стьюдента для непарных выборок. Данные считались достоверными при р <0.05.
Результаты и их обсуждение. Установлено, что величина СтЭО в контрольной группе мышей (n=10) составила в среднем 15132± 146 ккал/сут, что согласуется с литературными данными [7,8]. Было показано, что интенсивность потребления кислорода подопытными животными (n=10) и уровень СтЭО существенно зависят от степени их фоновой моторной активности. Введение p Q-901 сопровождалось снижением моторной активности животных, снижением их ректальной температуры на 5-7оС, а также достоверным уменьшением частоты следования ЭКГ-циклов с 712± 36/мин до 425± 28/мин (рис. 1).
Величина СтЭО достоверно понижалась. Через 90 мин после введения препарата животным СтЭО составлял величину порядка 5213± 86 ккал/сут. Полученные результаты дали основание предположить, что механизм действия комплексных соединений Zn(II) и N-ацетилцистеина связан с переводом энергетического обмена мышей на более низкий уровень, что нашло подтверждение в наших опытах, выполненных на суспензии митохондрий головного мозга крыс.
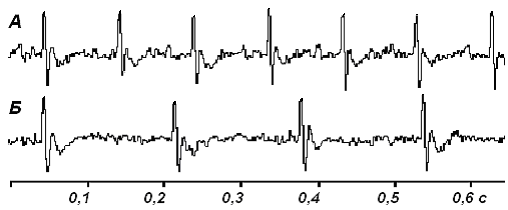
Рис. 1. Изменение ЭКГ мыши (компьютерная регистрация) через 60 мин после в/б введения
p Q-901 (50 мг/кг). А – исходная ЭКГ, Б – ЭКГ после введения вещества.Митохондрии, выделенные из ткани головного мозга крыс контрольной группы имели следующие показатели: скорости дыхания V
0, V3, V4, VДНФ соответственно равнялись – 22.07, 57.88, 25.72, 64.81 наног-атомов О2/мин/мг белка; дыхательный контроль – ДКЛУ и ДКЧУ составили соответственно – 2.66 и 2.27, коэффициент АДФ/O – 1.64, скорость фосфорилирования АДФ/t – 87.16 нмоль/мин/мг белка, 2,4-динитрофенол увеличивал скорость окисления в 2.54 раза (рис. 2).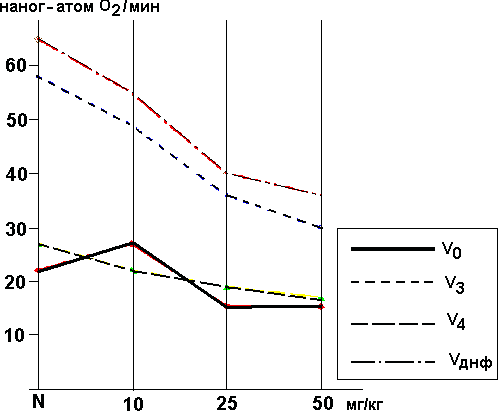
Рис. 2. Изменение скоростей дыхания (V
0, V3, V4, VДНФ) митохондрий через 60 мин после в/б введения вещества p Q-901 в дозах 10, 25 и 50 мг/кг. По оси ординат – скорость дыхания митохондрий (в наног-атом кислорода/мин на 1 мг белка митохондрий). По оси абсцисс – доза p Q-901, N – контроль.После введения
p Q-901 в дозе 10 мг/кг начальная скорость окисления субстрата (V0) увеличилась на 24.83%. Тем не менее прочие показатели свидетельствовали об ослаблении энергетической функции митохондрий. Так, скорость окисления после фосфорилирования (V4) снизилась на 13.06%, скорость фосфорилирующего (V3) и разобщенного окисления (VДНФ) снизились, соответственно, на 14.79 и 13.86% в сравнении с контролем. Сопряжение в дыхательной цепи ухудшилось, о чем свидетельствует снижение дыхательного контроля (ДКЛУ) на 32.71%, и скорости фосфорилирования добавки АДФ на 43.33%, что свидетельствует об ограничении образования АТФ в единицу времени.При введении
p Q-901 в дозе 25 мг/кг дыхание митохондрий становилось слабее. Было отмечено снижение скорости окисления субстрата (V0) на 30.09%, скорости фосфорилирующего окисления (V3) – на 37.66%, скорости окисления после фосфорилирования (V4) – на 25.8%, скорости разобщенного окисления (VДНФ) – на 37.39%. Нарушения сопряжения в дыхательной цепи прогрессировали. Образование АТФ в единицу времени снизилось на 73.3%.При введении вещества в дозе в дозе 50 мг/кг начальная скорость окисления субстрата (V
0) уменьшилась на 36.42%, скорость фосфорилирующего окисления (V3) – на 48.15%, скорость окисление после фосфорилирования (V4) – на 32.46%, скорость разобщенного окисления (VДНФ) – на 43.94%.Снижение скорости окисления в митохондриях можно расценивать как следствие подавления активности ферментов дыхательной цепи [5,6,8]. Угнетение VДНФ свидетельствует об уменьшении резервных возможностей дыхательной цепи митохондрий, а выраженное нарушение процессов сопряжения позволяет предположить наличие повреждений в дыхательной цепи и мембранах митохондрий.
Выводы. 1) Антигипоксический эффект комплексного соединения Zn(II) и N-ацетилцистеина
p Q-901 реализуется путём обратимого угнетения энергетического обмена, уменьшающего потребность животных в кислороде и обеспечивающего возможность их пролонгированного пребывания в условиях острой экзогенной гипоксии. 2) Защитный эффект комплексных соединений Zn(II) и N-ацетилцистеина при развитии острой экзогенной гипоксии тесно связан со способностью веществ данной группы оказывать угнетающее влияние на процессы окисления биологических субстратов в митохондриях.Литература
УДК 616.127-005.8-073.48
Динамика атеросклеротического процесса и эндотелий-зависимой вазодилатации у больных в разные сроки инфаркта миокарда
Смоленская государственная медицинская академия
Эндотелиальная дисфункция является ключевым звеном в формировании единого сердечно-сосудистого континуума. В динамике проанализировано состояние эндотелий-зависимой вазодилатации – основного показателя вазомоторной функции эндотелия, проведена оценка характера и степени атеросклеротического поражения периферических артерий
у больных инфарктом миокарда.Инфаркт миокарда – заболевание, механизмом развития которого является атеросклероз коронарных сосудов с повреждением атеросклеротической бляшки (АСБ) и последующим тромбозом артерий [1, 3, 5, 8]. Исследования последних лет показали, что ключевую роль в патогенезе атеросклероза (АС), артериальной гипертонии (АГ) и ишемической болезни сердца (ИБС) играет эндотелиальная дисфункция (ЭД), характеризующаяся нарушением регуляции сосудистого тонуса [3, 6, 7, 8]. При этом ЭД проявляет себя либо в виде спазма артерии, либо в виде отсутствия реакции в ответ на воздействие физиологических или фармакологических стимулов, тогда как нормальные сосуды реагируют дилатацией. Такая патологическая реакция эндотелия является начальным этапом развития АС с вовлечением не только крупных артерий, но и сосудов микроциркуляторного русла. Отмечено, что на ранних стадиях атеросклеротического процесса происходит утолщение слоев сосудистой стенки, предшествующее формированию атеромы [1, 2, 4]. Количественный показатель, рассчитанный при суммировании ряда послойных измерений сосудистой стенки и, по данным ряда авторов [1, 2, 4, 8], отражающий прогрессирование АС, получил название intima-media thickness (толщина комплекса интима-медиа – ТКИМ). Увеличение данного показателя более 1,0 мм расценивается как начальный АС в данной сосудистой области.
В настоящее время появилась возможность прижизненного неинвазивного исследования стенки сосуда – определения толщины и рельефа КИМ, выявления АСБ – в различных сосудистых бассейнах [1,2,4]. Метод исследования сосудов с использованием ультразвука высокого разрешения (УЗВР) получил название ультразвукового дуплексного сканирования (УДС). Метод позволяет проводить исследование периферических артерий в трех режимах – В-модальном, цветовом и допплеровском. УДС дает возможность не только оценить состояние КИМ, но также выявить и охарактеризовать АСБ, оценить кровоток в артериях.
Значительным прогрессом стала возможность неинвазивного определения состояния эндотелия периферических сосудов. Методика изучения функции эндотелия с помощью УЗВР предложена D.S. Celermajer c соавт. в 1992г [6]. В качестве модели чаще используется плечевая артерия. В ходе исследования рассчитывается эндотелий-зависимая вазодилатация (ЭЗВД) – количественный показатель, характеризующий вазомоторную функцию эндотелия. Нормальной считается ЭЗВД не менее 8-10% [6,8].
Цель исследования: изучить эндотелий-зависимую вазодилатацию и характер атеросклеротического поражения периферических артерий у больных инфарктом миокарда (ИМ) в динамике (в остром и постинфарктном периоде).
Материалы и методы. Обследовано 100 мужчин с острым ИМ в возрасте от 29 до 60 лет (средний возраст 49,753±0,724 лет). Диагноз ИМ у всех больных был установлен впервые и подтвержден клинически (у 90% развился типичный ангинозный приступ), лабораторными данными (лейкоцитоз, ускорение СОЭ, повышение уровня МВ-фракции КФК, ЛДГ, ЛДГ-1, АСТ, АЛТ) и инструментальными методами (характерные изменения на ЭКГ: патологический Q или QS, элевация ST, инверсия Т; зоны нарушения локальной сократимости в виде акинеза и гипокинеза при ЭхоКГ).
Для оценки характера и степени атеросклеротического поражения периферических артерий всем больным проведено УДС брахиоцефальных и бедренных артерий. Для расчета ЭЗВД – ультразвуковое исследование плечевой артерии и функциональная проба с реактивной гиперемией. Сканирование осуществлялось на аппарате “Hewlett – Packard, Sonos-4500” линейным датчиком с ультрашироким диапазоном частот (3-11 МГц). Обследование проводилось дважды – в 1-2 сутки острого ИМ и в постинфарктном периоде (через 6 месяцев от начала заболевания), контрольное исследование проведено у 65 больных. В постинфарктном периоде больные получали стандартизированную терапию – антиагреганты, бета-адреноблокаторы, ингибиторы АПФ, нитраты по требованию. Более половины обследованных принимали статины.
Результаты исследования. При УДС брахиоцефальных и бедренных артерий у 94 % больных выявлены утолщение КИМ более 1,0 мм, его неровность, повышение плотности, неравномерная эхоструктура Средняя величина КИМ при обследовании в 1-2 сутки острого ИМ (n=100) составила: 1,007±0,019 мм в правой общей сонной артерии, 1,041±0,020 мм в левой общей сонной артерии, 1,229±0,091 мм в правой общей бедренной артерии и 1,196±0,078 мм в левой общей бедренной артерии. У 65 пациентов УДС периферических артерий проведено в динамике. Полученные результаты представлены в таблице 1.
Как видно из таблицы, в постинфарктном периоде произошло статистически достоверное уменьшение толщины КИМ как в правой ОСА (на 8,2%), так и в левой ОСА (на 13,2%). В обеих общих бедренных артериях также выявлено уменьшение величины КИМ (на 8,1% в правой ОБА и на 3,9% в левой ОБА), однако эти изменения оказались статистически недостоверными.
Таблица 1. Динамика толщины КИМ у обследованных больных (n=65)
Показатель УДС |
Справа |
Слева |
||
1-2 сутки ИМ |
6 месяцев после ИМ |
1-2 сутки ИМ |
6 месяцев после ИМ |
|
Толщина КИМ в ОСА, мм |
1,006±0,025 |
0,923±0,020* |
1,053±0,027 |
0,914±0,022*** |
Толщина КИМ в ОБА, мм |
1,266±0,121 |
1,164±0,121 |
1,155±0,105 |
1,110±0,104 |
Примечание: * - р<0,05; *** - р<0,001
Помимо утолщения КИМ, у 90% больных в остром периоде ИМ выявлены атеросклеротические бляшки, которые чаще располагались в бифуркации брахиоцефального ствола и общих сонных артерий, в устье внутренних сонных артерий, по задней стенке общих бедренных артерий и в устье глубоких бедренных артерий (в зонах наибольшей турбулентности потока крови). Поражение периферических артерий более чем у половины больных (61%) носило комбинированный характер с вовлечением в патологический процесс как брахиоцефальных, так и бедренных артерий. Изолированное расположение бляшек в сонных или бедренных артериях наблюдалось значительно реже – у 9 и 20% обследованных соответственно.
У подавляющего большинства бляшки не вызывали гемодинамически значимого стенозирования. Однако у 10% сформировались крупные гемодинамически значимые бляшки с высокой степенью стенозирования. При обследовании в динамике число бляшек не уменьшилось, однако у 37 из 65 больных отмечены признаки стабилизации бляшек – выравнивание поверхности, более равномерная эхоструктура.
При ультразвуковом исследовании плечевой артерии в остром периоде ИМ исходный диаметр ПА перед проведением пробы с реактивной гиперемией составил 4,958±0,070 мм. Исходная пиковая систолическая скорость по ПА равнялась 66,092±1,658 см/сек. Эндотелий-зависимая вазодилатация у больных в 1-2 сутки ИМ составила 4,376±0,608%, что в два раза меньше физиологической величины. Диапазон значений ЭЗВД находился в пределах от минус 9,8% до 15
,2%. Характер ЭЗВД у больных с острым ИМ представлен на рис. 1.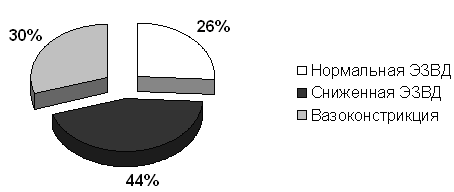
Рис. 1. Состояние вазорегулирующей функции эндотелия в острую стадию ИМ (n=100).
Полученные данные свидетельствуют, что более чем у 2/3 больных в остром периоде ИМ наблюдается снижение ЭЗВД – основного показателя эндотелиальной функции. Парадоксальная вазоконстрикторная реакция (вазоспазм) выявлена почти у 1/3 больных. У 65 пациентов ультразвуковое исследование плечевой артерии проведено в динамике. Результаты представлены в таблице 2.
Таблица 2. Динамика показателей ультразвукового исследования плечевой артерии у обследованных больных (n=65)
Параметры |
1-2 сутки ИМ |
6 месяцев после ИМ |
Исходный диаметр ПА, мм |
4,905±0,092 |
4,901±0,094 |
Исходная скорость кровотока в ПА, см/сек |
65,831±1,864 |
68,703±1,772 |
Максимальная скорость кровотока в ПА, см/сек |
122,766±4,210 |
150,545±4,724*** |
Эндотелий-зависимая дилатация ПА, % |
4,657±0,766 |
8,459±0,649*** |
Реактивная гиперемия (увеличение скорости кровотока), % |
94,324±7,171 |
121,769±6,481** |
Примечание: ** - р<0,01; *** - р<0,001
Как видно из приведенного материала, в постинфарктном периоде на фоне лечения произошло достоверное увеличение ЭЗВД (на 81,6%), максимальной скорости кровотока в ПА (на 22,6%), реактивной гиперемии (на 29,1%). Результаты, полученные в ходе динамического исследования больных, представлены на рис. 2.
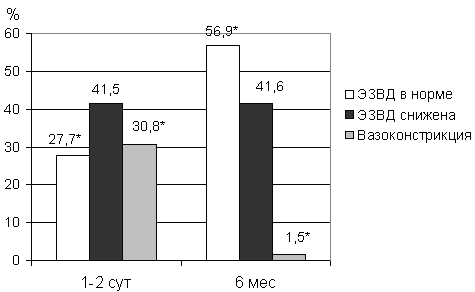
Рис. 2. Динамика ЭЗВД в остром и постинфарктном периоде (n=65).
Как видно из рисунка, в постинфарктном периоде количество больных с нормальной вазорегулирующей функцией эндотелия достоверно увеличилось при уменьшении количества больных с парадоксальной вазоконстрикторной реакцией (р<0,05).
Таким образом, в постинфарктном периоде под влиянием лечения отмечено достоверное уменьшение толщины КИМ в периферических артериях. Полученные результаты свидетельствуют о том, что процесс ремоделирования сосудов является частично обратимым. Особенно, когда атеросклеротическая бляшка еще не сформировалась, но уже имеется утолщение комплекса интима-медиа. Под влиянием терапии могут стабилизироваться уже существующие бляшки – их поверхность становится более ровной (меньше условий для агрегации тромбоцитов на поверхности бляшки), структура – более равномерной (ниже риск разрыва покрышки и разрушения АСБ с последующим атеротромбозом). Наличие тесной корреляционной связи между атеросклеротическим процессом в периферических и коронарных сосудах дает возможность косвенно судить о состоянии коронарного русла.
В остром периоде ИМ у большинства больных (74%) выявлено нарушение эндотелий-зависимой дилатации – основного показателя вазорегулирующей функции эндотелия, причем фактически у трети обследованных вместо дилатации в ответ на пробу с декомпрессий ПА происходила парадоксальная вазоконстрикция артерии, что является неблагоприятным прогностическим признаком. Однако, в постинфарктном периоде, под воздействием лечения, наблюдается достоверное улучшение ЭЗВД. Следовательно, нарушение эндотелиальной функции является динамичным, обратимым процессом. Назначение лекарственных препаратов, способных оказывать вазопротективное действие, может в значительной степени улучшить ЭЗВД, даже в случае исходно выявленной вазоконстрикторной реакции.
Литература
УДК 616.12-009.72 (001.8)
Связь госпитализированной заболеваемости ишемической болезнью сердца населения штата Нью-Йорк с проживанием в районах, расположенных вблизи источников стойких органических загрязнителей (популяционное исследование)
А. В. Сергеев, Д. О. Карпентер
Смоленская государственная медицинская академия, Смоленск
Институт здоровья и окружающей среды, Университет штата Нью-Йорк в Олбани, Ренсселер, Нью-Йорк
В работе представлена часть результатов популяционного исследования по изучению связи госпитализированной заболеваемости ишемической болезнью сердца (ИБС) с воздействием стойких органических загрязнителей (СОЗ). Показано, что проживание вблизи источников загрязнения окружающей среды СОЗ ассоциировано со статистически значимым повышением госпитализированной заболеваемости ИБС среди населения штата Нью-Йорк на 15,0%. Рекомендовано продолжить дальнейшие исследования в данной области для уточнения характера выявленных связей.
Введение
. Основные факторы риска ишемической болезни сердца (ИБС), такие как курение, артериальная гипертензия, дислипидемия, сахарный диабет, возраст и мужской пол, давно известны и хорошо изучены. Однако воздействие поллютантов окружающей среды также может повышать риск развития ИБС. В недавнем заявлении экспертов Американской Ассоциации Кардиологов (AHA – American Heart Association) говорится, что загрязнение воздуха взвешенными частицами (PM – particular matter) увеличивает риск госпитализированной заболеваемости сердечно-сосудистыми заболеваниями и смертности от них [3]. Была показана связь между риском инфаркта миокарда (ИМ) и потреблением ртути, содержащейся в пресноводной рыбе [9], а также концентрацией ртути в ногтях обследованных лиц [6]. По мнению Salonen et al. (1995), в основе выявленной связи лежит механизм стимулирования перекисного окисления липидов. Особый интерес представляет выявленная в ряде исследований связь между воздействием стойких органических загрязнителей (СОЗ) – полихлорбифенилов (ПХБ), полихлордибензодиоксинов (ПХДД), полихлордибензофуранов (ПХДФ) – и ИБС [7, 8].СОЗ относятся к хлорорганическим соединениям; они способны сохраняться в окружающей среде в неизменном виде на протяжении, как минимум, многих десятилетий и накапливаться в организме человека, поступая туда per os, чрескожным и ингаляционным путем. Двенадцать наиболее опасных СОЗ (т. н. “грязная дюжина” - ”dirty dozen”) стали предметом обсуждения в рамках межгосударственной Стокгольмской конвенции, предусматривающей принятие государствами-участниками мер по ликвидации производства и прекращению использования ряда токсических содинений [1]. “Грязная дюжина” включает в себя нежелательные побочные органические продукты (ПХДД и ПХДФ), промышленные продукты (ПХБ и гексахлорбензол – ГХБ), пестициды (ДДТ, алдрин, диэлдрин, эндрин, хлордан, мирекс, токсафен, гептахлор). Известно, что эти вещества являются канцерогенами, вызывают заболевания иммунной, нервной, эндокринной систем, нарушают репродуктивную функцию [5].
Кроме того, в исследованиях на животных было показано, что СОЗ индуцируют липогенные энзимы [2], оказывают прямое повреждающее действие на эндотелиоциты [11]. У рабочих, подвергшихся воздействию СОЗ на производстве, была отмечена гиперлипидемия [4, 10]. Поскольку нарушения липидного обмена и эндотелиальная дисфункция играют важную роль в развитии ИБС, мы выдвинули гипотезу, что в районах, расположенных вблизи источников СОЗ, будет повышена госпитализированная заболеваемость ИБС. Целью нашего исследования явилось изучение связи между популяционной экспозицией СОЗ по месту жительства и госпитализированной заболеваемостью ИБС среди населения штата Нью-Йорк. Часть результатов проведенного популяционного исследования представлена в данной публикации.
Материалы и методы. Было проведено поперечное исследование госпитализированной заболевемости ИБС в штате Нью-Йорк с использованием базы данных SPARCS (Statewide Planning and Research Cooperative System - Кооперативная система планирования деятельности и проведения научных исследований) Департамента здравоохранения штата Нью-Йорк за период 1993-2000 гг. Ежегодное количество госпитализаций в больничные учреждения, находящиеся в ведении штата Нью-Йорк, составляет около 2,5 миллионов. По каждому из этих случаев в базу данных SPARCS заносится детальная информация, в том числе до 15 выставленных пациенту диагнозов и до 15 выполненных ему процедур, закодированных в соответствии с Международной классификацией болезней, сведения о возрасте, поле, расовой принадлежности, типе медицинской страховки, адресе места жительства и др. Эти данные были использованы нами для поправки на потенциальные вмешивающиеся факторы (potential confounders), недоучет влияния которых мог бы привести к некорректной оценке характера/направленности выявленных связей (качественная оценка) и/или снижению точности результатов исследования (количественная оценка). Так, в связи с отсутствием в США системы обязательного медицинского страхования наличие и объем страхового покрытия (health insurance coverage) может в определенной степени повлиять на вероятность госпитатализации. По этой же причине другим потенциальным вмешивающимся фактором в нашем исследовании был социально-экономический статус (СЭС); в качестве его аппроксимированной меры (количественная оценка) использовали медианные значения годового дохода семей по данным переписи населения 2000 г. (US Census 2000), измеренные на уровне ZIP-кодов (аналоги Российских почтовых индексов). Экспозиция (воздействие СОЗ или прочих поллютантов) оценивалась на уровне ZIP-кодов. Все ZIP-коды штата Нью-Йорк, кроме города Нью-Йорк, были классифицированы как контаминированные СОЗ (“СОЗ”), контаминированные другими поллютантами (“не-СОЗ”) или незагрязненные (“чистые”) в зависимости от наличия тех или иных источников загрязнения (ИЗ) в пределах ZIP-кода или на непосредственно прилегающей к нему территории. Для определения локализации ИЗ использовали данные Агентства защиты окружающей среды США, Департамента защиты окружающей среды штата Нью-Йорк и Американо-Канадской международной объединенной комиссии по использованию приграничных водных ресурсов. Сто девяносто шесть ZIP-кодов были классифицированы как “СОЗ”, 222 – “не-СОЗ”, 996 – “чистые”. Статистическую обработку результатов проводили с использованием пакета SAS (версия 8.2). Для построения негативных биномиальных моделей с поправкой на известные ковариаты применяли процедуру GENMOD.
Результаты и обсуждение. Проживание в ZIP-коде, содержащем или примыкающем к источникам СОЗ, было ассоциировано со статистически достоверным 15-процентным повышением госпитализированной заболеваемости ИБС (95% доверительный интервал (ДИ) 2,9% - 28,6%) по сравнению с проживанием в “чистом” ZIP-коде. Среди проживающих в ZIP-кодах, загрязненных “не-СОЗ” поллютантами, отмечалось увеличение госпитализированной заболеваемости ИБС на 4,1%, которое, однако, не было статистически достоверным. Среди мужчин госпитализированная заболеваемость ИБС была почти в два раза выше, чем среди женщин (отношение шансов (ОШ) 1,726, 95% ДИ 1,573 – 1,893). Был отмечен устойчивый рост госпитализированной заболеваемостью ИБС по мере увеличения возраста с 25-34 лет (референтная группа) и далее в каждой возрастной группе (с 10-летним шагом) вплоть до самой старшей возрастной группы (от 75 лет и старше).
Несмотря на то, что анализ связи госпитализированной заболеваемости ИБС с полом и возрастом не входил в задачи нашего исследования, полученные результаты были использованы в качестве “индикатора качества” полученных моделей. Известно, что старший возраст и мужской пол являются факторами риска ИБС. Поэтому совершенно закономерно следует ожидать, что более высокий уровень госпитализированной заболеваемости ИБС будет отмечаться именно среди мужчин и лиц старшей возрастной группы. Следовательно, адекватность модели, описывающей связь между каким-либо изучаемым фактором (экспозицией) и госпитализированной заболеваемостью ИБС, могла бы быть поставлена под сомнение, если бы она не отражала вклад пола и возраста. Согласно данным критериям, нашу модель следует расценивать как адекватную.
Для учета влияния СЭС как потенциального вмешивающегося фактора значения медиан годового дохода были разбиты по квартилям и включены в модель; нижний квартиль Q1 (менее $30.312,5) был выбран в качестве референтной группы. По мере роста уровня годового дохода отмечалось снижение госпитализированной заболеваемости ИБС: ОШ 0,915 (95% ДИ 0,802 – 1,043) для Q2, ОШ 0,831 (95% ДИ 0,729 – 0,947) для Q3, ОШ 0,658 (95% ДИ 0,577 – 0,750) для Q4.
Наличие медицинской страховки Medicare (правительственная программа США по обеспечению медицинской помощи для пожилых) или покрывающей широкий спектр медицинских услуг частной страховки (Blue Cross и т.п.) было ассоциировано с более низкой госпитализированной заболеваемостью ИБС по сравнению с незастрахованными или лицами, имеющими страховку Medicaid (правительственная программа США по обеспечению медицинской помощи для ряда категорий бедных слоев населения). Это может быть объяснено более низким уровнем СЭС последних двух групп населения (Medicaid или отсутствие страховки) по сравнению с первыми двумя, а также более старшим возрастом лиц, подлежащих страхованию Medicare.
Выявленное в нашем исследовании повышение госпитализированной заболеваемости ИБС можно было бы попытаться объяснить влиянием пола, возраста, наличием/отсутствием приемлемой медицинской страховки, географически неравномерным распределением групп населения с высоким и низким СЭС. Однако все эти потенциальные вмешивающиеся факторы были учтены в полученной модели, т.е. на них была сделана соответствующая поправка, и полученные нами результаты не могут быть проявлением эффекта посторонних факторов.
Каждое исследование имеет свои ограничения. Не свободно от них и наше исследование. ZIP-коды имеют неодинаковые размеры и разную форму, что ограничивает точность их использования в качестве меры экспозиции. Однако, если бы это обстоятельство и повлияло на точность полученных результатов, то оно сместило бы их в сторону недооценки силы выявленной связи вследствие недифференцированной мисклассификации (non-differential misclassification). Иными словами, в таком случае
истинная связь между воздействием СОЗ и госпитализированной заболеваемостью ИБС оказалась бы еще сильнее по сравнению с выявленной в нашем исследовании.Заключение. Проживание вблизи источников загрязнения окружающей среды СОЗ ассоциировано со статистически значимым повышением госпитализированной заболеваемости ИБС. Несмотря на то, что данное исследование не позволяет сделать категоричных выводов о причинно-следственной связи между изучаемой экспозицией и развитием ИБС, полученные результаты косвенно подтверждают гипотезу о возможной роли СОЗ как фактора риска ИБС на популяционном уровне. Для уточнения характера выявленных связей необходимы дальнейшие исследования в данной области.
Литература
УДК 616.831-006-073.75
Данные компьютерной томографии и показатели гидроионного гомеостаза в диагностике перитуморозного отека
Н. А. Прохоренкова, Н. Н. Маслова
Смоленская государственная медицинская академия
В результате проведенного корреляционного сопоставления физико-химического (показатели гидроионного гомеостаза) и нейровизуализационного (КТ-данные) исследований у нейроонкологических больных установлена корреляционная зависимость, позволяющая получить дополнительную информацию как о гистологических особенностях опухоли, ее размерах и плотности, так и о выраженности перитуморозного отека.
Отмечаемое в последнее десятилетие во всем мире увеличение частоты онкологических заболеваний характерно и для России. В структуре общей онкологической заболеваемости опухоли головного мозга составляют 0,7–1,5%. В нашей стране нейроонкологическая заболеваемость составляет примерно 30 тыс. человек в год [3, 4, 7]. Высокая медико-социальная значимость делает проблему онкологических церебральных процессов и их последствий весьма актуальной и побуждает к поиску новых путей совершенствования нейроонкологической помощи. Современные нейровизуализационные методы исследования дают прямую оценку структурных изменений в различных отделах мозга, однако далеко не всегда в состоянии отобразить все многообразие функциональных изменений мозга при развитии опухоли. Использование экономичных, простых в применении физико-химических методов (дилатометрический метод, в частности) позволяет решить многие проблемы диагностики отека мозга и существенно расширить возможности контроля над состоянием мозговой ткани в процессе лечения пациента [2, 6].
По данным литературы, клинические проявления новообразований головного мозга разнообразны и обусловлены не только онкопроцессом, но и реакциями окружающей опухоль мозговой ткани в ответ на нарушение водно-электролитного баланса, гемо- и ликвородинамики и т.п. Наиболее общей, закономерно развивающейся при опухолях мозга реакцией является перифокальный отек, в основе развития которого лежит взаимодействие сосудистого и паренхиматозного факторов [1,5,8,9,10].Состояние перитуморозной зоны во многом определяет клиническое течение и прогнозирование исхода заболевания при первичных и метастатических опухолях головного мозга. Практический интерес, на наш взгляд, представляет сопоставление физико-химических и нейровизуализационных данных, что позволяет получить дополнительную информацию о структурной характеристике новообразования, а также о выраженности перифокального отека. В этом случае удается более точно определить размер отека и его характер, что имеет большое значение для выбора рациональной противоотечной терапии в предоперационной подготовке больного и планирования хирургического вмешательства.
Основные выводы данной работы базируются на результатах исследований, выполненных в процессе обследования 72 пациентов с верифицированными новообразованиями мозга, средний возраст которых составил 42,49+3,42 лет. Группу со злокачественными опухолями головного мозга составили 32 (44,44%) пациента, с доброкачественными – 40 (55,56%) больных.
Для оценки степени выраженности перифокального отека при доброкачественных и злокачественных опухолях головного мозга нами проведен корреляционный анализ между размером, плотностью опухоли и выраженностью перифокального отека по данным КТ- исследования. Для изучения роли отека вещества мозга в клинических проявлениях новообразований головного мозга в до- и послеоперационных периодах нами использовано физико-химическое исследование фракций воды в цельной крови и ее компонентах с помощью дилатометрического метода. Он является количественным и способен обеспечить высокую степень точности при выявлении минимальных отклонений в соотношении водных фракций в жидких средах организма, что объективно отражает состояние ткани мозга [2, 6]. Статистическая обработка результатов исследования проводилась на ПЭВМ типа IBM PC/AT Pentium – 100 c использованием пакета прикладных программ Statgraphics v. 5.0. Проверка гипотезы о нормальности распределения вариационных рядов полученных данных осуществлялась при помощи критерия хи-квадрат (x2) Пирсона. В случае невыполнения законов нормального распределения использовался ранговый корреляционный анализ по Спирману. Статистическая достоверность изменений в до- и послеоперационном периодах оценивалась с использованием парного t-теста Стьюдента (paired t-test). В случае невыполнения законов нормального распределения парный t-тест Стьюдента заменялся знаковым критерием Вилкоксона. Все статистические тесты проводились для двусторонней гипотезы при уровне статистической значимости – 0,05.
В результате корреляционного анализа, нами установлены: – положительная корреляция между выраженностью перифокального отека и свободной водой в эритромассе крови (рис.1), то есть бульшее содержание свободной воды в эритромассе крови больных с опухолями мозга сопровождается более выраженным перитуморозным отеком мозга (4-5 баллов); – отрицательная корреляция между выраженностью перифокального отека и связанной водой в эритромассе крови (рис.2), то есть, чем больше связанной воды в эритроцитарной массе крови пациентов, тем меньше выраженность перифокального отека (1-2 балла); – отрицательная корреляция между выраженностью перифокального отека и плотностью опухоли (табл.1): злокачественные опухоли (анапластические астроцитомы, глиобластомы) характеризуются пониженной плотностью новообразования (<60 ЕН) и выраженным отеком или обширной зоной перифокального отека (3-5 баллов), а доброкачественные (менингиомы, аденомы гипофиза) – наоборот, повышенной плотностью опухоли (>60 ЕН) и слабо или умеренно выраженным перифокальным отеком (1-2 балла).
Рис.1. Корреляционное поле для признаков ВПО (выраженность перифокального отека) и Своб. ВЭ (свободная вода в эритромассе крови)
Рис.2. Корреляционное поле для признаков ВПО (выраженность перифокального отека) и Связ.ВЭ (связанная в эритромассе крови)
Рис.3. Корреляционное поле для признаков ВПО (выраженность перифокального отека) и РО (размер опухоли).
Результаты нашего исследования показали, что размер новообразования не коррелирует с выраженностью перитуморозного отека (рис.3). В то же время нами установлена знбчимая отрицательная корреляция между выраженностью перифокального отека и плотностью новообразования (табл.1). Специфика измерения плотности опухоли (далее – признак ПО) заключается в том, что эти измерения представляют собой не точечные, а интервальные оценки измеряемой величины. В связи с этим интервальные оценки плотности опухоли отображались в
пространство точечных категоризированных наблюдений, для которого развита современная теория статистического анализа. Для категоризации интервальных измерений графоаналитическим методом был определен порог, значение которого равно 60 ЕН. При данном пороговом значении 32 интервальных измерения лежат ниже порога (злокачественные опухоли), 34 интервальных измерения лежат выше порога (доброкачественные), 6 интервальных измерений накрывают порог. Эти 6 измерений, составляющих 8,3 % от объема выборки, в дальнейшем для обеспечения “чистоты” выводов были исключены из анализа. Таким образом, интервальные количественные измерения признака “плотность новообразования” были приведены к номинальной дихотомической шкале, имеющей две градации: 1) интервальные значения, лежащие ниже порога, доля таких значений составила 32/66=0,485; 2) интервальные значения, лежащие выше порога, доля таких значений составила 34/66=0,515. Интервальный количественный признак “плотность опухоли”, рассматриваемый выше как номинальный дихотомический, также может рассматриваться как порядковый признак, имеющий два ранга: ранг 1 присваивается значениям, лежащим ниже порога (L); ранг 2 присваивается значениям лежащим выше порога (V). Выраженность перифокального отека измерена в порядковой пяти-бальной шкале: 1 балл – слабо выраженный перифокальный отек, 2 балла – умеренно выраженный отек, 3 балла – выраженный отек, 4 балла – резко выраженный отек и 5 баллов – обширная зона отека.Таблица 1. Соотношение выраженности перифокального отека и плотности новообразования по КТ-данным
| Порог плотности опухоли | Выраженность
перифокального отека (в баллах) |
Всего (n,%) | ||
| 1-2 | 3 | 4-5 | ||
| L | N=4 (12,50%) | n=10 (31,25%) | n=18 (56, 25%) | n=32 (48,48%) |
| V | N=21 (61,76%) | n=11 (32,35%) | n=2 (5, 88%) | n=34 (51,52%) |
| Всего(n,%) | N=25 (37,88%) | n=21 (31,82%) | n=20 (30, 30%) | n=66 (100,00%) |
Таким образом, подтверждено, что для злокачественных опухолей головного мозга характерно нарастание выраженности отека в перитуморозной зоне.
Нами также был проведен корреляционный анализ между плотностью и размером новообразований по КТ-данным, и показателями гидроионного гомеостаза. В исследуемой выборочной совокупности изучались содержание воды в крови больных физико-химическим дилатометрическим методом и плотность опухоли, ее размер по данным КТ, которые представляли собой интервальное измерение плотности опухоли в единицах Хаунсфилда (далее – признак ПО). Для количественной оценки степени связи между признаками, один из которых измерен в номинальной дихотомической шкале, а другой – в количественной шкале, мы использовали точечно-бисериальный коэффициент корреляции.
В результате вычислений установлено: выборочный точечно-бисериальный коэффициент корреляции между признаками Своб.ВЭ (свободная вода в эритромассе крови) и ПО, равный rpb=-0,45, является значимым (p<0,05); выборочный точечно-бисериальный коэффициент корреляции между признаками Связ.ВЭ (связанная вода в эритромассе крови) и ПО, равный rpb=0,54, является значимым (p<0,05); выборочный точечно-бисериальный коэффициент корреляции между признаками РО (размер опухоли) и ПО (плотность опухоли), равный rpb=-0,39, является значимым (p<0,05). Следовательно, в результате проведенного корреляционного анализа между плотностью, размером опухоли по КТ-данным и показателями гидроионного гомеостаза, нами установлены: – достоверно отрицательная корреляция между свободной водой в эритромассе крови и плотностью опухоли: бульшее содержание свободной воды в эритроцитарной массе крови нейроонкологических больных сопровождается меньшей плотностью новообразования, что, в свою очередь, свидетельствует о злокачественном характере последнего; – достоверно положительная корреляция между связанной водой в эритроцитарной массе крови и плотностью опухоли: чем больше связанной воды в эритромассе крови пациентов, тем больше плотность новообразования, что указывает на его доброкачественный характер; – достоверно отрицательная корреляция между размером новообразования и плотностью его: чем больше размер опухоли, тем меньше ее плотность, что говорит об инфильтративном
росте новообразования, и, следовательно, его злокачественном характере.Все вышеперечисленные факторы указывают на значительные изменения биохимических реакций в ткани опухоли и окружающих участках мозга. Эти реакции являются основой для развития как некротического, так и отечного процессов в перифокальной зоне, и в итоге они определяют степень повреждения участков мозга, вступающих в контакт с развивающимся туморозным очагом, а также развитие клинической неврологической симптоматики и проявления компрессионного синдрома. Назначение адекватной патогенетической терапии является основой для почти полной коррекции мозговых и соматических дисфункций, благоприятного исхода операции и послеоперационного периода. Результаты нашего исследования показали достаточную
эффективность соотношения нейровизуализационных и физико-химических методов исследования в диагностике опухолей мозга, позволяющего судить не только о структурной характеристике новообразования, но и состоянии окружающих мозговых тканей. Каждый из этих методов, обладая своими информационными возможностями, не является конкурирующим, они дополняют друг друга, позволяя детализировать различные стороны диагноза.Литература
УДК 615:616.36
ВОЗМОЖНОСТИ ФАРМАКОЛОГИЧЕСКОЙ ПРОТЕКЦИИ ФУНКЦИЙ ПЕЧЕНИ
Смоленская государственная медицинская академия
При заболеваниях печени, особенно инфекционного и токсического генеза, развиваются серьезные нарушения ее функций: метаболической, детоксикационной, синтетической и др. Нередко болезни печени, заканчивающиеся выздоровлением, оставляют “след” метаболического нарушения, который сохраняется на многие годы, а порой переходит в болезнь, требующую лекарственной терапии [75, 84, 118]. Для фармакологической протекции подобных нарушений функций печени часто используют гепатопротекторные средства.
Гепатопротекторы – лекарственные средства, улучшающие метаболические процессы в печени, повыщающие ее устойчивость к патогенным воздействиям, а также способствующие восстановлению ее функций при различных повреждениях [54]. Гепатопротекторный эффект в той или иной степени могут проявлять различные фармакологические средства, улучшающие метаболические процессы в организме, ингибирующие перекисное окисление липидов (ПОЛ), обладающие антигипоксической активностью, защищающие митохондриальные и микросомальные ферменты от повреждения, замедляющие синтез коллагена и повышающие активность коллагеназы [73, 106]. Таким образом, группа гепатопротекторов весьма гетерогенна и включает вещества различного химического строения с разнонаправленным воздействием на метаболические процессы [12, 13]. Гепатопротекторные средства можно классифицировать на биофлавоноидные, фосфолипидные, производные аминокислот, селеносодержащие, препараты животного происхождения, синтетические, препараты урсодегидрохолевой кислоты, препараты других групп.
Биофлавоноидные гепатопротекторы
В 1969 г. из плодов расторопши пятнистой (Silybum marianum L.) была выделена группа флавоноидных соединений, оказывающих гепатотропное действие. Эта группа соединений была обозначена как силимарин (Silimarin). В дальнейшем из флавоноидного комплекса расторопши пятнистой выделены изомерные соединения полигидроксифенолхроманонов, главными из которых являются силимарин, силибинин, силидианин и силикристин. Все соединения имеют фенилхроманоновую структуру, являются истинными антиоксидантами и обладают гепатопротекторной активностью [73]. Среди гепатопротекторов биофлавоноидной природы наиболее изучены и в широком ассортименте предложены к клиническому применению препараты, содержащие в качестве основного действующего вещества силимарин [14]. Силимарин является действующим веществом препаратов под коммерческими названиями: гепадестал, гепарсил, карсил, легалон, лепротек, силарин, силген, силегон, силибор, силимарин, соматрон, флавобион и др. Он также входит в состав комбинированных препаратов гепабене, гепатофальк-планта, сибектан, галстена.
Гепатопротекторное действие силимарина обусловлено его антиоксидантными, мембраностабилизирующими и стимулирующими репаративный потенциал печеночных клеток свойствами [129, 154]. К их числу относятся: защита биологических мембран от токсинов в результате ингибирования их захвата гепатоцитами, стабилизации клеточных мембран и включения в них фосфолипидов (репарация мембран); повышение обезвреживающей функции гепатоцитов, связанное с увеличением пула глутатиона в гепатоците и возрастанием активности ферментов, участвующих в окислении ксенобиотиков (в частности супероксиддисмутазы); антиоксидантное действие, обусловленное связыванием свободных радикалов, торможением реакций избыточного перекисного окисления липидов в результате ингибирования фермента липооксигеназы, снижения содержания малонового диальдегида и уменьшения расхода глутатиона; антифибротическое действие, связанное с влиянием на трансформирующий фактор роста b и экспрессию генов матрикса в стеллатных клетках (клетках Ito), а также с повышением клиренса свободных радикалов и непосредственным подавлением синтеза коллагена; повышение белково-синтетической функции печени; ингибирование синтеза холестерина в результате уменьшения активности микросомальной гидроксил-СоА-редуктазы; противовоспалительное и иммуномоделирующее действие, обусловленное уменьшением активности макрофагальных клеток, участвующих в презентации антигенов [132].
В фармакодинамике силибинина ведущими являются мембраностабилизирующие и метаболические свойства. Мембраностабилизирующее действие реализуется несколькими путями: биохимическим взаимодействием силибинина с мембранами гепатоцитов, его способностью ингибировать активность цАМФ и, как следствие, понижать содержание кальция внутри клеток, угнетать кальций-зависимый процесс активации фосфолипаз. Метаболическое действие связано со стимуляцией биосинтеза белка и ускорением регенерации поврежденных гепатоцитов. Силибинин специфически стимулирует РНК-полимеразу I в клеточном ядре, что активирует транскрипцию и скорость синтеза р-РНК в клетках печени. Последнее, в свою очередь, приводит к увеличению количества рибосом и активации биосинтеза структурных и функциональных белков. Стимуляция белоксинтетической функции гепатоцитов имеет большое значение для процессов регенерации в печени. При этом силибинин не оказывает влияния на скорость редупликации и транскрипции в измененных клетках с максимальным уровнем синтеза ДНК, что исключает возможность пролиферативного действия [14, 106, 129].
Указанные механизмы действия на гепатоцит определяют терапевтическое значение препаратов, содержащих биофлавоноиды расторопши, при диффузных заболеваниях печени. Так, в многочисленных исследованиях, посвященных изучению действия силимарина, показана его высокая эффективность при лечении больных с хроническими гепатитами и циррозами, токсическими поражениями печени, в том числе вызванными алкоголем, лекарственными препаратами, ядохимикатами, солями тяжелых металлов и др. [106]. Силимарин обладает желчегонными свойствами благодаря наличию у него одновременно холеретического и холекинетического действия. Холерез развивается благодаря повышению секреции желчных кислот и электролитов гепатоцитами. Холекинетический эффект связан со снижением тонуса сфинктеров желчевыводящих путей [129].
В последние годы у силимарина обнаружены противоопухолевые свойства, обусловленные его способностью угнетать циклооксигеназу и липооксигеназу, активность которых повышается при злокачественных новообразованиях печени, толстого кишечника, поджелудочной, молочной желез, легких, кожи и мочевого пузыря [142]. При отравлении бледной поганкой показано лечебное действие силибинина (противодействие яду ?-амантину). Главным механизмом такого действия силибинина считается его способность блокировать соответствующие участки связывания на клеточной мембране и транспортные системы, обеспечивающие перенос токсических веществ через мембрану [164]. Флавоноиды расторопши проявляют иммуномодулирующие свойства при алкогольной болезни печени, способствуя снижению цитотоксического звена (цитотоксических лимфоцитов СD8+), снижению продукции ?-глобулинов и повышению скорости бластрансформации лимфоцитов [120].
В состав комбинированного препарата гепабене наряду с флавоноидами расторопши пятнистой входит экстракт дымянки аптечной, основным действующим веществом которой является производное фумаровой кислоты – алкалоид протопин. Он увеличивает желчевыделение, активирует продукцию холецистокинина и секретина, что повышает секрецию воды и бикарбонатов эпителием желчных протоков, приводит к сокращению желчного пузыря, ослаблению сфинктера Одди и беспрепятственному поступлению желчи в кишечник. Протопин эффективно восстанавливает дренажную функцию желчевыводящих путей, предупреждая развитие застоя желчи и образование конкрементов в желчном пузыре. Кроме того, через механизм обратной связи он уменьшает всасывание холестерина в кишечнике, его синтез в печени и секрецию в желчь, что уменьшает литогенность последней. Учитывая комбинированное действие, гепабене возможно использовать при различных заболеваниях гепатобилиарной системы – от функциональных заболеваний желчных путей (как у взрослых, так и у детей) до жирового гепатоза и хронического гепатита [22, 46, 47, 72, 132]. Применение гепабене при жировом гепатозе позволяет увеличить скорость экскреции триглицеридов – их липолиз и последующее окисление жирных кислот, включение триглицеридов в пре-?-липопротеиды и их секрецию в кровяное русло. Благодаря наличию силимарина препарат нормализует нарушенную белково-синтетическую функцию печени, а также улучшает дезинтоксикационную функцию за счет увеличения пула глутатиона в гепатоците, повышения активности ферментов, участвующих в окислении ксенобиотиков. При назначении желчегонных препаратов пациентам с хроническими гепатитами необходимо учитывать отрицательное действие желчных кислот на гепатоциты. В связи с наличием в составе гепабене гепатопротектора силимарина, способного нивелировать отрицательное действие желчных кислот, препарат не противопоказан при хронических поражениях печени [72].
К комбинированным растительным средствам, используемым в качестве гепатопротекторов, относится также препарат сибектан, содержащий в своем составе сухой экстракт пижмы, плодов расторопши пятнистой, травы зверобоя и листьев березы. Трава зверобоя содержит флавоноиды, эфирные масла, танины, которые оказывают вяжущее и противовоспалительное действие на слизистую оболочку желудочно-кишечного тракта. Цветки пижмы также содержат различные флавоноиды, эфирные масла и органические кислоты, которые оказывают желчегонное действие (повышают сократительную активность желчного пузыря). Экстракт листьев березы оказывает антисептическое действие, мягкое желчегонное и отчетливое мочегонное действие [129].
Ученые полагают, что влияние фитопрепаратов на процессы свободнорадикального окисления (СРО) в значительной мере обусловлено непосредственным участием химически активных соединений, в частности биофлавоноидов, которые реализуют свое действие через систему фенол-семихинон-хинон. В этой системе важнейшая роль отводится нестойкому семихиноновому радикалу, играющему роль ловушки для других реакционноспособных радикалов [8, 95]. Лекарственные растения содержат целый комплекс биологически активных соединений (алкалоидов, терпенов, хлорофиллов, каратиноидов, витаминов, микроэлементов), способных влиять на СРО на различных стадиях метаболизма в живом организме.
Из солянки холмовой получен гепатопротектор лохеин [11, 99]. В экспериментальных исследованиях показано, что терапевтическая активность солянки холмовой обусловлена благоприятным влиянием на метаболические процессы в печени. Экстракт растения является ингибитором СРО, усиливает антирадикальную защиту липидов, а также способствует сохранению основного компонента клеточных мембран – фосфатидилхолина. Лохеин предотвращает стеатоз печени, улучшает процессы конъюгации [10, 97]. Гепатопротективное действие лохеина подтверждено в клинике при хроническом активном гепатите и хроническом персистирующем гепатите вирусной и алкогольной этиологии. Лохеин дает более выраженный по сравнению с карсилом эффект в отношении основных клинических проявлений хронического гепатита [11].
В эксперименте изучены гепатозащитные свойства средств полифенольной природы салсоколлина и максара. Салсоколлин является сухим экстрактом солянки холмовой, его действующие вещества – флавоноиды, бетаин, стеарины. В состав максара – комплекса полифенолов маакии амурской – входят изофлавоны и стильбены. Механизм их терапевтического эффекта, очевидно, обусловлен антиоксидантными свойствами [98]. На модели токсического гепатита установлено гепатопротекторное действие флавоноидных соединений гесперидина из кожуры цитрусовых и диосмина [33].
Выявлена гепатопротекторная активность оригинальных комплексов растительного происхождения, в состав которых входят соки свеклы обыкновенной и моркови посевной, отвар плодов шиповника, настои кукурузных рылец, листьев мяты перечной, наземной части хвоща полевого [56]. При остром токсическом гепатите, вызванном тетрахлорметаном, они оказывают мембранопротекторное и антиоксидантное действие, что подтверждается уменьшением активности аланиновой аминотрансферазы, содержания в сыворотке крови общего билирубина, конечных и промежуточных продуктов липопероксидации, отсутствием падения уровня эндогенного ?-токоферола и активности глутатионзависимых ферментов. Использование фитопрепаратов позволяет восстановить нарушенный гомеостаз, структуру и целостность мембран гепатоцитов, ингибировать ПОЛ как одно из звеньев патогенеза гепатитов, стимулировать антиоксидантную защиту, желчеобразование и желчевыделение, активировать репаративные процессы печеночной ткани, улучшить процессы пищеварения и абсорбции питательных веществ [98]. При остром токсическом поражении печени изученные смеси, приготовленные из растений средней полосы России, обладают гепатопротекторной активностью, сопоставимой с эффектом гепатопротектора ЛИВ-52.
При экспериментальном гепатите изучено гепатозащитное действие гранул сухого экстракта горечавника бородатого, содержащего в надземной части в большом количестве вещества фенильной природы: иридоиды, фенолкарбоновые кислоты, ?-пироновые соединения (флавоноиды и ксантоны). Препарат препятствует деструкции клеточных и субклеточных мембран гепатоцитов, что позволяет его отнести к гепатопротекторам. Авторы предполагают, что применение гранул горечавника способствует “гашению” инициированных химическим воздействием свободных радикалов. При этом вещества ксантоновой и фенольной природы одновременно взаимодействуют с другими ингибиторами свободнорадикального окисления, восстанавливают активность более сильных эндогенных антиоксидантов, снижают интенсивность ПОЛ [78].
На основе экстракта травы люцерны посевной разработан лекарственный препарат люцерон и изучено его влияние на функциональное состояние гепатобилиарной системы. На всех моделях экспериментальных гепатитов, вызванных тетрахлорметаном, алкоголем и тетрациклином, люцерон стимулировал секрецию желчи, в ряде случаев превосходя гепатопротектор силибор. Установлено также, что люцерон нормализует нарушенный при гепатите синтез желчных кислот [68].
К числу флавоноидных соединений относится дигидрокверцетин, получаемый из древесины лиственницы [114]. Известно, что in vitro дигидрокверцетин проявляет высокие антиоксидантные свойства, которые определяются его способностью взаимодействовать со свободными радикалами [38; 147; 168] и хелатировать ионы двухвалентного железа. Изучено антиоксидантное действие дигидрокверцетина при экспериментальном гепатите, вызванном тетрахлоридом углерода [111]. Дигидрокверцетин является действующим веществом антиоксидантного препарата диквертин [61]. Указанный препарат хорошо зарекомендовал себя в качестве гепатопротекторного средства в комплексном лечении токсических гепатитов, а также в комплексной терапии бронхолегочных и сердечно-сосудистых заболеваний [60; 111; 115].
Опубликованы многочисленные данные о широком спектре биологической активности проантоцианидинов – одного из интереснейших классов семейства растительных полифенольных соединений, для обозначения которых был введен специальный термин “пикногерол” [159]. Это целый класс полифенольных олигомеров, образующихся в результате конденсации мономерных единиц флаван-3-олов (лейкоонтоцианидинов) с различной степенью полимеризации. Биологическая активность проантоцианидинов обусловлена их антиоксидантным действием [155; 156; 169]. Было проведено экспериментальное изучение влияния проантоцианидинов, содержащихся в полифенольном комплексе “Калифен”, представляющем собой жидкий экстракт гребней калины на биохимические показатели печени. Установлено, что “Калифен” оказывает выраженное гепатозащитное действие при поражении печени этиловым спиртом. Механизм терапевтического эффекта препарата обусловлен благоприятным влиянием полифенолов на метаболизм и функцию печени, что выражается в ингибировании СРО и уменьшении образования токсичных продуктов липопероксидации; поддержании уровня восстановленного глутатиона и антирадикальной активности печени; восстановлении пула NAD+, снижении ацидоза и тканевой гипоксии; стабилизации мембран лизосом, нормализации структуры гепатоцитов за счет регуляции синтеза холестерина, его этерификации и включения в структуру мембран; нормализации этерифицирующей функции печени. По способности увеличивать интегральную антирадикальную активность, образование NAD+, концентрацию восстановленного глутатиона и эфиров холестерина “Калифен” превосходил гепатопротектор легалон [110].
Достаточно давно в качестве гепатопротекторов применяются препараты хофитол, катерген (гепанорм, трансгепар), ЛИВ-52. Хофитол – экстракт свежих листьев артишока полевого, основными составными частями которого являются кофеоловая и хининовая кислоты, флавоноиды, а также витамины и ряд важных микроэлементов. Механизм действия хофитола многокомпонентный: стабилизация мембран гепатоцитов и улучшение антитоксической функции печени за счет антиоксидантных свойств, снижение уровня холестерина за счет холеретического усиления элиминации и снижения внутрипеченочного синтеза, нормализация состояния тиолдисульфидной системы и увеличение содержания сульфгидрильных групп (способствует образованию НАДФ-2, что свидетельствует о повышении синтеза белка). Кроме гепатопротективного и желчегонного действия препарат обладает диуретическим эффектом, снижает содержание мочевины в крови. Наиболее эффективен хофитол в лечении больных с токсическими формами поражения печени, алкогольной болезнью печени, неалкогольным стеатогепатитом, дискинезией желчевыводящих путей по гипотоническому типу, холестазом, с сочетанной сердечной патологией и застойной сердечной недостаточностью, нарушением липидного обмена, а также с поражением почек [75; 128].
Катерген (цианиданол-3) относится к группе полусинтетических флавоноидов и по основной химической структуре весьма близок к кверцетину и рутину, а также силибинину. Механизм его гепатопротекторного действия обусловлен связыванием токсичных свободных радикалов и стабилизацией мембран клеток и лизосом. Препарат повышает уровень АТФ в печени и облегчает протекание биохимических реакций, требующих больших энергетических затрат, в частности реакций фосфорилирования. Как и флавоноиды расторопши, он уменьшает проницаемость клеточных мембран для низкомолекулярных водорастворимых соединений. Применяется препарат у больных вирусным гепатитом, при компенсированном циррозе печени вирусной этиологии, хронических поражениях печени алкогольной этиологии и при других токсических поражениях печени [120].
В состав ЛИВ-52 входят порошки (форма Лив-52 таблетки) и экстракты (форма Лив-52 капли) лекарственных растений, широко используемых в традиционной медицине многих стран (цикорий обыкновенный, каперсы колючие, тысячелистник обыкновенный, кассия западная, терминалия аржуна, паслен черный и тамарикс гальский). Каждый ингредиент Лив-52 оказывает специфическое действие, усиливая и потенцируя эффекты других компонентов. Лив-52 обладает антитоксическим, антиоксидантным, мембраностабилизирующим, желчегонным, противовоспалительным, диуретическим и положительным метаболическим действием. Лив-52 защищает паренхиму печени от токсических воздействий, усиливая внутриклеточный обмен веществ и стимулируя регенерацию. Мембраностабилизирующий эффект препарата обусловлен стимуляцией биосинтеза протеинов и фосфолипидов, нормализацией активности Na+/K+- АТФ-азы [162], а антиоксидантный – увеличением уровня эндогенных токоферолов, глутатиона и других клеточных антиоксидантов [144; 167]. Лив-52 повышает активность цитохрома Р-450 [144] и ацетальдегиддегидрогеназы, способствующей элиминации алкоголя и снижению его токсического воздействия на организм. Препарат оказывает выраженное желчегонное действие (холеретическое и холекинетическое), уменьшает литогенные свойства желчи, способствует достоверному снижению уровней ?-холестерина, ?-липопротеидов и триглицеридов в сыворотке крови. Его применение можно рекомендовать при остром гепатите А и хронических гепатитах В и С, гипомоторной дискинезии желчевыводящих путей [117; 126], у пациентов группы риска по холелитиазу [76], в целях профилактики нежелательных гепатотоксических реакций при химиотерапии туберкулеза [2]. Лив-52 применяют при гипопротеинемии, анорексии, в период реконвалесценции после тяжелой болезни, травм и ожогов, при сахарном диабете, длительном приеме антибиотиков и других гепатотоксических лекарств [120].
К флавоноидным гепатопротекторам относится флакозид. Механизм действия препарата связывают с антиоксидантной активностью и стабилизацией клеточных мембран. Показаниями к его назначению являются хронические диффузные поражения печени, включая неалкогольный стеатогепатит. Флакозид противопоказан при острой печеночной недостаточности и других тяжелых нарушениях печени, а также при холестазе [120].
Из семян тыквы получен препарат тыквеол, терапевтический эффект которого обусловлен биологической активностью комплекса веществ (витамины, антиоксиданты, полиненасыщенные жирные кислоты и др.). Считают, что препарат обладает мембраностабилизирующими свойствами, оказывает противовоспалительное, прорегенераторное и желчегонное действие. Однако адекватные клинические исследования по оценке эффективности и безопасности тыквеола не проводились [84].
В Украинской фармацевтической академии проведено исследование гепатозащитных свойств флавоноидного препарата пифламина из травы гороха посевного [135]. Установлено, что пифламин проявляет высокие антиоксидантные свойства, оказывает гепатопротекторное действие на различных моделях острой и хронической патологии печени. Там же создан препарат альтан на основе эллаготаннинов из шишек ольхи клейкой. Субстанция альтан представляет собой стандартизованный полифенольный комплекс. Гепатозащитная активность альтана изучена на модели острого поражения печени тетрахлорметаном [15], а также в условиях острых токсических гепатитов, вызванных этанолом и четыреххлористым углеродом (CCl4). В условиях алкогольного гепатита альтан восстанавливает функциональную активность митохондрий до уровня контрольных животных и увеличивает гидроксилазную активность микросом при CCl4–гепатите [29].
В практической гепатологии нашли широкое применение препараты на основе суммы флавоноидов бессмертника песчаного (фламин), скумпии коггирия (флакумин), ландыша дальневосточного (конвафлавин), которые используются в комплексной терапии вирусного гепатита, хронических гепатитов, токсических (в том числе лекарственных) поражений печени, циррозов печени и др. [73].
Гомеопатическим гепатопротектором является препарат галстена. Галстена состоит из пяти натуральных компонентов, обладающих гисто- и органотропностью к гепатобилиарной системе (Carduus D1, Taraxacum D6, Chelidonium D6, Natrium sulfuricum D12, Phosphorus D12). Эти компоненты подобраны в таком составе и соотношении, что оказывают многостороннее регулирующее воздействие на печень и желчные пути, сочетая действие гепатопротектора, спазмолитика, противовоспалительного, желчегонного и холеретического средства [55; 74]. Основу галстены составляют экстракты чистотела большого, одуванчика лекарственного и чертополоха курчавого.
Фосфолипидные гепатопротекторы
К числу наиболее широко употребляемых гепатопотекторов относятся препараты, содержащие эссенциальные фосфолипиды (ЕPL). ЕPL представляют собой высокоочищенный эксракт из бобов сои. Основным его компонентом является полиненасыщенный фосфатидилхолин - 1,2-дилинолеоил-фосфатидилхолин (DLPC). На долю DLPC приходится 40-52% от общего количества фосфатидилхолинов, входящих в состав EPL. В этом состоит существенное отличие ЕPL от фосфолипидов, содержащихся в мембранах организма человека, где преобладают насыщенные или мононенасыщенные жирные кислоты. Это химическое отличие определяет терапевтическое преимущество EPL перед другими фосфолипидами [119].
Гепатопротективный эффект ЕPL реализуется путем встраивания их молекул непосредственно в структуру поврежденных гепатоцитов, устранения дефектов и восстановления барьерной функции мембран. Печень примерно на 80% состоит из мембран и ее дезинтоксикационный потенциал определяется, прежде всего, их нормальным функционированием. С этой точки зрения крайне важно, что ЕPL влияют на мембраны всех структур печени. Высокая активность в отношении мембран позволяет назвать применение ЕPL “мембранной терапией” [32]. Молекула фосфатидилхолина состоит из гидрофильной головки, образованной фосфатной группой и остатком холина, и отходящих от нее двух гидрофобных “хвостов”, состоящих из цепей жирных кислот [52]. В водной среде молекулы подвергаются агрегации, в результате чего образуется двойной слой. Гидрофильные головки располагаются на стороне, обращенной к воде, а гидрофобные хвосты формируют середину двойного слоя, вытесняя оттуда молекулы воды. Подобная структура обеспечивает, с одной стороны, непрерывность, а с другой стороны, текучесть мембран. Кроме того, нормализация структуры и функции клеточных мембран под влиянием ЕPL, способствует снижению доступа кислорода в гепатоциты и тем самым уменьшению ПОЛ и образования обладающих повреждающим действием свободных радикалов [21].
Почти за полувековой период, прошедший с момента получения эссенциальных фосфолипидов, они были тщательно изучены в экспериментах in vitro, опытах на животных, клинических исследованиях и при широком применении в медицинской практике. Так, в эксперименте эссенциальные фосфолипиды исследовались у 7 видов животных на 30 различных моделях, включая, химическую и лекарственную интоксикацию четырехлористым углеродом, этиловым спиртом, органическими растворителями, парацетамолом, тетрациклином и индометацином [32]. Благоприятный эффект эссенциальных фосфолипидов, по данным электронно-микроскопического исследования, выражался нормализацией структуры мембран и органелл клетки, уменьшением жировой дистрофии и некроза гепатоцитов. Кроме того, под их влиянием довольно значительно улучшались биохимические показатели – окисление липидов, активность трансаминаз, метаболизм гепатоцитов и др. Очень важным, с клинической точки зрения, эффектом является усиление под влиянием EPL регенерации клеток печени и уменьшение образования соединительной ткани [119].
Влияние EPL на алкогольные поражения печени в течение более 20 лет изучалось на обезьянах, у которых удается воспроизвести повреждения, идентичные развивающимся у человека [153]. В этих исследованиях убедительно показана эффективность EPL, которые достоверно замедляли прогрессирование заболевания и предупреждали его переход в стадию тяжелого фиброза. EPL приводят к полному прекращению прогрессирования алкогольных поражений печени на ранней стадии и даже регрессу тяжелых поражений [136; 153]. В эксперименте продемонстрирована способность EPL оказывать защитное действие при облучении [166].
Предполагается, что замедление под влиянием EPL скорости образования фиброза печени, вызванного токсическими агентами, и ускорение регрессии предсуществующего фиброза частично обусловлены уникальной способностью основного компонента EPL (DPLC) активировать коллагеназу липоцитов. Такая способность не была выявлена ни у одной другой фосфатидилхолиновой молекулы, в т.ч. дилинолеоилфосфатидилэтоноламина, свободных жирных кислот и свободного холина [32]. В экспериментах продемонстрирована также способность EPL усиливать синтез фосфатидилхолинов в печени. Возможно наличие у EPL и других важных механизмов действия, обусловливающих комплексный гепатозащитный эффект, который приводит к: нормализации функции печени и ферментной активности клеток печени; уменьшению уровня энергетических затрат печени; восстановлению и сохранению клеточной структуры печени и фосфолипидзависимых энергетических затрат печени; преобразованию нейтральных жиров и холестерина в формы, облегчающие их метаболизм; стабилизации физико-химических свойств желчи; нормализации обмена липидов, белков и детоксикационной функции печени; замедлению формирования соединительной ткани в печени.
Проведены многочисленные клинические исследования EPL. Ряд исследований были посвящены изучению эффективности и безопасности EPL у детей, в т.ч. новорожденных. Эффективность оценивалась на основании объективных клинических, биохимических, гистологических показателей и данных электронной микроскопии при применении по разным показаниям, включая острый вирусный гепатит, жировую дистрофию, токсическое повреждение и цирроз печени [32; 119]. Положительные результаты в клинике получены при добавлении EPL к дезинтоксикационной терапии при токсических поражениях печени, вызванных галогеновыми углеводородами, фосфорорганическими пестицидами, противоэпилептическими препаратами, грибами [105; 106]. В многоцентровом рандомизированном, двойном слепом, плацебо-контролируемом исследовании, включавшем 32 центра из Германии, Австрии, Польши и Чехии, показана эффективность EPL у больных с хроническими вирусными гепатитами B и C [158]. Положительный эффект EPL был особенно ярко выражен у больных хроническим гепатитом С.
Таким образом, имеющиеся на сегодняшний день данные позволяют рекомендовать применение EPL по широкому кругу показаний, которые можно подразделить на 3 основные группы: заболевания и токсические поражения печени; патология внутренних органов, осложненная повреждением печени; профилактика поражений печени при применении гепатотоксичных лекарственных препаратов и других гепатотоксичных веществ.
EPL используют при хронических гепатитах, циррозе и жировой дистрофии печени, печеночной коме, лекарственном и алкогольном поражении печени, для профилактики рецидивов желчнокаменной болезни, для предоперационной подготовки и послеоперационного лечения больных, особенно в случаях хирургических вмешательств на печени и желчных путях. Их назначают больным с поражением печёночных клеток при сахарном диабете, радиационном синдроме, при ряде других заболеваний, а также для лечения отравлений. EPL входят в стандарты (протоколы) лечения наркологических больных. Их, в частности, рекомендуют при разных стадиях злоупотребления алкоголем, при опийной, кокаиновой и каннабиодной наркомании, при интоксикации, вызванной другими стимуляторами и галлюциногенами, седативными и снотворными веществами, при наркомании и интоксикации, вызванных употреблением летучих растворителей [119].
Показания к применению EPL постоянно расширяются, причём в ряде случаев они основаны не на данных клинических исследований, а на многолетнем опыте применения препарата в клинике и консенсусе специалистов. Согласно требованиям доказательной медицины, это – низший, IV уровень доказательности, однако он правомочен в случае отсутствия специальных исследований в данной области. Так, EPL получили широкое применение для лечения токсикозов беременных, а также для профилактики нарушений функции печени у беременных женщин, особенно при ожирении, наличии сопутствующих заболеваний, многоплодной беременности и т.д. EPL применяют для лечения псориаза, в т.ч. в сочетании с PUVA-терапией. Их использование при псориазе основано на данных о важной роли нарушения активности печеночных ферментов в этиологии и патогенезе заболевания. При псориатической эритродермии добавление внутривенных EPL к PUVA-терапии позволяет значительно снизить количество сеансов последней и добиться полного разрешения дерматоза [166]. Эссенциальные фосфолипиды являются действующим началом ряда препаратов: эссенциале, эссливер, липофен, липофарм Н и других.
Прототипом препаратов, содержащих субстанцию EPL, является эссенциале. Это поликомпонентный препарат, в состав которого входят эссенциальные фосфолипиды, ненасыщенные жирные кислоты (линолевая, олеиновая, линоленовая) и витамины В1, В2, В6, В12, PP, E. Однако все доклинические исследования in vitro и in vivo проводились с “чистой” субстанцией EPL без каких-либо добавочных компонентов, т.е. в них было показано, что терапевтический эффект обеспечивают именно “эссенциальные” фосфолипиды, а не витамины. В то же время, по мнению Е.А. Ушкаловой [119], витамины ухудшают переносимость эссенциале. Побочные эффекты, которые развиваются преимущественнно при длительном применении EPL (диспептические расстройства, диарея, аллергические реакции, в редких случаях индукция холестаза), чаще наблюдаются при приеме препаратов, содержащих витамины. Наличие витаминов в составе препарата имеет и другие существенные недостатки [52]: ограничивает суточную дозу “эссенциальных фосфолипидов”; не позволяет назначать длительные курсы лечения (3 месяца и более) в связи с риском развития гипервитаминоза; не позволяет принимать препарат пациентам с гиперчувствительностью к тем или иным витаминам.
В связи с этим в настоящее время предпочтение рекомендуют отдавать препарату эссенциале Н, содержащему EPL без витаминных добавок, эффективность и безопасность которого были подтверждены в адекватных клинических исследованиях [6].
Изучалось корригирующее действие эссенциале в комбинации с антиоксидантом ?-токоферолом и стимулятором процессов биотрансформации ксенобиотиков кордиамином при холестатическом повреждении структуры печени. Было установлено, что эссенциале вызывает активацию цитозольной глутатион-S-трансферазы и антиокислительной активности плазмы крови, а комбинированное введение эссенциале, кордиамина и витамина Е значительно повышает активность монооксигеназной, глюкуро- и глутатионтрансферазной систем печени [40].
К фосфолипидсодержащим гепатопротекторам относится препарат фосфолип, в состав которого входит лецитин соевых бобов. Действующими веществами лецитина являются эссенциальные фосфолипиды фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозитол, фосфатидилсерин и линолевая кислота. Лецитин обладает выраженной гепатотропностью, оказывает защитный эффект на клеточные структуры гепатоцитов и фосфолипидоопосредованные энзимные системы, нормализует белковый и жировой обмен [37]. Эффективен при поражениях печени различной этиологии – жировой дистрофии, нарушениях иммунного, токсического и лекарственного генеза. Препарат применяют в комплексной терапии хронических и алкогольных гепатитов, циррозов печени, при лучевой болезни и токсикозе беременности [120].
Гепатопротектор липин представляет собой лиофилизированный яичный фосфатидилхолин в липосомальной форме. Он обладает антигипоксическим, антиоксидантным, детоксицирующим, кардиопротективным, противовоспалительным и гепатозащитным действием. Клинические испытания показали эффективность препарата при острых и хронических активных гепатитах, хроническом бескаменном холецистите, циррозе печени и неспецифическом язвенном колите. Липин рекомендован для коррекции нарушенных функций печени и органов ЖКТ во фтизиатрии, гастроэнтерологии, пульмонологии, легочной хирургии, кардиологии и реанимации. Он входит в состав комбинированного препарата лиолив [120].
В состав препарата липофен входят фосфатидилхолин из сои, флакумин, витамины В1, В6 и Е. Сравнительное изучение влияния липофена и эссенциале на функциональную активность митохондрий и микросом печени крыс при гепатитах, вызванных этанолом и ССl4, показало, что липофен проявляет высокую антиоксидантную активность при ферментативном и аскорбатзависимом ПОЛ микросом печени крыс. Липофен восстанавливает функциональную активность митохондрий до уровня интактных животных в условиях алкогольного гепатита и увеличивает гидроксилазную активность микросом печени при CCl4–гепатите [28].
В ГУ НИИ биомедицинской химии РАМН разработан комплексный гепатопротекторный препарат “Фосфоглив”, представляющий собой модифицированный аналог эссенциале с добавлением глицирризиновой кислоты, обладающей разносторонней, в том числе противовирусной активностью, и давно используемой в фармакологии [5; 116].
Глицирризиновая кислота (глицирризин) – тритерпеновый гликозид корня солодки (Glycyrrhiza glabra), состоящий из глицирретовой кислоты и двух остатков глюкуроновой кислоты. Глицирризиновая кислота (ГК) активно используется в медицине в странах Азии, давно известна положительным воздействие на ткань печени и обладает широким спектром биологической активности, не все механизмы которой выяснены достаточно. Противовирусное действие ГК или экстракта корня солодки, в котором она является основным компонентом, выявлено на нескольких видах вирусов. Показано, что ГК и ее соли полностью ингибируют in vitro в концентрациях 0,00105% репродукцию ДНК и РНК вирусов СПИДа, цитомегаловируса, герпеса, гепатитов А, В, С, возбудителя туберкулеза. Механизм столь широкого противовирусного действия ГК связан с инактивацией вируса на ранней стадии репликации за счет присоединения полисахаридного фрагмента ГК к внешней, обогащенной гликолипидами, стороне мембраны. Показано также воздействие ГК на клетки организма “хозяина” - блокирование рецепторов проникновения вируса, а также ингибирование протеинкиназы С, казеинкиназы Р и казеинкиназы С, препятствующее транскрипции и репликации вируса внутри клетки [5].
При клинических испытаниях глицирризин вызывал значительное снижение аминотрансфераз сыворотки (маркерных “печеночных” ферментов) и улучшение гистологической характеристики печени по сравнению с плацебо. В частности, двойное слепое плацебо-контролируемое исследование (80-240 мг ГК внутривенно 3 раза в неделю) на 57 больных с гепатитом С, резистентных к ?-интерферону, выявило снижение активности аланиновой аминотрансферазы при отсутствии побочных эффектов. Долговременное использование ГК предотвращает развитие гепатоклеточной карциномы у больных с хроническим гепатитом С [5]. Высказывается точка зрения, что в основе лечебного действия ГК при гепатитах лежит продукция интерферона. Однако препараты ГК оказывались в ряде случаев более эффективными, чем сам интерферон, что свидетельствует о дополнительных, не совсем ясных пока механизмах ее гепатопротекторного действия. Считают также, что ГК повышает способность печени к выведению токсинов и обладает антиоксидантным действием.
Установлено, что фосфоглив способен восстанавливать клетки печени после острого отравления, а также защищать их в условиях длительного повреждения, имитирующего модель хронического гепатита или цирроза. При этом действие эссенциале оказалось менее выраженным, чем фосфоглива, в плане эффективности устранения биосинтетических и морфологических изменений ткани печени и субклеточных структур гепатоцитов [5]. Новым фосфолипидным гепатопротектором, созданным в Сибирском медицинском университете, является эплир. Препарат представляет собой фракцию полярных липидов озерного илового осадка, содержащую фосфолипиды, сульфолипиды, тетратерпеноидные пигменты и желчные кислоты. Он проявляет достаточно высокую активность, способствует встраиванию нативных фосфолипидов в поврежденные мембраны гепатоцитов, препятствует их жировой дистрофии, улучшает биоэнергетику и синтез гликогена. Входящие в состав препарата тиолы являются предшественниками в синтезе глутатиона. Под влиянием эплира улучшается экскреторная функция печени, усиливается конъюгация билирубина с глюкуроновой кислотой и, таким образом, интенсифицируется его обезвреживание. Эплир ослабляет цитолитический синдром, холестаз, явления белковой и жировой дистрофии. В экспериментальных моделях острого токсического поражения печени эплир не уступал эссенциале по профилактическому действию в отношении структурно-метаболических повреждений печени, предотвращал развитие цитолиза и некроза. В клинических исследованиях показана эффективность эплира при остром и хроническом гепатите токсической, алкогольной и лекарственной этиологии, однако на практике его применяют преимущественно при хронических гепатитах [37].
Выявлено усиление антиоксидантных и гепатопротективных свойств лохеина и эплира при совместном применении [100]. Исходя из этих данных, разработан комплексный гепатопротектор липроксол, содержащий эплир и лохеин в отношении 1:2. В экспериментальных исследованиях установлено, что эффективность липроксола превосходит эффективность составляющих его компонентов – эплира и лохеина. Очевидно, синергизм обусловлен тем, что лохеин как прямой ингибитор ПОЛ, предохраняет мембраны гепатоцитов от деструкции, а эплир обогащает их собственным фосфолипидами (фосфатидилхолином и фосфатидилэтаноламином) [97; 100].
Гепатопротекторы – производные аминокислот
В последние годы в гастроэнтерологии, наркологии и психиатрии нашел широкое применение препарат гептрал [26; 27]. Его активным компонентом является S-аденозил-L-метионин (адеметионин) – физиологический субстрат многих биологических реакций, эндогенно синтезируемый из метионина и аденозина. Адеметионин – универсальный субстрат, уступающий только АТФ в разнообразии реакций. Он выступает в качестве необходимого структурного элемента по крайней мере в трех важных биохимических цепочках: трансметилировании, транссульфурировании и аминопропилировании [131].
К числу наиболее важных реакций адеметионинзависимого трансметилирования относится синтез фосфолипидов (ФЛ). ФЛ – основные стоительные компоненты клеточной мембраны, которые вместе с холестерином обусловливают ее текучесть. В свою очередь мембранная текучесть определяется соотношением ФЛ и холестерина: чем больше ФЛ, тем выше текучесть. Кроме того, зависимое от адеметионина метилирование ФЛ усиливает поляризацию, вызывая их непрерывный переход с внутреннего слоя мембраны на внешний, что также увеличивает ее текучесть. Текучесть мембран гепатоцитов является ключевым фактором в регулировании образования желчи. Нарушение функционирования мембран в ряде случаев сопровождается синдромом внутрипеченочного холестаза. Процесс метилирования ФЛ влияет на функцию Na
+/K+-АТФазного насоса, обеспечивающего транспорт желчных кислот. Нарушение метилирования фосфолипидов ведет к уменьшению активности Na+/K+-АТФазного насоса, изменению электрохимического потенциала мембраны и нарушению транспорта желчных кислот [93].Второй тип метаболических реакций, в которых принимает непосредственное участие адеметионин – реакции транссульфурирования, одной из них является синтез глутатиона – одного из наиболее важных детоксицирующих агентов. Снижение его уровня в печени, возникающее при ее хронических заболеваниях, приводит к снижению защищенности гепатоцитов от свободных радикалов, эндогенных и экзогенных веществ. Другой метаболит адеметионина – таурин – также играет важную роль в детоксицирующей функции печени. Таурин вовлечен в процесс конъюгации желчных кислот. Поскольку конъюгирование желчных кислот с таурином способствует увеличению растворимости, снижение содержания таурина ведет к накоплению токсичных желчных кислот в гепатоцитах. Детоксикация желчных кислот происходит также путем их непосредственного сульфурирования. Сульфурированые желчные кислоты способны защитить мембраны клеток от разрушительного действия несульфурированных желчных
кислот, которые в высоких концентрациях присутствуют в гепатоцитах при внутрипеченочном холестазе [88]. Наконец, третья реакция (аминопропилирование) – имеет отношение к процессам пролиферации гепатоцитов и регенерации печени (синтез полиаминов) [26].Применение гептрала в клинике показало его эффективность при алкогольных, лекарственных поражениях печени, а также при хронических гепатитах [26; 93]. Отмечена эффективность гептрала при хронических диффузных заболеваниях печени с синдромом внутрипеченочного холестаза [27; 88]. Препарат обладает выраженным антихолестатическим и гепатопротекторным эффектом. Гепатопротекторный эффект отчетливо наблюдался при лечении больных хроническим вирусным гепатитом. Э.П. Яковенко, П.Я. Григорьев [131] установили, что гептрал обладает протективным действием в отношении гипоксии и оксидативного стресса, что особенно значимо у больных циррозом печени, предупреждает повреждение митохондрий при приеме алкоголя, снижает уровень ?-некротизирующего фактора. Полученные данные существенно расширяют показания к назначению гептрала при острых и хронических болезнях печени [83].
Еще одним гепатопротектором – производным аминокислот является цитрат бетаина бофур (ЦББ). Активным компонентом препарата ЦББ является аминокислота бетаин и ион цитрата. Была исследована эффективность гептрала и ЦББ при печеночной энцефалопатии в результате хронических заболеваний печени. Гептрал и ЦББ достоверно улучшают биохимические показатели и клинические проявления печеночной недостаточности, у них более выражены антихолестатические свойства, тогда как у эссенциале – антицитолитические. Гептрал оказывает быстрое положительное влияние на когнитивные расттройства, способствует значительному регрессу депрессивного синдрома, нормализует сон, а также улучшает мозговой кровоток, тогда как ЦББ способствует главным образом редукции неврозоподобных расстройств [70; 71].
Заслуживает внимания инфузионный препарат гепасол А, содержащий L-аргинин, L-яблочную кислоту, аспарагиновую кислоту, сорбит, витамины группы В и др. Эффект гепасола основывается на введении в организм важных продуктов метаболизма, участвующих в цикле трикарбоновых кислот и синтезе мочевины. Гепасол оказывает метаболическое, гепатопротекторное и дезинтоксикационное действие. Установлено, что включение гепасола в терапию хронических заболеваний печени способствует уменьшению интоксикации за счет усиления метаболизма аммиака, повышает антиоксидантный потенциал сыворотки крови, нормализует показатели интерферонового статуса, вызывает умеренный иммуномодулирующий эффект [90].
Относительно новым гепатопротектором является орнитина аспартат. В кишечнике он диссоциирует с высвобождением аминокислот орнитина и аспартата. Оба ингредиента принимают участие в регулировании обмена веществ в печеночных клетках, на разных этапах включаются в цикл образования мочевины, усиливая метаболизм аммиака. Кроме того, аспартат служит субстратом для синтеза глутамина, участвует в связывании аммиака в перивенозных гепатоцитах, мозге и других тканях. Эффективность препарата у больных циррозом печени и повышенным уровнем аммиака в сыворотке крови доказана в рандомизированном многоцентровом исследовании [143]. Применяется орнитина аспартат при жировой дистрофии, гепатитах, циррозах, поражениях печени при алкоголизме и наркомании, для лечения печеночных энцефалопатий. Продолжительность курса лечения определяется динамикой концентрации аммиака в крови, состоянием больного и может повторяться каждые 2-3 месяца [120].
Описано блокирующее действие орнитина аспартата на катаболизм мышц, что может играть благоприятную роль у некоторых категорий пациентов, например, с тяжелыми ожогами. Препарат способствует выработке инсулина и соматотропного гормона, улучшает белковый обмен при заболеваниях, требующих парентерального питания, хорошо переносится
[3; 120]. Неспецифическое защитное действие на клетки печени оказывает другой препарат орнитина - орницетил (нейтральный альфакетоглютарат орнитина). При остром вирусном гепатите он снижает билирубин, способствует улучшению аппетита и общего состояния. Ценным качеством препарата является способность оказывать лечебный эффект без изменения кислотно-щелочного равновесия, электролитного и водного баланса. Применяют орницетил после перенесенной печеночной комы, при портокавальной энцефалопатии, гепатитах, полинейропатиях у алкоголиков [12].Гепатопротектор глутаргин представляет собой соль двух аминокислот – аргинина и глутаминовой кислоты. В механизме действия препарата основная роль принадлежит его способности связывать эндогенный аммиак, накапливающийся в избыточных (токсических) концентрациях при нарушении детоксицирующей функции печени. Нейтрализация аммиака глутаргином осуществляется путем активации двух ключевых биохимических процессов – превращения аммиака в мочевину в орнитиновом цикле мочевинообразования (цикл Кребса-Генселейта) и его связывания с глутаминовой кислотой с образованием глутамина. Другие механизмы действия глутаргина включают стабилизацию клеточных мембран гепатоцитов, нормализацию перекисного окисления липидов, повышение энергообеспечения
гепатоцитов, стимуляцию репаративных процессов в клетках печени, восстановление активности изоферментов системы цитохрома Р-450, нормализацию процессов желчеобразования и желчеотделения [6; 120].Показаниями к применению глутаргина являются острые и хронические гепатиты различной этиологии, цирроз печени, печеночная энцефалопатия, лептоспироз, отравления гепатотропными ядами (грибы, химические и лекарственные вещества). Препарат предупреждает развитие прекомы и комы при острой печеночной недостаточности и снижает проявления интоксикации аммиаком при хронической печеночной недостаточности. Его можно назначать в острой стадии заболевания в качестве дезинтоксиканта и донатора оксида азота, а в период реконвалесценции – как гепатопротектор [120].
Препараты селена
Глутатионовая система защиты клетки от СРО обеспечивается специальными ферментами: глутатионпероксидазой, глутатионредуктазой и глутатион-S-трансферазой. Ведущую роль в инактивации липидных гидроперекисей большинство авторов приписывают глутатиопероксидазе (ГП). ГП состоит из 4 субъединиц, каждая из которых содержит селен (Se) в виде селеноцистеинового остатка. Недостаточное поступление Se с пищей приводит не только к уменьшению его уровня в крови и органах, но и к падению активности ГП в них, а также к инициации ПОЛ. Отсюда следует, что поддержание физиологического уровня данного микроэлемента гарантирует стационарный уровень СРО. Из селенсодержащих препаратов на сегодняшний день многосторонне изучен селенит натрия. Однако эти исследования носят преимущественно экспериментальный и эпизодически клинический характер. Сложность применения препаратов, содержащих селен, обусловлена необходимостью учета селенового статуса организма, уровня поступления витаминов А и С, которые способствуют усвоению селена, его транспорту и утилизации в ферменте [14].
Как кофактор ГП селен участвует в детоксикации перекиси водорода и гидроперекисей ненасыщенных жирных кислот, тем самым препятствуя их распаду, вудущему к образованию чрезвычайно реакционноспособного гидроксильного радикала. Именно антиокислительной акивностью объясняются защитные эффекты микроэлемента при действии ксенобиотиков и других факторов, стимулирующих процессы СРО липидов [141]. В эксперименте установлено, что селеносодержащие препараты в терапевтических дозах оказывают гепатопротекторное действие при фосфорной интоксикации [127]. Селеноорганическое соединение эбселен предотвращает развитие галактозаминового гепатита [123]. Новое соединение селена – пиперидиний (диалкил) селенофосфатов (ПСФ) по антиокислительному эффекту значительно превосходит селенит натрия. Предполагается, что катионный атом азота в составе ПСФ является ловушкой для активных форм кислорода, следовательно усиливает конечный антиоксидантный эффект соединения [127].
Препараты животного происхождения
Среди гепатопротекторных средств есть препараты животного происхождения. Преимущественно это экстракты или гидролизаты ткани печени (органопрепараты), содержащие разнообразные высокомолекулярные компоненты, а нередко – и низкомолекулярные вещества. Некоторые из них обладают ферментативной активностью. Механизм действия органопрепаратов комплексный, включающий прямое и опосредованное активирующее влияние на процессы регенерации. Активация синтеза белка препаратами животного происхождения может осуществляться за счет действия входящих в них веществ пептидной или нуклеиновой природы, обладающих соответствующими репарирующими свойствами. В механизме репаративного действия некоторых препаратов определенное значение имеет включение их компонентов в синтезируемые соединения [120]. К средствам животного происхождения относятся сирепар, витогепат, вигератин, тропофар и гепатосан.
Из отечественных препаратов, в первую очередь, следует выделить гепатосан – препарат, получаемый из печени животных в результате сублимационной сушки. Считают, что попадая в организм человека, клетки печени оживают и начинают работать как гепатоциты на уровне кишки. Этот эффект зарегистрирован в ходе изучения короткоцепочных жирных кислот. Ростовые факторы, распавшиеся в кишечнике, всасываются и оказывают действие на уровне печеночной клетки. Гепатосан оказывает метаболическое и мембраностабилизирующее действия. Максимально эффективен препарат у больных с патологией печени в стадии цирроза. У этой группы больных он должен использоваться продолжительно, при этом уменьшается всасывание метаболитов толстокишечной микрофлоры и постепенно уменьшаются явления энцефалопатии [75].
Ряд препаратов (сирепар, витогепат, вигератин) созданы на основе гидролизатов экстрактов печени крупного рогатого скота и содержат комплекс витаминов пластического обмена, прежде всего, цианокобаламин, аминокислоты, низкомолекулярные метаболиты и, возможно, фрагменты ростовых факторов печени. Вигератин наряду с гидролизатами печени и витаминами содержит еще и панкреатин. Эти препараты ослабляют продукцию диеновых конъюгатов и малонового диальдегида, снижают проницаемость мембран гепатоцитов в отношении поступления в кровь аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы, усиливают секрецию желчи. Они предназначены для лечения хронических гепатитов и циррозов, а также токсических поражений печени. Их нельзя назначать при остром гепатите, поскольку в этом случае повышается риск развития цитолитического, мезенхимально-воспалительного и иммунопатологического синдромов [120]. Тропофар содержит полипептидные компоненты клеточных мембран гепатоцитов, экстрагируемых из печени крупного рогатого скота. Его терапевтический эффект связан со способностью уменьшать повреждение структурных компонетов мембран гепатоцитов, стимулировать синтез белков и предупреждать цитолиз гепатоцитов [120]. К гепатопротекторам животного происхождения можно отнести препарат эрбисол, получаемый из эмбриональной ткани крупного рогатого скота. Он обладает эндогенным регенераторным и иммуномодулирующим действием, индуцирует синтез интерферона. Показан при острых и хронических гепатитах, в т.ч. вирусных и лекарственных, гепатозах и циррозах печени [79].
Препараты урсодегидрохолевой кислоты (УДХК)
Нарушение функций печени часто сопровождается холестазом, этиология и механизмы развития которого многофаторны. Так, гепатоцеллюлярный и каналикулярный холестазы могут быть обусловлены вирусным, алкогольным, лекарственным, токсическим поражениями, застойной сердечной недостаточностью, метаболическими нарушениями [74].
Из препаратов, воздействующих на определенные звенья патогенеза холестаза, в настоящее время широко используется урсодеоксихолевая кислота – вещество, относящееся к группе гидрофильных желчных кислот, обладающее выраженными антихолестатическими и гепатопротекторными свойствами. Механизмы действия УДХК сложны и на сегодняшний день окончательно не изучены. Наиболее вероятными представляются цитопротективный и холеретический эффекты вследствие: вытеснения пула токсических гидрофобных желчных кислот [13]; стимуляции экзоцитоза в гепатоцитах путем активации Са
++- зависимой ?-протеинкиназы, который, в свою очередь, уменьшает концентрацию гидрофобных желчных кислот; индукции бикарбонатного холереза, за счет чего усиливается выведение гидрофобных желчных кислот в кишечник [44]. Как было недавно установлено, цитопротективное влияние на клетки билиарного эпителия реализуется через предотвращение выхода цитохрома С из митохондрий, что, в свою очередь, блокирует активацию каспаз и апоптоз холангиоцитов. УДХК снижает насыщенность желчи холестерином за счет угнетения его абсорбции в кишечнике, подавления синтеза в печени и уменьшения секреции в желчь; повышает растворимость холестерина в желчи посредством образования с ним жидких кристаллов; снижает литогенный индекс желчи, увеличивая содержание в ней желчных кислот. Помимо этого, УДХК обладает иммуномодулирующим действием, уменьшая экспрессию молекул HLA I и II классов на клетках билиарного эпителия и снижая продукцию провоспалительных цитокинов (интерлейкинов 1, 2, 6, g-интерферона) [13].Существует много показаний к назначению УДХК. При первичном билиарном циррозе УДХК является препаратом выбора, не только улучшающим клинические (уменьшение слабости, зуда, желтухи), биохимические (снижение ферментов цитолиза и холестаза), гистологические (уменьшения воспаления ткани печени) показатели, но и увеличивающим продолжительность жизни. Назначение препарата патогенетически обосновано при заболеваниях, сопровождающихся внутрипеченочным холестазом: первичном склерозирующем холангите, хроническом гепатите с холестатическим компонетом (особенно алкогольном и лекарственном), муковисцидозе, атрезии внутрипеченочных желчных путей, пострансплантационном холестазе, холестазе при парентеральном питании [13; 75], а также в лечении больных с гипомоторной дисфункцией желчного пузыря [44].
Синтетические препараты
Среди синтетическмх гепатопротектов обращают на себя внимание аналоги фермента супероксиддисмутазы (СОД) (эрисод, орготеин и др.), и препараты, созданные на основе координационных соединений. Известно, что для проявления биологической активности металлоферментов существенным является тип связи металла с белком и его пространственная конфигурация. Так, связь меди в СОД осуществляется за счет комплексообразования с атомами азота, являющимися активными лигандами. Именно главные принципы лигандообразования, как одно из направлений моделирования ферментных систем, послужили обоснованием для создания препарата “Антраль” [14].
Антраль получен на основе координационного соединения алюминия с аминокарбоновой кислотой. Он отличается выраженной антиоксидантной активностью, обеспечивающей гепатозащитный эффект. Механизм антиоксидантного действия антраля обусловлен, вероятно, как свойствами входящего в его состав металла, так и фармакологической активностью N-фентраниловой кислоты. Наряду с антиоксидантной активностью, антраль проявляет капилляроукрепляющее, антиэкссудативное, анальгезирующее действие [30; 62]. Назначение антраля рекомендовано при терапии вирусных, токсических, алкогольных гепатитов, циррозов печени [122].
Тиотриазолин – гепатопротекторное средство из группы тиазола (морфолиновая соль 3-метил-1,2,4-триазолил-5-тиоуксусной кислоты), обладающее антиоксидантным, мембраностабилизирующим, иммунокорригирующим и анаболическим действием. Предупреждает гибель гепатоцитов, снижает уровень жировой инфильтрации и распространение центролобулярных некрозов печени, способствует процессам репаративной регенерации гепатоцитов, нормализует в них белковый, углеводный, липидный и пигментный обмен. Кроме того, этот препарат увеличивает скорость синтеза и выделения желчи, нормализует ее химический состав. Тиотриазолин усиливает компенсаторную активацию анаэробного гликолиза, устраняет угнетение процессов окисления в цикле Кребса с сохранением внутриклеточного пула АТФ [96].
В гепатологии тиотриазолин применяют при хронических гепатитах, при печеночной недостаточности у пациентов, оперированных по поводу механической желтухи, желчно-каменной болезни и циррозах печени. Может вызывать гипертермическую реакцию, лихорадку и кожные высыпания, которые исчезают после отмены препарата [120]. Гепатопротекторное действие антраля и тиотриазолина было изучено при лечении больных хроническим гепатитом [122]. Отмечено, что эти лекарственные средства обладают мембраностабилизирующим, холатостимулирующим, иммуностимулирующим, умеренным антиоксидантным и противовоспалительным действием [23; 30].
Зиксорин (флумецинол) по химической структуре является 3-фторметил-?-этилбензгидролом. Препарат обладает относительно избирательным действием на микросомальные ферменты печени, индуцирует оксидазную ферментативную активность, усиливает образование глюкуронидов, способствует выведению из организма эндогенных и экзогенных метаболитов, увеличивает выделение желчи. Препарат применяется при функциональной гипербилирубинемии, хронических диффузных заболеваниях печени, желтухах, обусловленных энзимопатиями и доброкачественным внутрипеченочным холестазом, пищевой аллергии, сопровождающейся желтухой, а также для предупреждения и лечения желтухи у новорожденных. Есть сведения об эффективности зиксорина в комплексной терапии кожных заболеваний (псориаз, атопический дерматит), у больных, получающих противотуберкулезные средства [73].
Препараты других групп
С гепатопротекторной целью часто применяют препараты витаминов, например, токоферола ацетат. Токоферола ацетат, являясь обязательным структурным компонентом липидного бислоя мембран, оказывает стабилизирующее действие на протоплазматические и субклеточные мембраны гепатоцитов.
Как антиоксидант и мембраностабилизатор он препятствует репрессии ферментов гидроксилирующей системы при ишемических и постишемических состояниях печени, предупреждает нарушения со стороны состава жирных кислот в липидной фракции микросомальных мембран [24].В качестве гепатопротектора препараты витамина Е применяются при острых и хронических токсических гепатитах, в том числе алкогольных и лекарственных, а также при воспалительных и дистрофических заболеваниях печени другой этиологии [14; 64]. Курс лечения токоферолом в дозе 0,6 г/сут больных циррозом печени существенно улучшает их самочувствие и приводит к нормализации основных клинико-биохимических показателей, в первую очередь билирубина. Применение витамина Е у больных хроническим активным гепатитом и циррозом печени не только способствует улучшению клинического течения заболевания, но и нормализует разнонаправленные сдвиги в системе свертывания крови [41; 123].
Регулирующее влияние на обмен липидов и интенсивность ПОЛ в печени оказывает витамин А. Так, ретинол тормозит синтез холестерина, ингибирует СРО, резко подавляет ферментативное и неферментативное ПОЛ в микросомах и других органеллах гепатоцитов. Показана целесообразность включения препаратов этого витамина в лечебный комплекс при вирусном гепатите, циррозе печени [106].
Кислота аскорбиновая при поражениях печени способствует сохранению нормального уровня церулоплазмина сыворотки крови и цитохромоксидазной активности митохондрий печени, повышает активность сукцинатдегидрогеназы и цитохромоксидазы, восстанавливая процессы тканевого дыхания. Антиоксидантное действие данного витамина сопряжено, прежде всего, с антирадикальной активностью и способностью восстанавливать окисленные в процессе ПОЛ резервы глутатиона, токоферола, SH-содержащих белков и др. Как вспомогательное средство кислота аскорбиновая используется в комплексном лечении поражений печени, сопутствующих заболеваний желчевыводящих путей [14]. При сочетании витамина С с жирорастворимыми витаминами отмечается потенцирование антиоксидантного эффекта [123].
Нередко при заболеваниях печени используют витаминные комплексы. Так, комплекс витаминов А, D, E применяется для лечения больных первичным билиарным циррозом [145]. Комплекс ретинола и токоферола оказывает благоприятное клиническое и биохимическое действие у больных острым вирусным гепатитом В. Применение комплекса витаминов С, К, Е у больных механической желтухой приводит к более благоприятному течению послеоперационного периода, быстрому уменьшению гиперферментемии, предупреждению развития печеночной комы [123].
В регуляции метаболических процессов в печени существенная роль принадлежит ?-липоевой (тиоктовой) кислоте. Последняя в качестве кофермента участвует в углеводном и белковом обмене, является одной из важных составляющих в реакциях окислительного декарбоксилирования ?-кетокислот, включая превращение пировиноградной кислоты в ацетил-КоА. В сложном процессе окисления липоевой кислоты, в итоге, образуется 3 молекулы АТФ, что существенно увеличивает энергетический потенциал клетки. Липоевая кислота участвует в процессах окисления жирных кислот в митохондриях, что помимо энергообеспечения клетки, уменьшает содержание в ней субстратов для синтеза триглицеридов и, тем самым, предупреждает развитие жировой дистрофии печени. Липоевая кислота является важной составной частью антиоксидантной системы, она участвует в реакциях восстановления аскорбата в аскорбиновую кислоту (тиоловый цикл), витамина Е и генерации убихинона Q
10, которые являются ведущими компонентами антиоксидантной защиты организма [133]. В настоящее время препараты тиоктовой кислоты (оригинальный препарат тиоктацид) используются в эндокринологии, неврологии и значительно реже, чем это необходимо, в гепатологии [7; 137]. Тиоктацид показан при алкогольном и неалкогольном стеатогепатите, при жировом стеатозе для профилактики осложнений. Лечение можно проводить в виде монотерапии и в сочетании с другими антиоксидантами и гепатопротекторами. Имеются сведения об эффективности тиоктацида в лечении больных вирусным гепатитом С [138]. Обладает гепатопротекторными свойствами и прополис – натуральный продукт, вырабатываемый пчелами. В составе прополиса имеются 23 соединения, обладающие антиокислительными свойствами: флавоноиды, флавоны, ненасыщенные ароматические альдегиды [89]. Прополис в комплексе с витамином Е эффективен при токсическом поражении печени избытком полиненасыщенных жирных кислот [85]. В результате очистки прополиса-сырца получен отечественный препарат с антиоксидантной активностью прополон, его применяют в лечении больных с заболеваниями гепатобилиарной системы [112].В эксперименте изучена гепатопротекторная эффективность ряда циклических и линейных производных мочевины при токсическом поражении печени D-галактозамином. D-галактозаминовый гепатит является адекватной моделью вирусного гепатита человека [16; 157; 161]. Среди исследованных соединений наиболее активными и малотоксичными оказались бензонал, галонал и галодиф. Они улучшали антитоксическую функцию печени, повышая содержание и каталитическую активность цитохрома Р-450; препятствовали цитолизу гепатоцитов и стимулировали реакции с восстановленным глутатионом; усиливали экскрецию бромсульфталеина и билирубина. Бензонал, галонал и галодиф в восстановительном периоде после отравления улучшали функции, метаболизм и струкуру печени, интенсифицируя регенерацию ее паренхимы [82; 101; 102]. В экспериментальных и клинических исследованиях убедительно показана гепатопротекторная активность ряда синтетических антигипоксантов [59; 64; 80; 81; 108]. Так, бемитил, этомерзол (производные 2-меркаптобензимидазола), яктон (производное янтарной кислоты) ускоряют регенерацию печени после частичной гепэктомии. Положительный эффект бемитила и этомерзола обусловлен активацией генома, в результате чего усиливается синтез нуклеиновых кислот и белка. Позитивный эффект яктона связан с усилением функционального взаимодействия энергопродуцирующего митохондриального окисления с энергопотребляющим синтезом белка на рибосомах [25].
Бемитил стимулирует образование ферментов и структурных белков митохондрий, способствует сопряженности окисления с фосфорилированием и увеличению энергопродукции в условиях дефицита кислорода, обладает выраженной антигипоксической и противоишемической активностью. Гепатопротекторному действию способствует и иммуномодулирующий эффект
препарата. Бемитил применяют в комплексной восстановительной терапии гепатитов и цирроза печени, что приводит к ускорению клинического выздоровления и восстановлению физической работоспособности пациентов. Отмечено его положительное влияние на показатели цитолитического и мезенхимально-воспалительного синдромов. Бемитил уменьшает гепатотоксичность противотуберкулезных средств [64]. Препарат противопоказан при гипогликемии [84; 120]. После подтверждения высокой эффективности синтетического антиоксиданта ионола (дибунола) в эксперименте на различных моделях поражения печени его стали применять в клинической практике. При лечении больных хроничеким активным гепатитом ионол снижал содержание продуктов ПОЛ в крови, повышал уровень эндогенных антиоксидантов – витамина Е, восстановленного глутатиона, кортизола [43; 107].При экспериментальном токсическом гепатите установлено гепатопротекторное действие мексидола и других производных 3-оксипиридина [58; 59; 125], фенозана [39], некоторых производных пиримидина, 1,4-дигидроксипиридина, 1-Н-1,2-диазефеналена, метокси- и нитрозопроизводных акридинил-9-тиоуксусных кислот и других соединений с антиоксидантной активностью [1; 34; 35; 86; 130]. Выявлены гепатопротекторные, антиоксидантные, иммуномодулирующие и радиопротекторные свойства бисгемифталата бетулина [53]. При токсических гепатитах, жировой дистрофии печени показаны нестероидные анаболические вещества, например, рибоксин (инозин). Он восстанавливает клеточный метаболизм, способствует образованию эндогенного АТФ [1
2]. По мнению Е.А. Ушкаловой [120], “идеальный” гепатопротектор должен отвечать следующим требованиям: хорошо всасываться в желудочно-кишечном тракте; обладать эффектом первого прохождения через печень; сохранять способность к естественному метаболизму при патологии печени; обладать энтерогепатической циркуляцией; способностью предупреждать образование или связывать высокоактивные повреждающие соединения; обладать противовоспалительными свойствами; способностью подавлять фиброгенез; стимулировать регенерацию печени; невысокой токсичностью.К сожалению, ни один из имеющихся в настоящее время на фармацевтическом рынке гепатопротекторов не удовлетворяет в полной мере этим требованиям, поэтому поиск новых соединений, способных предупреждать и устранять повреждения печени, остается актуальным.
Литература