УДК 616-001.8:615.355
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ЦИНКА И N-АЦЕТИЛ-L-ЦИСТЕИНА ПРИ ОСТРОЙ ЭКЗОГЕННОЙ ГИПОКСИИ (evseev.doc) © 2006 г. Евсеев А. В., Сосин Д. В., Евсеева М. А.На примере нового антигипоксанта из группы аминотиолов (вещество p Q-901) показано, что защитное действие комплексных соединений Zn(II) и N-ацетил-L-цистеина при развитии экзогенной острой гипоксии у мышей сопровождается выраженным уменьшением величины стандартного энергетического обмена. В опытах на крысах показано, что антигипоксический эффект указанных веществ обусловлен их способностью оказывать угнетающее влияние на процессы окисления биологических субстратов в митохондриях.
Ключевые слова: гипоксия, антигипоксанты, окислительные процессы, мыши, крысы.
Введение. В комплексе мероприятий по выживанию в условиях дефицита кислорода, помимо средств индивидуальной защиты и предварительной гипоксической тренировки, используются лекарственные препараты, обладающие антигипоксическим действием [1,4]. Выраженный протективный эффект лекарственных веществ в условиях гипоксии зачастую обусловлен изменением (как правило, понижением) энергетического статуса организма [7]. Ранее в скрининговых опытах на мышах нами было показано, что новые производные аминотиолов (вещества под шифрами p Q-901 и p Q-1104), при в/б введении в дозе 50 мг/кг повышают устойчивость животных к острой экзогенной гипоксии в 4–5 раз [2]. Антигипоксическое действие названных веществ сопровождалось существенным снижением ректальной температуры, что, вероятно, связано с уменьшением производства энергии в тканях [3].
Целью настоящего исследования явилось: изучение влияния нового производного аминотиолов – вещества p Q-901 (бис(N-ацетил-L-цистеинато) аквоцинк(II)дисемигидрат) на величину стандартного энергетического обмена (СтЭО) у мышей, а также поиск возможных механизмов защитного действия веществ этой группы при острой экзогенной гипоксии.
Материалы и методы исследования. Опыты выполнены на 20 лабораторных белых мышах-самцах линии CBF1 массой 20-25 г и 28 лабораторных белых крысах-самцах массой 150-180 г. Потребление кислорода мышами контрольной и опытной групп оценивали по методу Холдена [7], адаптированному нами для решения поставленной задачи. Полученные данные использовали для расчета СтЭО по Крогу. За 30 мин до измерения СтЭО мышам опытной группы в/б вводили p Q-901 (50 мг/кг). У всех мышей измеряли ректальную температуру исходно и через 90 мин после введения p Q-901. В ходе эксперимента у мышей непрерывно проводили регистрацию ЭКГ с помощью оригинальных электродов и усилителя биопотенциалов, сопряженного с лабораторной ЭВМ.
Процессы окислительного фосфорилирования в митохондриях головного мозга изучали по стандартной методике, описанной в работе А. Н. Шарова [6]. После декапитации из мозговой ткани методом дифференциального центрифугирования выделяли митохондрии, в которых полярографически с помощью закрытого электрода Кларка, определяли состояние окислительного фосфорилирования. В качестве субстрата окисления использовали глутамат натрия. По данным полярограммы рассчитывали скорость дыхания митохондрий в различных метаболических состояниях (V0 – скорость окисления субстрата, V3 – скорость фосфорилирующего окисления, V4 – скорость окисления после фосфорилирования), скорость разобщенного дыхания (VДНФ). Также рассчитывали показатели, характеризующие сопряжение процессов окисления и фосфорилирования в митохондриях: дыхательный контроль по Ларди и Уэллману (ДКЛУ =V3/V0), дыхательный контроль по Чансу и Уильямсу (ДКЧУ =V3/V4), коэффициент АДФ/О, стимуляцию дыхания 2,4-динитрофенолом (ДНФ=VДНФ/V4), скорость фосфорилирования добавки АДФ (АДФ/t). Скорости дыхания митохондрий выражали в наног-атомах О2 за 1мин в расчете на 1 мг белка митохондрий. АДФ/t выражали в нмолях АДФ за 1 мин на 1 мг белка. Полученные данные обрабатывали с помощью пакета Statistica 6.0 с подсчетом критерия Стьюдента для непарных выборок. Данные считались достоверными при р <0.05.
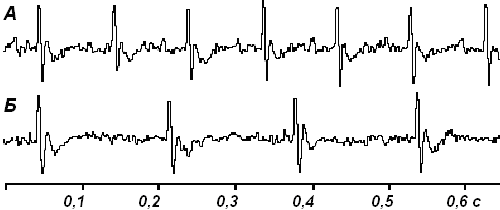
Результаты и их обсуждение. Установлено, что величина СтЭО в контрольной группе мышей (n=10) составила в среднем 15132± 146 ккал/сут, что согласуется с литературными данными [7,8]. Было показано, что интенсивность потребления кислорода подопытными животными (n=10) и уровень СтЭО существенно зависят от степени их фоновой моторной активности. Введение p Q-901 сопровождалось снижением моторной активности животных, снижением их ректальной температуры на 5-7оС, а также достоверным уменьшением частоты следования ЭКГ-циклов с 712± 36/мин до 425± 28/мин (рис. 1).
Величина СтЭО достоверно понижалась. Через 90 мин после введения препарата животным СтЭО составлял величину порядка 5213± 86 ккал/сут. Полученные результаты дали основание предположить, что механизм действия новых производных аминотиолов связан с переводом энергетического обмена мышей на более низкий уровень, что нашло свое подтверждение в наших опытах выполненных на суспензии митохондрий головного мозга крыс.

Рис. 1. Изменение ЭКГ мыши через 60 мин после в/б введения p Q-901 (50 мг/кг). А – исходная ЭКГ, Б – ЭКГ после введения вещества
Митохондрии, выделенные из ткани головного мозга крыс контрольной группы имели следующие показатели: скорости дыхания V0, V3, V4, VДНФ соответственно равнялись – 22.07, 57.88, 25.72, 64.81 наног-атомов О2/мин/мг белка; дыхательный контроль – ДКЛУ и ДКЧУ составили соответственно – 2.66 и 2.27, коэффициент АДФ/O – 1.64, скорость фосфорилирования АДФ/t – 87.16 нмоль/мин/мг белка, 2,4-динитрофенол увеличивал скорость окисления в 2.54 раза (рис. 2).
После введения p Q-901 в дозе 10 мг/кг начальная скорость окисления субстрата (V0) увеличилась на 24.83%. Тем не менее, прочие показатели свидетельствовали об ослаблении энергетической функции митохондрий. Так, скорость окисления после фосфорилирования (V4) снизилась на 13.06%, скорость фосфорилирующего (V3) и разобщенного окисления (VДНФ) снизились, соответственно, на 14.79 и 13.86% в сравнении с контролем. Сопряжение в дыхательной цепи ухудшилось, о чем свидетельствует снижение дыхательного контроля (ДКЛУ) на 32.71%, и скорости фосфорилирования добавки АДФ на 43.33%, что свидетельствует об ограничении образования АТФ в единицу времени.

Рис. 2. Изменение скоростей дыхания (V0, V3, V4, VДНФ) митохондрий через 60 мин после в/б введения вещества p Q-901 в дозах 10, 25 и 50 мг/кг. По оси ординат – скорость дыхания митохондрий (в наног-атом кислорода/мин на 1 мг белка митохондрий). По оси абсцисс – доза p Q-901, N – контроль
При введении p Q-901 в дозе 25 мг/кг дыхание митохондрий становилось слабее. Было отмечено снижение скорости окисления субстрата (V0) на 30.09%, скорости фосфорилирующего окисления (V3) – на 37.66%, скорости окисления после фосфорилирования (V4) – на 25.8%, скорости разобщенного окисления (VДНФ) – на 37.39%. Нарушения сопряжения в дыхательной цепи прогрессировали. Образование АТФ в единицу времени снизилось на 73.3%.
При введении вещества в дозе в дозе 50 мг/кг начальная скорость окисления субстрата (V0) уменьшилась на 36.42%, скорость фосфорилирующего окисления (V3) – на 48.15%, скорость окисление после фосфорилирования (V4) – на 32.46%, скорость разобщенного окисления (VДНФ) – на 43.94%.
Снижение скорости окисления в митохондриях можно расценивать как следствие подавления активности ферментов дыхательной цепи [5,6,8]. Угнетение VДНФ свидетельствует об уменьшении резервных возможностей дыхательной цепи митохондрий, а выраженное нарушение процессов сопряжения, позволяет предположить наличие повреждений в дыхательной цепи и мембранах митохондрий.
Выводы. 1) Протективный эффект нового производного аминотиолов – вещества p Q-901 – реализуется путём обратимого угнетения энергетического обмена, уменьшающего потребность животных в кислороде и обеспечивающего возможность их пролонгированного пребывания в условиях острой экзогенной гипоксии. 2) Защитный эффект вещества p Q-901 при развитии острой экзогенной гипоксии тесно связан со способностью веществ данной группы оказывать угнетающее влияние на процессы окисления биологических субстратов в митохондриях.
Литература
COMPLEX COMPOUNDS OF ZINK AND N-ACYTHIL-L-CYCTEINE IN THE ACUTE EXOGENOUS HYPOXIA
Evseyev A. V., Sosin D. V., Evseyeva M. A.
By using of new amynothiol antihypoxant (substance p Q-901) was shown that protective action of complex compounds of Zn(II) and N-acythil-L-cysteine is accompanied by the significant decrease of standard energetic metabolism. Was shown in experiments on rats that the antihypoxic effect of these substances is provided by supression of the oxidative processes of biological substrates in mitochondria.
Key words: hypoxia, amynothiol antihypoxants, oxidative processes, mice, rats.
Кафедра нормальной физиологии
Смоленская государственная медицинская академия
Поступила в редакцию 28.09.06.