УДК 616-001.8:615.355
ВЛИЯНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ N-АЦЕТИЛ-L-ЦИСТЕИНА С БИОМЕТАЛЛАМИ НА ДИНАМИКУ АДАПТИВНЫХ РЕАКЦИЙ ОРГАНИЗМА
©
2006 г. Парфёнов Э. А., Евсеев А. В., Ковалёва В. Л., Крылов И. А., Правдивцев В. А., Евсеева М. А.Исследовано воздействие комплексных соединений N-ацетил-L-цистеина с переходными биометаллами на воспалительную реакцию и реакции адаптации. Показано, что некоторые из исследованных соединений значительно превосходят по своей активности известные антигипоксанты и актопротекторы, а также обнаруживают заметную противовоспалительную активность.
Ключевые слова:
N-ацетил-L-цистеин, биометаллы, воспаление, адаптацияВведение. На угрожающие здоровью физические, химические или биологические воздействия животные организмы отвечают сложной универсальной реакцией. Цель этой реакции – помочь организму преодолеть патологическое или экстремальное состояние. Патологическое (экстремальное) состояние можно определить как такое, в котором, по крайней мере, хотя бы один из показателей гомеостаза выходит за нормальные рамки. Известны две универсальные защитные реакции, воспалительная и адаптационная. На биохимическом уровне воспалительную реакцию легко обнаружить по наработке большого количества цитокинов, состав и количество которых зависит от фазы воспаления [4]. Развитие приспособительной реакции тоже связано с наработкой химических соединений, не характерных для нормы [3]. Очевидно, экзогенные химические агенты, способные регулировать естественные защитные реакции и возвращать к норме показатели гомеостаза, также можно рассматривать как защитные факторы. Такие агенты должны воспроизводить структуру истинных метаболитов или моделировать ее [7].
L-цистеин входит в состав большинства белков и глутатиона. В белках эта аминокислота играет структурную и функциональную роль. Важнейшее значение имеет реактивность сульфгидрильной группы в составе L-цистеина. В результате ее обратимого превращения в дисульфидную группу становятся возможными внутри- и межмолекулярные перестройки белков, что во многом определяет их поведение в биологических системах. Сульфгидрильная группа – участник многих энзиматических реакций. Особенно важна ее роль в реакциях сопряженного катализа, обеспечивающих синхронизацию событий в метаболических, энергетических и информационных биологических потоках. Редокс-превращения сульфгидрильной группы органических компонентов клетки способствуют сохранению показателей гомеостаза на постоянном уровне [8]. N-ацетил-L-цистеин (L-NAC) – природный метаболит L-цистеина, характерный для животных и растительных организмов. В мозге крысы, например, содержание этого метаболита приближается к таковому глутатиона. По-видимому, можно рассматривать это соединение не только как депо L-цистеина, его предшественника в составе белков и глутатиона, но и как низкомолекулярное соединение, способное выполнять самостоятельные функции, в частности, защитные. Об этом свидетельствует антиоксидантное действие L-NAC в биологических системах [8]. В некоторых из них биологическая активность L-NAC определяется только редокс-активностью (без его предварительного превращения в глутатион) т. к. даже увеличение уровня содержания глутатиона в клетке не зависит от формы использованного стереоизомера – L- или D- [6].
Переходные металлы в биологических системах выполняют функцию активного центра металлоферментов, их избыток депонируется специализированными белками. В патофизиологических условиях наблюдается перераспределение переходных биометаллов. Так, при воспалительной реакции резко усиливается извлечение меди из депо в печени и ее перераспределение в другие органы и ткани [9]. Уровень свободных ионов переходных металлов (транзитный пул) чрезвычайно низок [2]. Из своего депо в орган-мишень ионы переходных металлов доставляются специализированными транспортерами. Установлено, что некоторые противовоспалительные лекарства (индометацин и др.) могут принимать участие в метаболизме меди в качестве ее транспортных средств, что в определенной степени объясняет их лечебное действие [8]. Есть факты, свидетельствующие о том, что L-NAC может выполнять физиологическую функцию хелатора. Например, этот агент регулирует активность факторов транскрипции АР-1 и NF-кВ в качестве хелатора ионов Zn2+ [5], а не ловушки активных частиц, как считали ранее.
Комплексные соединения L-NAC с биометаллами можно рассматривать как метаболиты металла и лиганда. По этой причине вероятность обнаружения защитного эффекта у комплексного соединения выше, чем только у металла или лиганда.
Цель данного исследования – экспериментально подтвердить, что комплексные соединения L-цистеина, L-NAC с переходными биометаллами можно рассматривать в качестве агентов, выполняющих защитную функцию в патологических или экстремальных условиях.
Материалы и методы исследования. Комплексные соединения L-NAC с биометаллами синтезированы в НИИ ЭДиТО ГУ РОНЦ им. Н. Н. Блохина РАМН в рамках исследований по теоретическому и экспериментальному обоснованию концепции физиологически совместимых антиоксидантов [4, 7]. Часть биологических тестов выполнена на кафедре основ медицинских знаний Брянского государственного университета им. акад. И. Г. Петровского (зав. каф. – проф. Н. Н. Самойлов).
Способность комплексных соединений L-NAC выполнять функцию адаптогена в экстремальных условиях изучали на беспородных мышах-самцах массой 20-23 г. В каждом эксперименте использовали контрольную и опытную группы (8-12 животных в каждой). Дозы препаратов составляли 10-50 мг/кг. Водные растворы или стабилизированные суспензии вводили внутрибрюшинно за 1 ч до начала эксперимента. Животным контрольных групп в те же сроки и тем же способом вводили равный объем физиологического раствора. Физическую работоспособность мышей оценивали по продолжительности бега в шестидорожном третбане при скорости движения транспортерной ленты 29-32 м/мин и/или по продолжительности плавания в бассейне с прикрепленным к основанию хвоста грузом, равным 7% от массы тела животного, при температуре воды 28°С. Острую гипобарическую гипоксию (ОГ+Гб) у мышей вызывали в электровакуумном аппарате "Вита" путем имитации поднятия животных на высоту 10000 м над уровнем моря со средней скоростью 50 м/с при 20-22°С. Для моделирования острой нормобарической гипоксии с гиперкапнией (ОГ+Гк) мышей помешали в аптечный штанглаз с притертой стеклянной пробкой объемом 0.25 л. Антигипоксический эффект веществ оценивали по продолжительности нахождения животных в экспериментальных условиях до полной остановки дыхания. В отношении одного из соединений (бис(N-ацетил-L-цистеинато)цинк(II)сульфат) было проведено изучение его влияния (50 мг/кг, внутрибрюшинно) на дыхательную систему мышей по показателям пневмограмм, регистрируемых у животных в условиях ОГ+ГК.
Способность комплексных соединений L-NAC участвовать в регуляции воспалительной реакции оценивали на модели каррагенинового отека конечностей беспородных крыс массой 200-250 г, которым в правую конечность субплантарно вводили 1% раствор каррагенина ("Serva") в объеме 0.1 мл. Исследуемое вещество вводили внутрижелудочно за 1 ч до каррагенина. Измерение объема конечности проводили с помощью плетизмометра ("Ugo Basil") через 4 ч после введения каррагенина. Эффект терапевтического воздействия исследуемого препарата оценивали по степени угнетения воспалительной реакции в сравнении с интактной конечностью данного животного и с реакцией крыс контрольной (нелеченые особи) группы. Прирост объема конечности крысы в результате развития воспалительной реакции вычисляли по формуле:
(V
П –VЛ)----------- х 100,
V
Лгде VП – объем правой конечности, VЛ – объем левой конечности. Торможение воспалительной реакции (в процентах) рассчитывали по формуле:
100 – (V
ОП x 100/VK),где VОП – прирост объема в опыте, V
K – прирост объема в контроле.Статистическую обработку результатов проводили с помощью t критерия Стьюдента и программы "Statgraph".
Результаты и их обсуждение. Всего для исследования по трем выбранным биотестам было предоставлено 11 производных L-NAC, в которых лиганд модифицирован ионами Zn
2+, Co2+, Co3+, Fe2+ или Ti4+.Таблица 1. Влияние металлопроизводных L-NAC на продолжительность бега и плавания мышей в стандартных условиях и на их выживание при гипоксии
Название |
Бег |
Плавание |
Вид гипоксии |
|||||
острая гипобарическая гипоксия |
острая нормо- барическая гипоксия с гиперкапнией |
|||||||
доза, мг/кг |
продолжи-тельность, % к контролю |
Доза, мг/кг |
Продолжи-тельность, % к контролю |
доза, мг/кг |
продолжи-тельность нахож-дения в камере, % к контролю |
доза, мг/кг |
продолжи-тельность нахож-дения в камере, % к контролю |
|
Металлопроизводные |
||||||||
| бис(N-ацетил-L-цистеинато) кобальт(II) |
25 |
149 ± 3* |
||||||
| Бис(N-ацетил-L-цистеинато) кобальт(III) |
10 |
164 ± 3* |
5 |
164 ± 4* |
||||
| бис(2-метил-5-этил-3-гидрокси-пиридиний)
бис(N-ацетил-L-ци- стеинато)эскулетинатотитан(IV) |
25 |
63 ± 10* |
||||||
| бис(N-ацетил-L-цистеинато) железо(II) |
10 |
151 ± 7* |
10 |
175 ± 3* |
10 |
126 ± 6* |
25 |
57 ± 2* |
| бис(N-ацетил-L-цистеинато) аквоцинк(II) |
25 |
64 ± 8 |
50 |
286 ± 12* |
50 |
417 ± 18* |
||
| бис(N-ацетил-L-цистеинато) цинк(II)сульфат |
50 |
244 ± 14* |
50 |
385 ± 16* |
||||
| Бис(N-ацетил-L-цистеинато) эскулетинатотитан (IV) |
25 |
109 ± 16 |
25 |
96 ± 9 |
||||
Вещества сравнения |
||||||||
| Бемитил | 50 |
132 ± 6* |
50 |
124 ± 2* |
||||
| бромантан | 50 |
125 ± 4* |
50 |
128 ± 3* |
||||
| амтизол | 25 |
161 |
25 |
96 |
||||
| ацизол | 10 |
94 ± 15 |
10 |
220 |
10 |
100 |
||
| мексидол | 50 |
110 ± 14 |
100 |
90 ± 18 |
100 |
124 ± 5* |
||
| натрия оксибутират | 50 |
76 ± 10* |
100 |
105 ± 21 |
100 |
100 ± 9 |
||
| нооглютил | 50 |
95 ± 17 |
25 |
172 ± 7* |
50 |
118 ± 4* |
||
| эмоксипин | 50 |
81 ± 12 |
100 |
125 ± 6 |
100 |
131 ± 4* |
||
| этомерзол | 50 |
113 ± 14 |
100 |
151 ± 9* |
100 |
125 ± 6* |
||
Примечание.
*р<0,05 по сравнению с контролем.Представлены результаты биологического тестирования на способность комплексных соединений L-NAC с переходными биометаллами выступать в качестве защитных агентов в экстремальных ситуациях и патологических состояниях (табл. 1, 2).
Таблица 2. Влияние металлопроизводных L-NAC на каррагениновый отек конечности крысы7
Группа |
Объём правой конечнос-ти, см 3 |
Объём левой конечнос-ти, см 3 |
Разность см 3 |
При-рост, % |
Тормо-жение, % |
Контроль, каррагенин |
2.12 ± 0.10 |
0.86 ± 0.10 |
1.26 ± 0.20 |
146.5 |
66.2 |
Каррагенин+N-ацетил-L-цистеинатоцинк(II) |
1.60 ± 0.15 |
1.07 ± 0.07* |
0.53 ± 0.18 |
49.5 |
70.6 |
Каррагенин+ N-ацетил-L-цистеинатокобальт(II) |
1.53 ± 0.03 |
1.07 ± 0.08* |
0.46 ± 0.10 |
42.9 |
69.5 |
Каррагенин+ N-ацетил-L-цистеинатокобальт(III) |
1.50 ± 0.04 |
1.03 ± 0.05* |
0.46 ± 0.08 |
44.6 |
71.5 |
Каррагенин+бис(N-ацетил-L-цистеинато)цинк(II) |
1.37 ± 0.07 |
0.96 ± 0.04* |
0.40 ± 0.05 |
41.7 |
66.2 |
Каррагенин+ бис(N-ацетил-L-цистеинато)кобальт(II) |
1.55 ± 0.02 |
1.03 ± 0.08* |
0.51 ± 0.07 |
49.5 |
47.8 |
Каррагенин+ бис(N-ацетил-L-цистеинато)кобальт(III) |
1.57 ± 0.20 |
0.89 ± 0.10* |
0.68 ± 0.20 |
76.4 |
75.8 |
Каррагенин+ бис(2-этил-6-метил-3-гидроксипиридиний бис(N-ацетил-L-цистеинато)эскулетинатотитан(IV) |
1.49 ± 0.03 |
1.10 ± 0.01* |
0.39 ± 0.03 |
35.4 |
47.2 |
Каррагенин+бис(N-ацетил-L-цистеинато) эскулетинатотитан(IV) |
1.72 ± 0.03 |
0.97 ± 0.01* |
0.75 ± 0.03 |
77.3 |
73.3 |
Индометацин |
1.28 ± 0.06 |
0.92 ± 0.02 |
0.36 ± 0.07 |
39.1 |
Примечание.
*р<0,002 по сравнению с контролем.В качестве веществ сравнения нами бьли использованы самые известные из химических
соединений-адаптогенов медицинского назначения. Три испытанных нами производных L-NAC бис(N-ацетил-L-иистеинато)кобальт(II), бис(N-ацетил-L-цистеинато)кобальт(III) и бис(N-ацетил-L-цистеинато)железо(П) – вполне успешно выдерживают сравнение с известными актопротекторами бромантаном и бемитилом (табл. 1). Лучшие результаты получены в тесте плавания. Из новых антигипоксантов значительно превосходили по своей активности все семь веществ сравнения производные L-NAC с цинком, бис(N-ацетил-L-цистеинато)аквоцинк(II) и бис(N-ацетил-L-цистеинато)цинк(П)сульфат, а бис(N-ацетил-L-цистеинато)железо(II) проявил слабую активность в условиях ОГ+Гб, но в варианте ОГ+Гк выдерживал сравнение с эталонами.
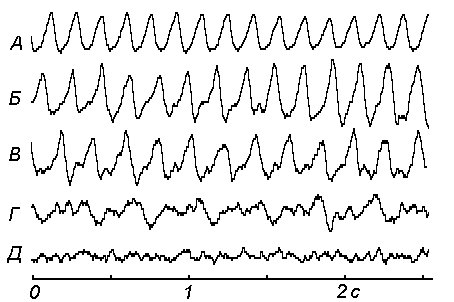
Рисунок 1. Изменение пневмограммы у мышей в условиях острой ОГ+Гк. А – исходная пневмограмма. Б – через 12 мин после помещения в условия ОГ+Гк; В – через 25 мин; Г – через 30 мин; Д – через 33 мин после помещения в условия ОГ+Гк.
Как видно из рис. 1, 2, и 3 бис(N-ацетил-L-цистеинато)цинк(II)сульфат изменяет уровень функциональной активности дыхательной системы мышей таким образом, что позволяет обеспечить новые стартовые возможности для эффективного переживания животными состояния ОГ+Гк – изучаемое вещество вызывает замедление частоты следования дыхательных циклов благодаря чему значительно пролонгирует "период относительного благополучия" в рамках нарастания гипоксического статуса.
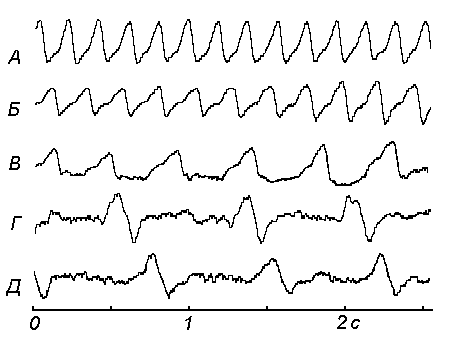
Рисунок 2. Влияние вещества ?Q1104 на параметры пневмограммы у мышей в период инкубации. А – исходная пневмограмма. Б – через 10 мин после введения; В – через 20 мин после введения; Г – через 30 мин после введения; Д – через 60 мин после введения.
Замедление ЧДД, по-видимому, обусловлено замедлением метаболических процессов в тканях под влиянием вещества бис(N-ацетил-L-цистеинато)цинк(II)сульфат, что нашло подтверждение в работе [1].
Все испытанные соединения – новые производные L-NAC – обнаружили противовоспалительную активность, причем только два соединения из восьми уступали в 1.5 раза по своей активности препарату сравнения индометацину, а остальные проявили близкую к нему активность (табл. 2).
Таким образом, результаты, полученные на примерах комплексных соединений цинка, кобальта, железа и титана, подтверждают наши предположение о том, что химическая модификация природного антиоксиданта L-NAC переходным биометаллом позволяет перевести его в разряд защитных агентов. Это обстоятельство можно рассматривать как научное обоснование существования минорных метаболитов с защитными свойствами, представленными комплексными соединениями природных антиоксидантов с переходными биометаллами, а также возможность применения этих метаболитов как принципиально новых безопасных средств хемотерапии.
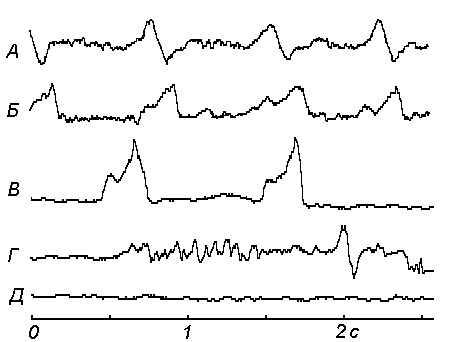
Рисунок 3. Влияние вещества ?
Q1104 (50 мг/кг) на дыхание мышей при развитии ОГ+Гк. А – пневмограмма через 5 мин после помещения животного в условия опыта. Б – через 110 мин; В – через 130 мин; Г – через 140 мин (агония); Д - смерть.Биологическую активность обнаружили 8 соединений из 11 испытанных (73%). Результаты наших исследований являются экспериментальным подтверждением концепции физиологически совместимых антиоксидантов [7]. Выявлены мультиактивность постулированных метаболитов с защитной функцией (только 3 соединения обнаружили активность в одном тесте, остальные 5 – в двух-трех) и модулирующий характер их биологической активности, что позволяет предположить наличие регулирующего характера воздействия испытанных соединении на многокомпонентные защитные системы организма животного.
Литература
INFLUENCE OF COMPLEX COMPOUNDS OF N-ACETYL-L-CYSTEINE WITH BIOMETALS ON DYNAMIC
OF ADAPTIVE REACTIONS OF ORGANISM
Parfenov E. A., Evseyev A. V., Kovaleva V. L., Krilov I. A., Pravdivtsev V. A., Evseyeva M. A.
Action of complex compounds of N-acetyl-L-cysteine with biometals on reaction of inflammation and development of adaptation processes was studied. It is shown that some of these substances have anti-inflammatory activity and much more active than some well known of antihypoxants and actoprotectors.
Key words: N-acetyl-L-cysteine, biometals, inflammation, adaptation.
Кафедра нормальной физиологии
Смоленская государственная медицинская академия
Поступила в редакцию 7.10.06