УДК
615.015+616-001.8
БИОЭЛЕКТРИЧЕСКИЕ ПРОЦЕССЫ КОРЫ ГОЛОВНОГО МОЗГА В
УСЛОВИЯХ ОСТРОЙ ГИПОКСИИ
И ПРИ ПРОФИЛАКТИЧЕСКОМ ВВЕДЕНИИ
НОВОГО АНТИГИПОКСАНТА АМИНОТИОЛОВОГО РЯДА
(КОМПЬЮТЕРНЫЙ АНАЛИЗ)
© 2006 г.
Евсеев А. В. , Правдивцев В. А., Евсеева М. А.
На новой
модели острой экзогенной гипоксии с
гиперкапнией (ОГсГк) в опытах на кошках были
изучены с использованием метода компьютерного
анализа некоторые показатели электрической
активности коры головного мозга (параметры
вызванных потенциалов и импульсной активности
соматосенсорной зоны). Для обеспечения защиты
мозга использовали новое производное
аминотиолов –
бис(N-ацетил-L-цистеинато)аквоцинк(II) дисемигидрат
– pQ-901 (50 мг/кг). Изучаемое вещество
показало значительный антигипоксический эффект
на всех стадиях ОГсГк. Продолжительность жизни
животных в среднем увеличивалась в 2,4 раза по
сравнению с контролем. Была изучена динамика
изменения активности нейронов в условиях ОГсГк и
после введения pQ-901.
Ключевые слова: гипоксия,
гиперкапния, головной мозг, нейрон, вызванные
потенциалы, импульсная активность нейронов,
антигипоксанты, кошка.
Введение. В
условиях эксплуатации летательных
аппаратов, подводных
лодок всегда присутствует некоторая вероятность
отказа систем,
обеспечивающих регенерацию газовых смесей
обитаемых замкнутых пространств. Ухудшение качественных
характеристик газовых смесей инициирует
развитие экзогенной формы острой гипоксии с
гиперкапнией (ОГсГк) у членов экипажа, что, как
правило, нарушает их общее состояние и
работоспособность [1], в
первую очередь, из-за нарушений
функций ЦНС [2, 15].
Успехи современной
химии и фармакологии позволили осуществить
синтез и внедрить в практику так называемые
антигипоксанты – лекарственные вещества нового
класса [4]. Применение антигипоксантов
оказалось действенным при многих видах
хронических форм кислородной недостаточности [4,
7, 11]. Однако, большинство
используемых в
настоящее время антигипоксантов, не обладают
необходимой эффективностью в качестве средств
экстренной помощи, преимущественно из-за
медленной скорости развития терапевтического
действия. Обнадеживающие перспективы открылись
в связи с разработкой очередного поколения
антиоксидантов – физиологически совместимых
антиоксидантов (ФСАО). ФСАО по большей части,
представляют собой комплексные соединения
переходных металлов с биоантиоксидантами [9].
В экспериментах на
мышах, помещённых в условия ОГсГк, было
показано, что производные N-ацетил-L-цистеина и цинка (II)
– вещества pQ-901, pQ-1104, относящиеся
к категории ФСАО, обладают отчетливым
и быстроразвивающимся ангипоксическим
эффектом [6].
Целью
настоящего исследования явилось изучение
влияний антигипоксанта бис(N-ацетил-L-цистеинато)аквоцинк(II)дисемигидрата (вещества pQ-901) на биоэлектрическую
активность высших отделов ЦНС при развитии ОГсГк в
остром эксперименте.
Материалы и
методы. Опыты проводили на кошках массой 3,5-
Статус ОГсГк моделировали
по методике, специально разработанной для
решения поставленной задачи [10]. Сущность метода
– создаётся замкнутый контур, включающий в себя
дыхательную ёмкость объёмом
Вещество pQ-901 в дозе 50 мг/кг кошкам опытной
группы (25) вводили внутрибрюшинно
в 3 мл раствора натрия хлорида (0,9%). Кошкам
контрольной группы (19) вводили аналогичный объём
раствора натрия хлорида (0,9%). Инъекции выполняли
за 90 мин до процедур моделирования статуса ОГсГк. Полученные
результаты обрабатывали статистически на
персональном компьютере с использованием t-критерия Стьюдента и стандартных
программ Statistica for Windows.
Результаты.
На рис. 1А представлен
исходный ВП на одиночное раздражение лучевого
нерва. Видно (рис. 1Б–1, 2, 3, 4),
что по мере перехода
животного из исходного состояния
в состояние ОГсГк амплитуда всех компонентов ВП
достоверно уменьшается, при этом их длительность
увеличивается. Наиболее отчётливо изменения ВП
проявлялись в динамике первичной негативной
волны (ПНВ). Отмеченные изменения ВП у всех
животных контрольной
группы (n=10) были однотипными, что позволило
использовать, прежде всего, амплитудные
параметры ПНВ в качестве маркера функционального статуса
головного мозга в ходе развивающейся ОГсГк.
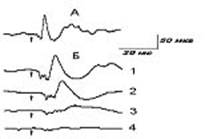
Рис 1.
Вызванные потенциалы соматосенсорной коры
головного мозга кошки при развитии ОГсГк. А –
исходное состояние. Б – на фоне ОГсГк: 1 – легкая стадия ОГсГк
(через 15 мин ОГсГк); 2 -
средняя стадия ОГсГк (через 35 мин ОГсГк); 3 - глубокая стадия ОГсГк
(через 50 мин ОГсГк); 4 -
терминальная стадия ОГсГк (через 55 мин
ОГсГк).Стрелкой обозначен момент нанесения
болевого раздражения
Было принято, что уменьшение ПНВ в
пределах 90-55% от исходного уровня характеризует
легкую, 1-ю стадию ОГсГк (рис. 1Б–1). Уменьшение
ПНВ в пределах 50-30% от исходного уровня
характеризует среднюю, 2-ю стадию ОГсГк (рис. 1Б–2). Уменьшение ПНВ в
пределах 25-10% от
исходного уровня характеризует глубокую, 3-ю
стадию ОГсГк (рис. 1Б–3),
наконец, полное исчезновение ПНВ характеризует
терминальную, 4-ю стадию ОГсГк (рис. 1Б–4). В наших экспериментах лёгкая стадия гипоксии у
животных в среднем
развивалась через 7±1,2 мин после инициации
модельных условий, средняя стадия – через 34±3,3 мин, глубокая – через 50±3,5
мин, тогда как терминальная стадия развивалась
обычно через 55±3,8 мин.
Параллельно с записью ВП у всех
животных в соматосенсорной коре регистрировали
активность одиночных нейронов, как правило, на
глубине порядка 1000 мкм. Для работы
отбирали нейроны, отвечающие антидромным
разрядом на одиночное раздражение аксонов
пирамидного тракта [12]. Из общего числа
идентифицированных корковых мотонейронов (184)
все имели исходную фоновую активность (ФА) и
реагировали на электрическую стимуляцию
лучевого нерва.
В ходе изучения влияния ОГсГк на
импульсную активность
нейронов животных контрольной группы было
зарегистрировано 73 нейрона: 26
– во время развития
1-й стадии ОГсГк, 28 – во время 2-й
стадии, 15 – во время 3-й стадии ОГсГк и 4 во время развития 4-й
стадии.
По итогам данной серии
экспериментов, прежде всего, обращает на себя
внимание характерное изменение параметров ФА.
Так, если исходная фоновая частота нейронной
активности у кошек в соматосенсорной коре
составила 5±0,4 имп/с, то на
1-й стадии развития ОГсГк было отмечено её
значительное увеличение до 23±3
имп/с.
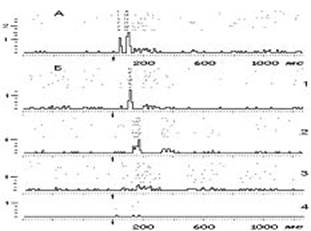
Рис. 2. Динамика
вызванных реакций отдельного нейрона
соматосенсорной коры головного мозга кошки при
развитии ОГсГк.
А – исходное состояние. Б – на фоне
ОГсГк: 1 – легкая стадия
ОГсГк (через 15 мин ОГсГк); 2
- средняя стадия ОГсГк (через 35 мин ОГсГк); 3 - глубокая стадия ОГсГк
(через 50 мин ОГсГк); 4 -
терминальная стадия ОГсГк (через 55 мин ОГсГк). По
вертикали – число импульсов в бине
перистимульной гистограммы; по горизонтали –
время, мс. Стрелкой обозначен момент нанесения
болевого раздражения
В последующем, на 2-й и 3-й стадиях развития ОГсГк, повышенный
уровень ФА обычно сохранялся, хотя её средняя
частота постепенно уменьшалась до величины
порядка 10±2 имп/с. Однако
к моменту окончания 3-й или в начале 4-й стадии
развития ОГсГк ФА нейронов внезапно исчезала.
Столь же значительными были
изменения вызванной активности изученных
нейронов. С целью большей наглядности динамики
ФА и вызванных ответов нейронов во время
стадийного развития ОГсГк в 9-ти дополнительных
опытах были зарегистрированы 9 нейронов,
изменения активности которых наблюдали на всех
стадиях становления и развития у подопытных
кошек ОГсГк. На рис. 2Б–1, 2, 3,
4 демонстрируются результаты одного из
экспериментов. Представленные нейрограммы и
усредненные перистимульные гистограммы
фиксируют типичные изменения фоновой и
вызванной активности зарегистрированного
нейрона на протяжении всего опыта.
Таблица 1.
Пороговые
концентрации кислорода и углекислого газа во
вдыхаемой газовой смеси
при
различных стадиях развития ОГсГк у животных, не
получавших вещество pQ-901
Момент забора пробы |
Концентрация О2 (%) |
Концентрация СО2 (%) |
Исходные параметры |
20,8±0,14 |
0,03±0,01 |
Начало 1-й стадии |
18,5±0,16 |
2.14±0,08 |
Начало 2-й стадии |
16,4±0,14 |
4,05±0,11 |
Начало 3-й стадии |
14,1±0,12 |
6,47±0,13 |
Начало 4-й стадии |
13,5±0,11 |
7,04±0,09 |
Гибель |
13,2±0,12 |
7,54±0,11 |
Итак, на рис. 2А демонстрируется
исходный ответ нейрона на стимуляцию лучевого
нерва. Рис. 2Б–1 – тот же
нейрон у кошки в легкой стадии ОГсГк. Видно, что
под влиянием легкой гипоксии (15 мин) фоновая
частота импульсной активности нейрона с уровня 6
имп/с увеличилась до уровня 21
имп/с. Нельзя не отметить трансформацию
паттерна вызванного ответа нейрона, а также
сокращение продолжительности его следовой реакции.
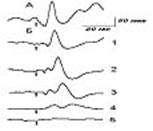
Рис 3. Вызванные
потенциалы соматосенсорной коры головного мозга
кошки, получившей вещество pQ-901,
в динамике развития ОГсГк. А –
исходное состояние. Б-1 –
через 90 мин после введения вещества pQ-901, 2 – легкая
стадия ОГсГк (через 35 мин ОГсГк); 3 - средняя стадия ОГсГк
(через 70 мин ОГсГк); 4 -
глубокая стадия ОГсГк (через 130 мин ОГсГк);
5 -
терминальная стадия ОГсГк (через 160 мин ОГсГк).
Стрелкой обозначен момент нанесения болевого
раздражения
В ходе углубления состоянии ОГсГк
можно было наблюдать дальнейшие изменения
параметров как фоновой, так и вызванной
активности нейрона, как во время развития
средней стадии ОГсГк, так и при возникновении
тяжелой стадии ОГсГк. Во время развития
терминальной стадии ОГсГк нейрон (50 минута
наблюдения) практически становился ареактивным.
Было отмечено, что на протяжении
первых трёх стадий ОГсГк концентрация О2 и
СО2 во вдыхаемом воздухе изменяется
линейно. Переход к очередной стадии наблюдали
при уменьшении содержания О2 и увеличении
концентрации СО2 в среднем на каждые 2%.
Однако к моменту развития 4-ой (терминальной)
стадии потребление животными О2 и,
соответственно, выделение СО2 существенно
снижалось.

Рис 4.
Гистограммы вызванных ответов отдельного
нейрона соматосенсорной области коры головного
мозга кошки, получившей вещество pQ-901, в динамике развития ОГсГк. А –
исходное состояние. Б-1 –
через 90 мин после введения вещества pQ-901, 2 – легкая
стадия ОГсГк (через 35 мин ОГсГк); 3 - средняя стадия ОГсГк
(через 70 мин ОГсГк); 4 -
тяжелая стадия ОГсГк (через 130 мин ОГсГк); 5 - терминальная стадия
ОГсГк (через 160 мин ОГсГк). По вертикали – число
импульсов в бине перистимульной
гистограммы; по горизонтали – время,
мс. Стрелкой обозначен момент нанесения болевого
раздражения
Исследование изменения газового
состава воздуха, используемого для вентиляции
лёгких экспериментальных животных, предоставило
возможность установить пороговые концентрации О2
и СО2, при которых, в условиях
предложенной нами модели ОГсГк, стадии гипоксии
последовательно сменяют друг друга (табл. 1).
Профилактическое введение вещества pQ-901 сопровождалось изменением
исследуемых биоэлектрических реакций мозга
животных, как находящихся вне гипоксии, так и в
условиях ОГсГк.
В частности, под влиянием вещества pQ-901 было отмечено снижение на 28%
амплитуды ПНВ ВП, увеличение латентного периода
генерации ПНВ на 34% (рис. 3А, 3Б–1), а также
пролонгирование латентности вызванных
ответов отдельных нейронов (рис. 4А, 4Б–1). Достоверных изменений ФА
нейронов на фоне действия вещества pQ-901 выявлено
не было.
Для идентификации стадии ОГсГк у
животных, получивших вещество pQ-901, вновь был применён метод
регистрации ВП. Глубину состояния ОГсГк
оценивали по тем же критериям.
Введение животным вещества pQ-901 способствовало достоверному
пролонгированию периода активной деятельности
корковых нейронов, что нашло отражение, как в
характеристиках ФА нейронов, так и в динамике
амплитудно-временных параметров ВП.
На рис. 3Б–1, 2, 3,
4, 5 представлены кривые, отображающие динамику
корковых ВП мозга кошки, помещенной в условия
ОГсГк, на протяжении одного опыта. Было
установлено, что в соответствии с динамикой ПНВ,
состояние ОГсГк на фоне вещества pQ-901 развивается медленнее. Так,
легкую стадию гипоксии регистрировали в среднем
через 12±2,3 мин после
помещения животных в условия опыта. Среднюю
стадию ОГсГк регистрировали через 40±3,9 мин, глубокую – через 86±6,3 мин. Переход в
терминальную стадию отмечали значительно позже
в сравнении с контролем, как правило, спустя 154±13,6 мин от момента помещения
животных в модельные условия.
В опытах по изучению влияния
состояния ОГсГк на характеристики импульсной
активности отдельных нейронов у животных,
получивших вещество pQ-901, было зарегистрировано 92
нейрона: 32 – во время развития 1-й стадии ОГсГк, 24
– во время 2-й стадии, 25 –
во время 3-й стадии и 11– во
время развития 4-й стадии ОГсГк.
Было отмечено, что на фоне действия
вещества pQ-901 ФА нервных клеток достоверно не
изменялась на протяжении всей 1-й (лёгкой) стадии
ОГсГк и составила в среднем 6±0,5 имп/с. На
протяжении 2-й и 3-й стадий ОГсГк ФА нейронов
постепенно возрастала до уровня 15±3,7 имп/с, но к
концу глубокой (3-й)
стадии выявлялась тенденция к снижению ФА. С
наступлением терминальной (4-й) стадии ФА
нейронов не определялась.
Защитное действие вещества pQ-901 при развитии ОГсГк также было
нами исследовано в серии из 10 дополнительных
опытов, в которых изучали разрядную активность
отдельно взятых нейронов (10) по мере развития
всех стадий ОГсГк. На рис. 4Б–1, 2, 3, 4, 5 представлены нейрограммы и усредненные
перистимульные гистограммы, являющиеся
результатом наблюдения за состоянием отдельного
нейрона на протяжении одного эксперимента.
На рис. 4Б–1
представлен ответ нейрона на стимуляцию
лучевого нерва, зарегистрированный через 90 мин
после введения изучаемого вещества. На рис. 2Б–2 – та же клетка при
развитии легкой стадии
ОГсГк через 35 мин после помещения животного в
модельные условия. Обращает на себя внимание
отсутствие заметных различий в уровне ФА
нервной, клетки в сравнении с её исходным
состоянием, при наличии явных изменений в
структуре паттерна вызванного ответа.
По мере углубления ОГсГк (рис. 2Б –3, 4, 5) было установлено, что
нейроны соматосенсорной коры кошек, на фоне
действия вещества pQ-901, в целом, слабее реагируют на
развитие состояния гипоксии в сравнении с
нейронами животных, не получивших данного
вещества, что подтверждается менее выраженными
изменениями ФА и более устойчивыми паттернами
вызванных ответов. Из рис. 4Б–4 видно, что высокий
уровень ФА нейрона сохраняется даже через 130 мин
эксперимента. Состояние ареактивности
развивалось, обычно, к 150 мин.
Продолжительность жизни животных,
помещённых в условия ОГсГк, на фоне действия
вещества pQ-901, согласно полученным результатам,
увеличивалась в 2,4 раза в сравнении с контролем.
Также было отмечено, что гибель животных
наступала при более тяжёлых условиях
кислородного обеспечения и более высокой
концентрации СО2 во вдыхаемом воздухе
(табл. 2).
Таблица 2.
Пороговые
концентрации кислорода и углекислого газа во
вдыхаемой газовой смеси
при
различных стадиях развития ОГсГк у животных,
получавших вещество pQ-901
Момент
забора пробы |
Концентрация О2 (%) |
Концентрация СО2 (%) |
Исходные
параметры |
20,5±0,12 |
0,02±0,01 |
Начало
1-й стадии |
17,7±0,13 |
3.02±0,07 |
Начало
2-й стадии |
15,0±0,11 |
5,81±0,14 |
Начало
3-й стадии |
12,3±0,15 |
8,16±0,17 |
Начало
4-й стадии |
10,4±0,12 |
9,92±0,13 |
Гибель |
8,6±0,10 |
12,43±0,14 |
Обсуждение
результатов. Известно, что лекарственная
защита при развитии состояния гипоксии может
быть в той или иной мере обеспечена
своевременным введением веществ и препаратов,
являющихся представителями многих
фармакологических групп [13]. Однако, по мнению
большинства исследователей, наиболее
перспективными являются разработки антигипоксических средств,
сочетающих в себе энергостабилизирующие
свойства с антиоксидантными [7, 8, 11]. При
возникновении ситуаций, сопровождающихся
развитием гипоксии, такие средства могут быть
использованы для «переживания» гипоксического
состояния [8], т.е. для пассивного выживания за
счёт существенного снижения потребностей
организма в энергетических субстратах.
Развитие состояния ОГсГк, на первых
порах, сопровождается резким увеличением
интенсивности метаболизма, что обусловлено
накоплением в тканях организма избытка
углекислоты [13]. В связи с этим, для обеспечения
эффективной защиты от воздействия ОГсГк
требуются вещества не только повышающие
резистентность организма к гипоксии, но и
снижающие чувствительность клеток и рецепторов
к высокой концентрации СО2
в тканях.
По нашему мнению цинк(II) содержащие производные N-ацетил-L-цистеина (pQ-901, pQ-1104) в перспективе могут быть
отнесены к данной категории веществ. Изучаемое
вещество pQ-901, подобно известным
антигипоксантам гутимину и амтизолу [7], является
серосодержащим аминотиолом. Введение цинка в
молекулу N-ацетил-L-цистеина существенно повышает его
фармакологическую активность. В наших
исследованиях ранее было показано, что вещество pQ-901 способно значимо снижать
интенсивность окислительных процессов в
митохондриях нервных клеток головного мозга [6].
Частичная, обратимая блокада клеточного дыхания
в тканях организма позволяет задействовать
дополнительные ресурсы для обеспечения
минимальных энергетических потребностей
жизненно важных органов – головного мозга и
миокарда, что повышает возможность
выживания в осложнённых гипоксией условиях [14].
Не исключено некоторое отрицательное влияние
такого рода антигипоксантов на функциональную
активность головного мозга [3], что косвенно
подтверждено настоящим исследованием, в
частности, ухудшением ряда характеристик ВП
соматосенсорной коры под влиянием вещества pQ-901.
Вещество pQ-901 продемонстрировало высокую
антигипоксическую эффективность на животных
высокого уровня эволюционного развития –
кошках. При этом критериями эффективности
выступают не только показатель
продолжительности жизни в экстремальных
условиях и повышение резистентности к ухудшению
газового состава вдыхаемого воздуха.
Осуществление непрерывного контроля над
состоянием нейронов
соматосенсорной зоны коры головного мозга
позволяет оценить прямое влияние изучаемого
вещества на функциональный статус высших
отделов ЦНС, предоставляет возможность точнее
определить внутренний потенциал
антигипоксического средства в рамках изучаемого
патологического состояния.
Таким образом, проведенные
исследования показали, что вещество pQ-901 при развитии состояния ОГсГк
эффективно защищает нейроны соматосенсорной
коры головного мозга,
обеспечивая удлинение времени активного
переживания гипоксического статуса более чем в 2
раза
Вещество pQ-901 в совокупности с другими
комплексными соединениями цинка(II)
и N-ацетил-L-цистеина
может быть отнесено к перспективной группе
антигипоксантов энергостабилизирующего
механизма действия.
Литература
1.
Агаджанян Н. А.,
Гневушев В. В., Катков А. Ю. Адаптация к гипоксии и
биоэкономика внешнего дыхания. М.: Изд-во УДН, 1987.
– 186 с.
2.
Евсеев А. В., Евсеева М.
А., Сосин Д. В. Устройство для моделирования
острой экзогенной нормобарической гипоксии без
гиперкапнии у мелких лабораторных животных //
Заявка на изобретение № 2005112394 (014318) От 25.04.2005 г.
3.
Зарубина И. В., Шабанов
П. Д. Молекулярная фармакология антигипоксантов.
– СПб.: ООО «Издательство Н-Л», 2004. – 368 с.
4.
Караш Ю. М., Стрелков Р.
Б., Чижов Я. И. Нормобарическая гипоксия в лечении,
профилактике и реабилитации. М. «Медицина», 1988. –
351 с.
5.
Методические
рекомендации по экспериментальному изучению
препаратов, предлагаемых для клинического
применения в качестве антигипоксических
средств. Под редакцией Л. Д. Лукьяновой М. – 1990. - 18
с.
6.
Новиков В. С.
Физиология летного труда. СПб.: Изд-во «Наука», 1997.
– 410 с.
7.
Шевченко Ю.Л., Новиков
В. С., Шанин В. Ю. Гипоксия. Адаптация, патогенез,
клиника. – СПб, ООО «ЭЛЛБИ-СПб», 2000. – 384 с.
8.
Brooderick
P. A. Dopamine and serotonine in rat striatum during in vivo hypoxic-hipoxia //Metab. Brain Dis. – 1989. – N4. – V.2. –
P. 143—153.
9.
Conev A.,
Marshall J.M. Effect of systemic hypoxia uponcirculation of
the cerebral cortex in the anaesthetized rat // J.
Physiol. Proc. – 1995. – V. 483. – P. 88.
10.
Sutton
J. R., Coates G., Remmers J. Hypoxia. –
BIOELECTRICAL PROCESSES OF BRAIN CORTEX
IN ACUTE HYPOXIA AND UNDER PROTECTION OF NEW AMINOTHIOLIGNIN ANTIHYPOXIC SUBSTANCE
(COMPUTER ANALYSIS)
Yevseyev A. V., Pravdivtsev V. A., Yevseyeva
With using of the new model of the acute
exogenous hypercapnic hypoxia (AHH) some parameters of evoked potentials and impulse
activities of somatosensory cortex neurons were studied by computer analysis in
experiments on cats. The new aminothiol derivant – bis(N-acythil-L-
cysteine)aquozinc(II)disemihidrate – pQ-901 (50 mg/kg) was
used for the brain protection. The studied substance showed high effective antihypoxic
activity in the brain neurons during all periods of AHH. The average life span of cats was
prolonged in 2.4 times in comparison with the control group. The neuron activity dynamic
under AHH condition and after pQ-901 injection was
observed.
Key words: hypoxia, hypercapnia, brain, neuron,
evoked potentials, impulse activity of neurons, antihypoxic substances, cats.