УДК
616.314-089.29-633.001.57: 616.716.4
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ В
ПЛАНИРОВАНИИ ОРТОПЕДИЧЕСКОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ
С ПОЛНЫМ ОТСУТСТВИЕМ ЗУБОВ НА НИЖНЕЙ ЧЕЛЮСТИ
©2006 г. Шашмурина В. Р. ,
Чумаченко
Представлена математическая модель
«съемный протез-имплантат-кость» с переменными
параметрами размеров и плотности костной ткани,
позволяющая изучить биомеханические основы
взаимодействия структур костной ткани нижней
челюсти с полными съемными протезами различной
конструкции и фиксирующими их дентальными
внутрикостными имплантатами.
Биомеханический анализ,
проведенный с использованием данной модели, показал, что в большинстве
случаев целесообразно рекомендовать установку
трех имплантатов для опоры полного съемного
протеза. Применение четырех и более имплантатов
показано для пациентов с пониженной плотностью
губчатой кости и существенной атрофией нижней
челюсти. Полный съемный протез, фиксируемый на
двух имплантатах может применяться у пациентов с
высокой плотностью губчатой кости и при
отсутствии атрофии.
Одной из актуальных
медико-социальных проблем является реабилитация
пациентов с полным отсутствием зубов [3, 6, 26, 33].
Наибольшие трудности возникают при лечении
пациентов с полным отсутствием зубов на нижней
челюсти, особенно при неблагоприятных условиях
полости рта, которые наблюдаются у 30 – 35% больных [24], и безуспешной
психоэмоциональной адаптации к съемным протезам
у 5,7 – 8,2% больных [25]. Одним из современных
эффективных методов компенсации нарушенных
функций у таких пациентов является дентальная
имплантация [4, 19, 20] [12, 13]. Применение имплантатов
для механической фиксации полных съемных
протезов позволяет улучшить стабилизацию и
равновесие конструкции, перевести ее из разряда
неопирающейся в опирающуюся, осуществить
постановку зубов при нефизиологических
вариантах соотношения челюстей, увеличить срок
функционирования съемного протеза за счет
укрепления его базиса фиксирующими матрицами
аттачменов, замедлить резорбцию
альвеолярного гребня; улучшить внешний вид
больного за счет поддержки базисом мягких тканей
лица [22, 23, 34].
Однако дентальная имплантация
требует особого внимания к проведению
этапа планирования и прогнозирования
результатов лечения. Нередко, установка большого
количества имплантатов для последующего
протезирования бывает затруднена из-за
биомеханических проблем, связанных с атрофией
челюсти, ее низкой минеральной плотностью,
противопоказаниями к костной пластике [1].
Обоснование выбора имплантатов и
конструкции протеза зависит от состояния
протезного ложа, других общих и местных факторов
[5, 18, 20, 28]. Однако приводимые в литературе данные о
преимуществе и показаниях к тем или иным
конструкциям фиксирующих систем, способах
соединения супра- и мезоструктуры, выборе
необходимого количества устанавливаемых
имплантатов и оптимального расстояния между
ними весьма противоречивы [7, 15, 17, 37]. До
настоящего времени отсутствуют обоснованные
рекомендации по планированию хирургического и
протетического этапов лечения пациентов с
полным отсутствием зубов в зависимости от
степени и вида атрофии, размеров и плотности
костной ткани нижней челюсти. Не разработано и
удовлетворительной математической модели,
позволяющей оценить состояние опорных тканей
нижней челюсти после удаления
всех зубов. Исследования в этой области
немногочисленны. Так, влияние плотности кости на
ее напряженно-деформированное состояние легло в
основу создания метода оптимального
расположения опорных имплантатов, программы
математического моделирования протезных
конструкций при частичной и полной потере зубов,
разработанных [27]. При
конструировании объемной математической
модели челюсти для имплантации [16] учли
структуру челюсти, т.е. наличие губчатой и
кортикальной костей с
разными модулями упругости.
Индивидуальный подход, обеспечивающий биомеханическую совместимость имплантатной системы и кости, повышение надежности фиксации и долговечного функционирования протезов не может быть осуществлен без выявления закономерностей напряженно-деформированного состояния тканей, окружающих дентальный имплантат и элементы съемного протеза, безопасного уровня нагрузки для ремоделирования кости [27]. Для решения задач биомеханического обоснования конструирования пластиночных протезов, перекрывающих внутрикостные имплантаты, используют разнообразные математические и физические модели с последующим тензометрическим, голографическим, поляризационно-оптическим и математическим анализом [10, 18, 27]. Наиболее перспективным и доступным является математическое моделирование и конечно-элементный анализ [28, 30, 32].
Целью работы явилось создание
математической модели «съемный
протез-имплантат-кость» с переменными
параметрами размеров и плотности костной ткани,
позволяющей изучить биомеханические основы
взаимодействия структур костной ткани нижней
челюсти с полными съемными протезами различной
конструкции и фиксирующими их дентальными
внутрикостными имплантатами.
Материалы и
методы
Математическая
модель создавалась с учетом следующих
параметров: размера,
направления и продолжительности силового
воздействия; конструкции и
материала зубного протеза; формы и материала
зубного имплантата; способа тканевой интеграции
в области имплантата; качества и
количества кости [37].
Биомеханическое исследование
предполагает моделирование механических
свойств костных тканей. Что касается дентина и
кортикальной кости, то они изучены более
подробно. Достоверность данных о плотности и
достаточной независимости механических свойств
дентина и кортикальной кости от индивидуальных
особенностей человека подтверждена в рамках
популяционных исследований. Эти данные
неоднократно использовались при расчетах
различных биомеханических конструкций
минерализованных тканей [27, 29, 30]. Проблемы
возникают при определении упругих механических
свойств губчатой кости. Дело в том, что ее
пористость носит индивидуальный характер и
может существенно зависеть от состояния
здоровья пациента. Следует отметить, если
плотность кости выше, чем у здорового
среднестатистического пациента из
рассматриваемой группы, то это не приводит к
ослаблению конструкции и не ограничивает
допустимые для биологической системы нагрузки.
Увеличение же пористости при соответствующем
уменьшении плотности губчатой кости такие
ограничения, несомненно, накладывает.
При определении плотности
костной ткани предпочтение отдается
компьютерной или магниторезонансной томографии [12]; денситометрической
радиовизиографии [2].
В работе [29] было определено
соответствие между упругими характеристиками
губчатой кости и ее плотностью. За базовую
плотность (![]() ) была принята плотность,
соответствующая плотности губчатой кости у
здорового среднестатистического пациента. Для
этой плотности считались известными модуль Юнга
(Е) и коэффициент Пуассона (n) [14]. А для установления общей связи
) была принята плотность,
соответствующая плотности губчатой кости у
здорового среднестатистического пациента. Для
этой плотности считались известными модуль Юнга
(Е) и коэффициент Пуассона (n) [14]. А для установления общей связи ![]() ,
,
![]() воспользовались
приемами механики композитных материалов [8, 9].
воспользовались
приемами механики композитных материалов [8, 9].
В результате, было установлено, что
при изменении относительной плотности r (действительная
плотность Pi отнесенная к
начальной плотности r0 ) от 0,3 до 1,0, графики
зависимости модуля Юнга, предела упругости на
сжатие и модуля сдвига от плотности имеют вид,
показанный на рис.1.

Рис. 1. Гипотетическая зависимость
упругих модулей губчатой кости от ее
относительной плотности.
Построенная на этой основе модель
биомеханического взаимодействия костных тканей
челюсти и искусственных включений реализована с
помощью базового вычислительного комплекса SPLEN-K,
разработанного фирмой Коммек Лтд. (www.kommek.ru),
объединяющей ученых ряда ведущих технических
вузов Москвы. Механические свойства костных
тканей, материалов имплантатов и протезов, в
рассматриваемой модели, могут быть
аппроксимированы следующим набором констант
теории упругости (табл.1).
В данном исследовании мы изучали
характеристики биомеханической системы при
условии равномерной атрофии беззубой нижней
челюсти. В основу построения расчетных схем
заложена классификация нижней челюсти по ее
количественным и качественным характеристикам
[34], соответствующие им единицы шкалы Хаунсфилда
[5], физические свойства опорных тканей челюсти
[29]. Все рассматриваемые модели нижней челюсти
были классифицированы по признакам атрофии и
плотности губчатой костной ткани. Т.о. за
основные, были приняты девять состояний нижней
челюсти – для трех различных значений плотности
костной ткани P1,
P2, P3
и для трех соответствующих степеней атрофии A, B, C [35]. Четвертая
степень атрофии D
нами не рассматривалась, так как является
противопоказанием к имплантации.
Таблица 1
Физические характеристики материалов модели
№ пп |
Материал имплантата, протеза или костной структуры |
Е, |
n |
кг/мм2 |
кг/мм2 |
1 |
2 |
3 |
4 |
5 |
6 |
| Кортикальная кость | 1610 |
0,25 |
14,8 |
4,5 |
|
2. |
Губчатая кость r (P1) =1,0 r (P2) =0,7 r (P3) =0,4 |
750 289 173 |
0,45 0,44 0,44 |
8,2 3,27 1,9 |
1,5 0,8 0,6 |
3. |
Слизистая оболочка |
0,7 |
0,45 |
1000 |
1000 |
4. |
КХС |
2000 |
0,3 |
19 |
18,9 |
5. |
Титановый сплав |
15000 |
0,34 |
84 |
60 |
6. |
Пластмасса |
300 |
0,33 |
9,9 |
3,0 |
7. |
Эластичная матрица |
0,7 |
0,45 |
10000 |
1000 |
В каждой из локально однородных
односвязных подобластей (I),
неоднородного многосвязного фрагмента костной
ткани челюсти с имплантатом и протезом, должны
выполняться:
§
уравнения равновесия:
![]() ,
(1)
,
(1)
§
экспериментально найденные
соотношения:
![]() ,
(2)
,
(2)
характеризующие
физические инвариантные зависимости между
интенсивностью напряжений и деформаций в
костных тканях челюсти и искусственных
включениях,
§
соотношения,
связывающие компоненты тензора напряжений и
деформаций
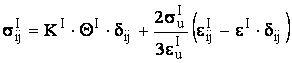 ,
(3)
,
(3)
где
![]() ,
, ![]()
K –
коэффициент объемного сжатия,
dij
– дельта
Кронекера,
§
соотношения Коши:
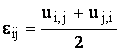 .
(4)
.
(4)
В каждой точке смежных границ
соседних подобластей I
и J принимаются специальные условия
для функций перемещения
![]() ,
(5)
,
(5)
обеспечивающие
жесткое соединение костных тканей между собой и
непрерывность поля деформаций при приложении
нагрузки к моделируемому фрагменту челюсти.
В силу того, что в костных тканях
челюсти при приложении жевательной нагрузки
недопустимо возникновение пластических
деформаций, так как это может привести к
нарушению целостности костных структур и
необратимому изменению биомеханических
параметров челюсти, механические свойства
костных тканей (2),
аппроксимированы упругопластической средой с
линейным упрочнением (рис. 2).

Рис. 2.
Вариант модели физических соотношений в костных
тканях зуба и челюсти.
Модуль Юнга Е связан с модулем сдвига G, коэффициентом объемного
сжатия K и коэффициентом Пуассона n соотношениями:
![]() ,
,
![]() .
(6)
.
(6)
При расчете предельных состояний в
костных тканях зубо-челюстной системы,
имплантантах и протезах в условиях
функциональной и предельной системы внешних
воздействий, используются различные критерии,
основанные на той или иной теории прочности.
Проблема рационального выбора
критерия сводится к определению некоторой
функции ![]() . Если значения главных
напряжений соответствуют состоянию,
предшествующему разрушению, то говорят об
условии разрушения.
. Если значения главных
напряжений соответствуют состоянию,
предшествующему разрушению, то говорят об
условии разрушения.
![]() (7)
(7)
Величина К – критерий
прочности – обычно имеет определенную
физическую интерпретацию: нормальное или
касательное напряжение, интенсивность
напряжений, максимальное удлинение, энергия
формоизменения и т.д. Нам так же необходимо
учитывать, что костные ткани различным образом
сопротивляются сжатию и растяжению. Причем
прочность на сжатие выше прочности на
растяжение. Это влияние можно учесть, например,
если принять, что величина критического
касательного напряжения зависит от величины
критического нормального напряжения,
действующего в той же плоскости. На этом
основывается теория разрушения Мора, которая не
только позволяет охарактеризовать напряженное
состояние при разрушении, но и предсказать
ориентацию плоскости разрушения. Но само
разрушение, при изучении биомеханической
естественно-искусственной системы, не является
главным. Нас в значительно большей степени
интересует вероятный запас прочности
исследуемой биомеханической конструкции и
связанные с этим вопросы выбора того или иного
метода терапевтического или ортопедического
лечения. В этом смысле более удобна теория
разрушения Шлейхера-Надаи [31]. В известном смысле
она аналогична теории Мора, но формулируется в
терминах интенсивности касательных напряжений ![]() и
средних напряжений
и
средних напряжений ![]() . В
опасном состоянии интенсивность касательных
напряжений является функцией средних
напряжений, характерной для данного материала:
. В
опасном состоянии интенсивность касательных
напряжений является функцией средних
напряжений, характерной для данного материала:
![]() (8)
(8)
На плоскости ![]() , s уравнение
(8) определяет некоторую кривую – границу
разрушения (рис. 3а).
, s уравнение
(8) определяет некоторую кривую – границу
разрушения (рис. 3а).
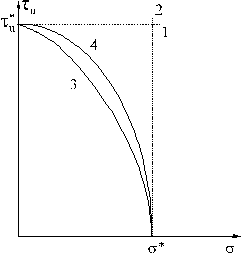
а)
б)
Рис. 3 Предельные кривые теории
разрушения Шлейхера-Надаи (а) и расчетная схема
для определения вероятности разрушения
конструкции (б).
Пунктирная прямая 1
соответствует условию наибольшей интенсивности
касательных напряжений («сдвиговое разрушение»);
прямая 2 – условию наибольшего объемного
растяжения («хрупкое разрушение»). Общий случай
характеризуется некоторыми кривыми 3 или 4. В
зависимости от напряженно-деформированного
состояния один и тот же материала может
разрушаться хрупко и вязко. Теория
Шлейхера-Надаи позволяет учесть двойственность
характера разрушения и построить эффективные
вероятностные оценки. Одной из приемлемых
аппроксимаций кривой Шлейхера-Надаи является
парабола, симметричная относительно оси ![]() и проходящая через
критические точки (
и проходящая через
критические точки (![]() ) и
) и
(![]() ), где
), где ![]() -
максимальное значение интенсивности сдвига, а
-
максимальное значение интенсивности сдвига, а ![]() - максимальное значение
средних растягивающих напряжений. При значениях
- максимальное значение
средних растягивающих напряжений. При значениях ![]() ,
оценка запаса прочности осуществляется по
критерию только сдвигового разрушения.
,
оценка запаса прочности осуществляется по
критерию только сдвигового разрушения.
Так как значения ![]() и
и ![]() получены из опытов на
одноосное растяжение-сжатие, то можно принять,
что
получены из опытов на
одноосное растяжение-сжатие, то можно принять,
что ![]() , а
, а ![]() .
.
Вероятность разрушения (Vp) и запас прочности (Vзп)
в окрестности произвольной точки
рассматриваемой костной ткани с учетом
индивидуальных особенностей всей конструкции и
условий ее нагружения, могут быть получены после
расчета напряженно-деформированного состояния,
в виде соответствующих отношений
![]() ,
Vзп = 1 – Vp
(9)
,
Vзп = 1 – Vp
(9)
где ![]() ,
а
,
а ![]() определяется
как расстояние (по линии, проходящей через точку
определяется
как расстояние (по линии, проходящей через точку ![]() )
от начала координат в системе осей
)
от начала координат в системе осей ![]() до кривой
до кривой ![]() , имеющей вид:
, имеющей вид:
 при
при ![]() (10)
(10)
Как уже упоминалось ранее, в случае,
если ![]() , полагаем
, полагаем ![]() .
.
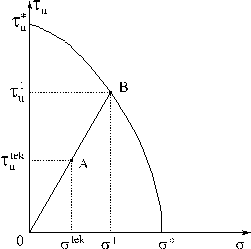
На рис. 3б значение ![]() интерпретируется как
отрезок ОА,
интерпретируется как
отрезок ОА, ![]() - соответствует отрезку ОВ. Точка В, пересечение
луча ОА и кривой
Шлейхера-Надаи, имеет координаты (
- соответствует отрезку ОВ. Точка В, пересечение
луча ОА и кривой
Шлейхера-Надаи, имеет координаты (![]() ).
).
Созданная модель позволяет
проводить расчеты при переменных параметрах:
плотности и атрофии костной ткани, длине
имплантатов и расстоянию между ними, величине и
направлению нагрузки. Действительно,
прогнозирование биомеханических
закономерностей в той или иной конструкции
протеза зависит от величины прилагаемой
нагрузки, то есть характеристик
зубов-антагонистов. Для соблюдения принципа
идентичности условий исследования, а также
учитывая частоту сочетания полного отсутствия
зубов на верхней и нижней челюсти у пациентов
пожилого возраста, мы определили среднюю
вертикальную нагрузку как 1 кг/мм?, сдвиговую – 0,2
кг/мм?.
Результаты и
их обсуждение
Большинство авторов единодушны в
том, что при полном отсутствии зубов для
улучшения фиксации съемного протеза установку
имплантатов следует производить в межментальной
области [33, 38], длину
имплантатов лучше иметь большей, но не менее 10 мм,
если это не ограничивается индивидуальными
размерами челюсти; а количество их должно
быть не менее двух [11, 18]. Эти рекомендации были
учтены нами в работе.
Созданная модель дает возможность
изучить биомеханику системы «съемный протез –
имплантат – кость» в проекции на различные
плоскости, при различном приложении и величине
нагрузки. Модель позволяет в зависимости от
клинической ситуации обосновать с позиций
биомеханики
1) необходимое количество
имплантатов,
2) размеры имплантатов,
3) расстояние между имплантатами,
4) конструктивные особенности
мезоструктуры,
5) способ соединения мезо- и
супраструктуры,
6) выбор конструкционных материалов.
Рассмотрим сравнительную
характеристику запаса прочности у
биомеханической системы нижней челюсти и
полного съемного протеза с балочным
полулабильным соединением для трех уровней
атрофии и различного числа опорных винтовых
титановых имплантатов «Альфа-Био» [21].
Распределенную нагрузку будем прикладывать к
протезу в одном случае в центре, имитируя прямую
нагрузку на имплантаты, в другом – на край
протеза, имитируя максимальную вывихивающую
нагрузку. Расчеты, выполненные в соответствии с
описанной методикой, сведем в таблицу 2, где в
соответствии с заданными нагрузками, атрофией и
плотностью губчатой кости, приведены
вероятностные значения запасов прочности
рассматриваемой биомеханической конструкции.
Расчетная схема и примеры рассчитанных полей
вероятности разрушения для центральной и
краевой нагрузки приведены на рисунках 4 и 5.
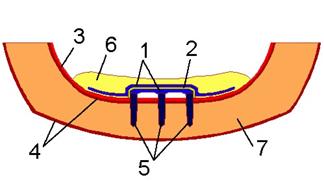
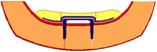
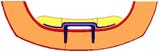
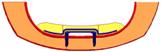
Рис. 4. Расчетная схема
биомеханической системы «челюсть-протез».
1 –
сплав КХС, 2 – эластичная прокладка, 3 –
слизистая, 4 – кортикальная кость, 5 – титановые
имплантаты, 6 – пластмассовый протез, 7- губчатая
кость.
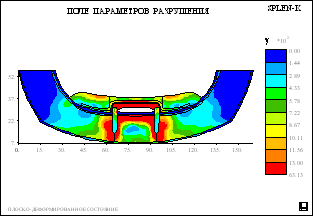
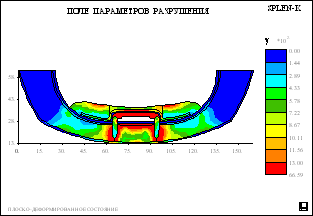



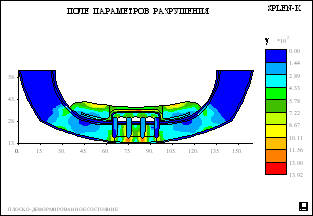
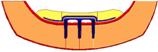
Рис. 5.
Распределение полей относительной вероятности
разрушения в биомеханическом сегменте нижней
челюсти и полносъемного протеза с балочной
системой полу лабильного соединения для второго
и третьего уровня атрофии и различного числа
опорных имплантатов.
Из приведенных результатов следует,
что при эксплуатации протезов данного типа, их
эффективность и запас прочности будут тем выше,
чем больше число опорных
имплантатов. Однако эта зависимость имеет
нелинейный характер при переходе от двух опорных
имплантатов к трем, запас прочности, в некоторых
случаях (для центральной нагрузки), возрастает
почти в два раза. А при переходе от трех опор к
четырем, преимущества остаются минимальными.
Таким образом, можно заключить, что опору на
четыре и большее число имплантатов следует
рассматривать только
в случае, если при значительном уровне атрофии
плотность губчатой кости пациента существенно
понижена. На рисунке 5 приведены рассчитанные
поля вероятностей разрушения биомеханической
конструкции с относительной плотностью губчатой
кости 0,7 при центральной распределенной
нагрузке. Анализ этих полей и обратных к ним
полей запаса прочности, а также всего комплекса
полученных результатов, показывает, что в
большинстве случаев целесообразно
рекомендовать для фиксации полного съемного
протеза установку трех внутрикостных
имплантатов. Четыре и более имплантата показаны
пациентам с пониженной плотностью губчатой
кости и существенной атрофией нижней челюсти.
Система фиксации на двух имплантатах может
применяться у пациентов с высокой плотностью
губчатой кости при отсутствии атрофии.
Конкретные рекомендации целесообразно уточнять
с помощью компьютерного имитационного
моделирования по данным компьютерной томографии
пациента.
Таблица 2
Оценка запаса прочности
зубочелюстной биомеханической конструкции
Относительная плотность губчатой
кости |
|
|
|
|||
Вид нагрузки |
||||||
Центр |
Край |
Центр |
Край |
Центр |
Край |
|
r= 1,0 |
0,478 |
0,776 |
0,372 |
0,763 |
0,335 |
0,797 |
r= 0,7 |
0,467 |
0,742 |
0,369 |
0,745 |
0,334 |
0,796 |
r= 0,4 |
0,406 |
0,678 |
0,361 |
0,687 |
0,334 |
0,757 |
Относительная плотность губчатой
кости |
|
|
|
|||
Вид нагрузки |
||||||
Центр |
Край |
Центр |
Край |
Центр |
Край |
|
r= 1,0 |
0,834 |
0,778 |
0,836 |
0,768 |
0,837 |
0,773 |
r= 0,7 |
0,790 |
0,776 |
0,828 |
0,767 |
0,744 |
0,772 |
r= 0,4 |
0,642 |
0,719 |
0,733 |
0,739 |
0,569 |
0,771 |
Относительная плотность губчатой
кости |
|
|
|
|||
Вид нагрузки |
||||||
Центр |
Край |
Центр |
Край |
Центр |
Край |
|
r= 1,0 |
0,868 |
0,778 |
0,865 |
0,763 |
0,865 |
0,766 |
r= 0,7 |
0,821 |
0,776 |
0,845 |
0,762 |
0,861 |
0,765 |
r= 0,4 |
0,705 |
0,728 |
0,716 |
0,751 |
0,761 |
0,764 |
Заключение
Дальнейшие исследования с
использованием разработанной имитационной
модели позволят оптимизировать конструкции
полных съемных протезов с опорой на имплантаты,
обеспечить равномерное распределение нагрузки
между элементами биомеханической системы,
разработать алгоритм действия врача при
планировании хирургического и ортопедического
этапов лечения пациентов
с полным отсутствием зубов с использованием
перекрывающих съемных зубных протезов,
фиксируемых при помощи имплантатов.
Литература
1. Безруков В.М., Кулаков А.А. Субпериостальная имплантация – как метод хирургической реабилитации пациентов со значительной атрофией челюстей. // Российский вестник дентальной имплантологии. – 2003. - № 1. – С. 60 - 64.
2. Гветадзе Р.Ш., Безруков В.М., Матвеева А.И, Александров М.Т., Бажанов Н.Н., Дронов Д.А. Применение денситометрической радиовизиографии для оценки результатов дентальной имплантации. // Стоматология. – 2000. - №5. – С. 23 – 30.
3. Дадыкин
В.Р., Дадыкин А.В., Дадыкина В.А. Выбор имплантатных
систем для протезирования беззубой нижней
челюсти и хирургической коррекции
функционального состояния мягких тканей
околоротовой области. // Бюллетень
Восточно-Сибирского научного центра СОРАМН. - №1
(11). – 2000. – С. 32 – 34.
4. Иванов
С.Ю., Бизяев А.Ф., Ломакин М.В. с соавт.
Стоматологическая имплантология. - Стоматология
ХХI века. – М., 2000. – 63 с.
5. Иванов
С.Ю., Васильев А.Ю., Буланова Т.В., Гончаров И.Ю.,
Бучнев Д.Ю. Методика предимплантационного
обследования пациентов. // Российский вестник
дентальной имплантологии. – 2003. - № 2. – С. 42 - 43.
6.
Каливраджиян Э.С., Голубев Н.А., Лещева Е.А., Рыжова
Л.П. Применение модифицированной конструкции
съемного протеза с целью повышения
эффективности лечения больных с полным
отсутствием зубов. // Актуальные проблемы
стоматологии. Сб. трудов под ред проф. Лебеденко
И.Ю. – М, 2002. – С. 104 – 107.
7. Кирюшин
М.А. Лебеденко И.Ю., Ревякин А.В.
Напряженно-деформированние состояние с в
системе «Полный съемный пластиночый протез -
нижняя челюсть» со сферической и балочной
системами фиксации на четырех внутрикостных
винтовых имплантатах. // Современная
ортопедическая стоматология. - 2005. - № 4. – С. 92-94.
8.
Композиционные материалы. / Под ред. Л.Браутмана,и
Р.Крока: Пер. с англ. В 8 томах. – 1978.
9.
Композиционные материалы: справочник. / Под ред.
В.В.Васильева, Ю.М.Тарнопольского. -М.:
Машиностроение. - 1990 – 512 с.
10. Корякин
Г.Н. Клинико-рентгенологическое и
биомеханическое обоснование применения
оссеоинтегрированных имплантатов у больных с
потерей зубов. / Дис… канд. мед. наук.- Н-Новгород.,
1997.- 197 с.
11. Матвеева
А.И., Гветадзе Р.Ш., Логинов В.Э., Гаврюшин С.С.,
Карасев А.В. Исследование биомеханики дентальных
имплантатов с использованием методики
трехмерного объемного моделирования. //
Стоматология. – М. – 1998. - №6. – С. 38-44.
12. Матвеева
А.И., Гаврюшин С.С., Борисов А.Г. Использование
математического моделирования при
проектировании протезных конструкций с опорой
на внутрикостные имплантаты. // Российский
вестник дентальной имплантологии. – 2003. - № 1. – С.
10 - 13.
13. Матвеева
А.И., Гветадзе Р.Ш., Хачидзе К.Д., Захаров К.В.
Биомеханические подходы к протезированию в
дентальной имплантологии. // Российский вестник
дентальной имплантологии. – 2003. - № 1. – С. 34 - 37.
14.
Матвейчук И.В.Структурно-функциональная
адаптация костной ткани как композита с учетом
видовых, возрастных и функциональных
особенностей: Автореф. дис. … д-ра биол. наук. - М.,
1998. – 49 с.
15.
Миргазизов М.З. Уровни решения клинических задач
с использованием дентальных имплантатов и новая
классификация отсутствия зубов. // Российский
вестник дентальной имплантологии. – 2003. - № 2. – С.
4 - 7.
16.
Миргазизов А.М., Изаксон М.В. Конечно-элементный
анализ напряженно-деформированного состояния
дентальных имплантатов и окружающей их костной
ткани при неточной посадке литых каркасов //
Российский вестник дентальной имплантологии. –
2003. - № 3/4. – С. 58 - 61.
17.
Миргазизов А.М., Чуйкин Р.Ю. Применение балочных
конструкций на имплантатах при полной утрате
зубов // Российский вестник дентальной
имплантологии. – 2003. - № 3/4. – С. 48 - 51.
18. Олесова
В.Н., Осипов А.В. Изучение процессов
напряженно-деформированного состояния в системе
протез-имплантат-кость при ортопедическом
лечении беззубой нижней челюсти. Ч. 2. Несъемное
протезирование // Проблемы нейростоматологии. –
1998. - № 4. – С. 8 – 11.
19. Олесова
В.Н., Мушеев И.Ю., Поздеев А.И., Рогатнев В.П., Осипов
А.В. Титан оптимальный конструкционный материал
для протезов на дентальных имплантатах //
Российский вестник дентальной имплантологии. –
2003. - № 1. – С. 24 - 27.
20. Олесова
В.Н., Набоков А.Ю., Дмитренко Л.Н., Гарафутдинов Д.М.,
Мушеев И.У. Дахно Л.А., Золотарев А.С.
Компьютеризированное планирование дентальной
имплантации. // Российский вестник дентальной
имплантологии. – 2004. - № 2 (6). – С. 54 - 57.
21. Олесова
В.Н., Магамедханов Ю.Н., Мушеев И.Ю., Гарпафутдинов
Д.М., Золотарев А.С., Кащенко П.В. Сравнительная
оценка эффективности дентальных имплантатов в
зависимости от сроков их нагружения после
двухфазной имплантации. // Российский вестник
дентальной имплантологии. – 2004. - № 2 (6). – С. 36 - 39.
22.
Перевезенцев А.П. Замещение дефектов зубных
рядов с использованием малого количества
имплантатов. // Современная
ортопедическая стоматология, 2004. - № 2. – С. 50 – 53.
23.
Руководство по ортопедической стоматологии.
Протезирование при полном отсутствии зубов. //
Под ред. И.Ю.Лебеденко, Э.С.Каливраджияна,
Т.И.Ибрагимова. – М.: ООО «Медицинское
информационное агенство», 2005. – 400 с.
24. Саввиди
К.Г., Саввиди Г.Л., Щербаков А.С. Опыт ортопедического лечения
пациентов с неблагоприятными клиническими
условиями на беззубой нижней челюсти / Труды У1
съезда Стоматологической ассоциации России. –
М., 2000. – С 405 – 407.
25. Садыков
М.И. Стоматологическая реабилитация пациентов с
полным отсутствием зубов. // Институт
стоматологии. - 2002. – № 2. – С. 30.
26. Свирин
Б.В. Получение функционального слепка с верхней и
нижней челюстей после полной утраты зубов,
обусловленной заболеваниями пародонта. //
Современная ортопедическая стоматология. - 2005. -
№ 3. – С. 50-52.
27. Сухарев
М.Ф., Бобров А.В. Изучение биомеханического
взаимодействия имплантатов и кости методом
математического моделирования. // Клиническая
имплантология и стоматология. – 1997. - №2. – С. 34 –
37.
28. Трезубов В.Н., Арутюнов С.Д. Стоматология. - М.: Медицинская книга. - 2003. - 576 с.
29.
Чумаченко Е.Н., Воложин А.И., Портной В.К., Маркин
В.А. Гипотетическая модель биомеханического
взаимодействия зубов и опорных тканей челюсти
при различных значениях жевательной нагрузки. //
Стоматология, 1999, № 5, том 78. – С.4-8.
30.
Чумаченко Е.Н., Воложин А.И., Маркин В.А.
Биомеханическая модель и методика расчета
напряженно-деформированного состояния
пародонтального комплекса нижней челюсти. //
Наукоемкие технологии. - 2001. - №1. – С. 49 – 60.
31.
Чумаченко Е.Н., Арутюнов С.Д., Лебеденко И.Ю.
Математическое моделирование
напряженно-деформированного состояния зубных протезов. – М.:- Молодая
гвардия.- 2003. – 270 с.
32. Чумаченко Е.Н., Шашмурина В.Р. Математическая модель съемного зубного протеза // Сб. трудов 2-й МНПК Исследование, разработка и применение высоких технологий в промышленности. - Санкт-Петербург, 2006. – Т. 4. – С. 255 - 256.
33.
Цимбалистов А.В., Войтяцкая И.В., Статовская Е.Е.,
Максимова Т.М., Богдаова Т.К.
Ошибки при лечении больных с полным отсутствием
зубов. / Труды УI съезда Стоматологической
ассоциации России. – М., 2000. – 412 – 414.
34. Misch C.E. Contemporary Implant Dentistry. -2nd
ed. – Mosby, Inc., 1999. - 684 p.
35. Misch C.E., Judy K.W.M. Classification of partially
edentulous arches for implant dentistry. Int J.-Oral Implantol. – 1987. – 4. - 7-12.
36. Renouard F., Rangert B. Факторы риска в
дентальной имплантологии. - М.: 2004, -182 с.
37. Weiss CM,
Weiss A. Principles and Practice of Implant Dentistry. - Mosby, Inc., 2001.-447 p.
38. Worthington
P., Lang B.R., LaVelle W.E. Остеоинтеграция в стоматологии. –
Изд. «Квинтэссенция». – 2005. – 126 с.
The mathematical modeling for the planning
Shashmurina V. R., Chumachenko E. N.
Here is presented mathematical model
“changeable prothese-implantat-bone” with changeable parameters in size and density of
bone tissue which helps to study biomechanical base of interaction between bony tissue
structure of mandibule with totally changeable protheses of different construction and
fixing them with dental interostal implantats.
Biomechanical analisis which has been
used in this model has shown better to recommend three implantats to support total change
of prothesis. Using 4 or more is recommended for patients with less density of trabecular
bone and substantial atrophy of mandibule. Full changeable prothesis fixed on two
implantats can be used for patients with of high density of trabecular bone and in absence
of atrophy.