УДК 616.34–001.4:612.014.464
ОЗОНОТЕРАПИЯ
И ГИПОХЛОРИТ НАТРИЯ В ХИРУРГИЧЕСКОМ
ЛЕЧЕНИИ ОСТРОЙ КИШЕЧНОЙ НЕПРОХОДИМОСТИ
Ó 2007 г. Ивлиев Н. В., Баженов С. М., Лелянов А. Д., Касумьян С. А.,
Дубенская Л. И., Никонорова Н. М.
В работе
изучались особенности заживления экспериментального кишечного анастомоза в
условиях сочетанного применения озона и гипохлорита натрия для перитонеально-интестинального
лаважа при хирургическом лечении острой кишечной непроходимости. Разработаны
оригинальные макро- и микроструктурные критерии оценки состояния анастомоза.
Выделен новый «сальниковый» тип заживления ран кишечника.
Лечение
острой кишечной непроходимости до настоящего времени остается одной из самых
актуальных и трудноразрешимых проблем неотложной абдоминальной хирургии. Летальность
при этой тяжелой, часто встречающейся хирургической патологии продолжает
оставаться высокой (20-50%) и не имеет тенденции к снижению [8, 24, 30].
Различные гнойно-воспалительные осложнения (перитонит, внутрибрюшные абсцессы,
нагноение лапаротомной раны) возникают у 8-30% оперированных больных [1, 5,
18, 24, 30, 32].
Несмотря на появление новых шовных
материалов и сшивающих технологий, основной причиной фатальных исходов резекции кишки
при острой кишечной непроходимости является несостоятельность швов анастомоза,
развивающаяся вследствие микробного обсеменения и нарушений микроциркуляции
зоны соустья, а также повышения
внутрикишечного давления и прогрессирования перитонита [5, 8, 13, 19, 25, 33,
39, 43]. Патогенная
микрофлора и гипоксия
усугубляют воспалительную реакцию в области кишечных швов, способствуют
развитию некроза и снижению синтеза коллагена, обеспечивающего механическую прочность
анастомоза [9, 33, 38, 42, 44, 47].
Поэтому приоритетными задачами оперативного
лечения острой кишечной непроходимости являются эффективная санация брюшной
полости и снижение уровня инфицирования и гипоксии тканей в зоне формируемого
соустья, способствующие созданию оптимальных условий для заживления кишечных
швов. Существующие
способы внутрибрюшной и кишечной санации обеспечивают механическое очищение и в
некоторой степени снижают бактериальную обсемененность брюшной полости и
кишечника [1, 2, 6, 8, 19, 34, 37, 45].
Недостаточная
эффективность используемых средств побуждает к поиску новых, более
физиологичных антисептиков, обладающих выраженной антибактериальной активностью.
В этой связи заслуживают внимания сообщения об универсальном антимикробном и
биостимулирующем действии озона и гипохлорита натрия [4, 21,
23, 36, 40, 46, 48]. Проведенные
в последние годы исследования выявили высокий терапевтический эффект их применения
в комплексном лечении гнойно-воспалительных заболеваний [4, 7,
10, 11, 21, 22, 28, 36].
Целью
настоящего исследования явилось улучшение результатов хирургического лечения
острой кишечной непроходимости путем сочетанного применения озона и гипохлорита
натрия для перитонеально-интестинального
лаважа и стимуляции заживления кишечного анастомоза.
Материал и методы. В основу работы положена оценка результатов экспериментального
исследования на 144 лабораторных животных (крысы линии Вистар). Животным под
общим обезболиванием после срединной лапаротомии моделировали острую странгуляционную
кишечную непроходимость наложением узловой лигатуры на петлю кишки с брыжейкой
в 7-8 см проксимальнее анального отверстия. После развития некроза лигированного
сегмента толстой кишки и перитонита измененный участок кишки резецировали и в пределах жизнеспособных тканей
формировали кишечный анастомоз конец в конец однорядным узловым швом
атравматической иглой с нитью полипропилен 5/0 на полихлорвиниловом катетере,
проведенном через анус. После наложения кишечного соустья и проведения санационных мероприятий
через операционную рану в брюшную полость вводили микроирригатор и брюшную стенку
ушивали. Трансанально проведенный интестинальный катетер фиксировали к
основанию хвоста животного.
После отработки
методики эксперимента (12 опытов) животные были разделены на 2 группы –
основную (74 крысы) и контрольную (58 особей). В основной группе санацию
брюшной полости проводили 0,05-0,06% раствором гипохлорита натрия и
растворенным озоном в концентрации 4-6 мг/л. Кишечный лаваж осуществляли по
интестинальному катетеру растворенным озоном в концентрации 6-8 мг/л. После
3-5-минутной экспозиции аспирировали кишечное содержимое и в область соустья
под визуальным контролем вводили 1-2 мл озонированного масла «Озонид»
(«Медозон», Москва). Перед ушиванием брюшную полость вновь промывали
гипохлоритом натрия и растворенным озоном. Послеоперационную рану обрабатывали
раствором гипохлорита натрия. На следующие сутки перитонеально-интестинальный
лаваж повторяли и после внутрикишечного введения озонированного масла удаляли
катетер и микроирригатор. В группе сравнения внутрибрюшной и кишечный лаваж
проводили фурацилином.
Озоно-кислородную смесь получали на озонотерапевтической установке УОТА-60-01 («Медозон», Москва). Для внутрикишечного введения использовали масло «Озонид» («Медозон», Москва), представляющее раствор озонидов ненасыщенных карбоновых кислот (природного происхождения) в оливковом масле. Раствор гипохлорита натрия готовили электрохимическим способом из физиологического раствора в электролизерах ЭДО-4 и ДЭО-01 «МЕДЭК».
Эффективность лечения оценивали по выживаемости животных, состоянию брюшной полости и послеоперационной раны, динамике морфологических изменений и биомеханической прочности кишечного анастомоза на 1-е, 3-и, 5-7-е, 8-11 и 12-14-е сутки после операции, а также по результатам микробиологического исследования.
До и после проведения интраоперационного перитонеально-интестинального лаважа производили взятие экссудата из брюшной полости и смывов со стенок кишки в области формируемого соустья для определения уровня бактериальной обсемененности. Количество микроорганизмов определяли методом серийных разведений исследуемого материала и его посевов на питательные среды и выражали в колониеобразующих единицах (КОЕ) на 1 мл.
Животных выводили из опыта внутриплевральным введением больших доз миорелаксанта короткого действия под наркозом. Отмечали характер заживления лапаротомной раны, наличие или отсутствие гнойно-воспалительных осложнений. При ревизии брюшной полости оценивали состояние кишечного соустья, наличие выпота, спаечный процесс. Аутопсию завершали резекцией сегмента кишки с анастомозом для морфологического и биомеханического исследования.
Биомеханическую прочность кишечного соустья исследовали
методом определения внутрипросветного давления разрыва (гидропневмопрессии) на
специально созданной нами установке (удостоверение на рационализаторское
предложение №1446 от 03.06.2002 г.), основными узлами которой являются
шприцевой инфузионный насос, манометр, магистрали из полихлорвинилового
материала и емкость с жидкостью [17]. Кишечный
анастомоз помещали в емкость с жидкостью и присоединяли установку к катетеру,
введенному в просвет кишки. Шприцевым насосом создавали постоянный поток
воздуха или подкрашенной жидкости, которые вводили по катетеру в кишку со
скоростью 1,7 мл/мин. Противоположный конец кишки лигировали или закрывали
зажимом. Давление в исследуемом фрагменте кишки повышали до уровня, когда
воздух или подкрашенная жидкость начинали выходить через рану анастомоза или
дефект кишечной стенки.
С целью объективизации сравнительной характеристики процессов
заживления нами был разработан и применен способ оценки морфофункционального
состояния кишечного анастомоза по совокупности макро- и микроструктурных
показателей.
Для макроскопического исследования кишечный анастомоз разрезали по длиннику на 2 половины, стараясь максимально сохранить на них пространственную конфигурацию соустья. Визуально оценивали форму и угол изгиба анастомоза, состояние зоны соустья со стороны слизистой (величина зоны деструктивно-воспалительных изменений, западение или выбухание области анастомоза и его размеры, степень эпителизации). Количественную оценку выявленных изменений проводили по разработанной нами 4-балльной системе (от 0 до 3 баллов). Полученные баллы суммировали. При сумме до 6 баллов морфофункциональное состояние кишечного анастомоза оценивали как хорошее, свыше 12 считали неудовлетворительным. Кроме того, измеряли внутренний диаметр и толщину стенки анастомозированной кишки. Выраженность спаечного процесса также оценивали в баллах, учитывая количество припаянных органов (сальник, петли кишки, почка, мочеточник).
Для гистологического исследования у погибших и выведенных из опыта животных брали кусочки ткани анастомоза и фиксировали в 10% растворе нейтрального формалина в течение 14 суток. Кусочки фиксированных тканей кишечной стенки обезвоживали в спиртах и эфире, заливали в парафин и приготавливали срезы толщиной 5-7 мкм, которые окрашивали по общегистологическим методикам гематоксилином и эозином, пикрофуксином по Ван Гизон, а также альциановым синим. В качестве критериев оценки заживления использовали характер воспалительной реакции в области стыка анастомоза, размеры зоны некроза, степень зрелости соединительной ткани, эпителизацию кишечной раны, состояние мышечной оболочки кишки, выраженность спаечного процесса. Выявленные изменения интегрировали в баллах (от 0 до 3) и на основании этого проводили количественную оценку заживления кишечного соустья.
Статистическую обработку полученных данных проводили согласно рекомендациям для
медико-биологических исследований на ПК IBM Pentium-IV
с использованием программ Statistica v.5.5A и SPSS v.10.0.5 for Windows. Полученные результаты анализировались
методами вариационной статистики и были представлены средним арифметическим и
его стандартным (среднеквадратичным) отклонением, средней квадратичной ошибкой
среднего арифметического для данных количественного типа, частостями и
частотами для качественного типа данных. Для сравнения количественных
показателей между группами использовали t-тест Стьюдента при анализе данных,
представленных в метрической шкале, а также его непараметрический аналог –
непарный U-тест
Манна-Уитни в случае анализа данных, представленных в ранговой (балльной)
шкале. При сравнении качественных данных использовали угловое преобразование
Фишера. Различия считали достоверными на уровне значимости p<0,05.
Результаты и обсуждение. Анализ микробиологических исследований показал, что все биоматериалы до санации являлись бактериально загрязненными (табл. 1). Значимых различий в исходных уровнях бактериальной обсемененности брюшной полости и толстой кишки между группами не было (p>0,05).
Таблица 1
Динамика концентрации микробных тел (КОЕ/мл) в
брюшной
полости и кишечном содержимом в зависимости
от метода санации
|
Биоматериал |
Основная группа |
Контрольная группа |
||
|
до |
после санации |
до |
после санации |
|
|
Перитонеальный экссудат |
1,39×107 ±1,83×106 |
2,35×104 ±7,22×103*• |
1,45×107 ±2,2×106 |
4,02×106 ±1,38×106• |
|
Кишечное содержимое |
2,37×109 ±3,47×108 |
2,1×106 ±2,18×105*• |
2,11×109 ±3,26×108 |
4,19×108 ±1,37×108• |
|
Примечание:
*
р<0,01 в сравнении с контролем • р<0,001 в сравнении с
исходным уровнем
|
||||
После внутрибрюшной и кишечной санации происходило достоверное (р<0,001) снижение степени микробной контаминации перитонеального экссудата и толстокишечного содержимого (табл. 1). Однако при использовании физико-химических методов отмечали более значительное снижение уровня бактериальной обсемененности брюшины и анастомозированной кишки – на 2-4 порядка (с 106-7 до 102-3 и с 108-9 до 104-6 КОЕ/мл соответственно). Следует отметить, что в 30,6% наблюдений микрофлора в смывах брюшной полости после санации не высевалась.
В контрольной группе уровень бактериальной обсемененности
брюшной полости и толстой кишки снижался не более чем на 1-2 порядка. В 16,1% случаев после санации брюшной полости и в 13,7% после проведения
кишечного лаважа фурацилином степень микробного обсеменения не изменилась.
Таким образом, комплексное применение гипохлорита натрия и озона оказывает выраженный санационный эффект. Однако необходимо учитывать, что гипохлорит натрия, являясь мощным антибактериальным препаратом, может повреждать мезотелий с последующим развитием спаечного процесса. Противомикробная активность растворенного озона ниже, но его использование в вышеуказанной последовательности позволяет снизить риск повреждающего действия на брюшину гипохлорита натрия.
Исследования биомеханической прочности кишечных соустий показали, что в первые 3-е суток после операции, как правило, происходило нарушение герметичности анастомоза через места вколов иглы при минимальном давлении – 40,2±1,5 мм рт.ст. в основной и 30±1,5мм рт.ст. в контрольной группах (рис. 1). На 6-е сутки в основной группе разрыв анастомоза возникал при внутрикишечном давлении 100,6±1,2 мм рт.ст., в контрольной – при давлении 85,1±2,1мм рт.ст. Достоверные (р<0,001) различия в механической прочности соустий между группами сохранялись и в последующем.
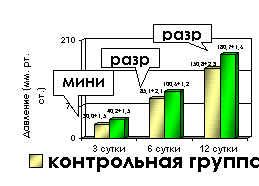
Рис. 1. Динамика
биомеханической прочности толстокишечных анастомозов
На 12-е сутки кишечные анастомозы в основной группе выдерживали давление 180,7±1,6мм рт.ст., при этом наблюдали разрыв стенки кишки вне зоны соустья. В контрольной группе аналогичный уровень давления разрыва отмечен только на 14-е сутки после операции.
Феномен более раннего повышения прочности стенки кишки после введения растворенного озона и масла «Озонид» связан, очевидно, с усилением образования коллагена вследствие улучшения оксигенации и кислородного режима кишечной раны, что способствует образованию более прочного и эластичного рубца.
Следует отметить, что анастомозы при неосложненном раневом процессе довольно быстро после их формирования становятся прочнее, чем ткани самой кишки. Это явление, вероятно, обусловлено меньшей растяжимостью зоны соустья за счет ригидности рубцовой ткани и прочности швов. Поэтому, по мере приобретения анастомозом определенной прочности, при раздувании исследуемого сегмента кишки разрыв возникает вне зоны соустья.
Установлено, что при внутрикишечном введении жидкости и достижении
давления в сегменте кишки на уровне
90-110 мм рт.ст. на гистограмме отчетливо определяется плато (рис. 2), после
чего вновь происходит повышение внутрикишечного давления вплоть до развития
разрыва стенки кишки. Это явление, по-видимому, связано с разрывом
коллагеновых волокон, образующих довольно прочный каркас в подслизистом слое.
Дальнейшую прочность кишки обеспечивает только
мышечный слой и в значительно меньшей степени серозная оболочка.
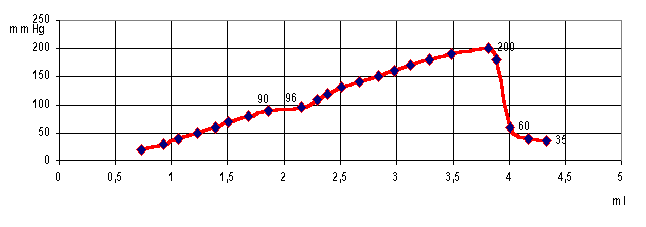
Рис. 2. Динамика изменения внутрикишечного давления в сегменте толстой
кишки крысы в зависимости от объема вводимой жидкости
Макроскопическое изучение кишечных анастомозов показало, что наиболее информативными критериями качества заживления являются пространственная конфигурация соустья, степень деструктивных и воспалительных изменений, активность эпителизации кишечной раны, а также выраженность регионарного спаечного процесса [17].
Установлено, что разрез стенки кишки и проведение лигатуры через слизистую вызывают дистрофические, некробиотические и воспалительные изменения, что приводит к некрозу и отторжению краев кишечной раны и расхождению стянутых швом краев слизистой оболочки кишки с образованием язвенного дефекта различной протяженности. Ширину образующейся циркулярной язвы мы расценивали как ширину зоны анастомоза и считали одним из критериев выраженности воспалительно-деструктивных изменений. С развитием продуктивного воспаления наблюдали возникновение воспалительно-пролиферативного вала, выступающего в просвет кишки, ширину которого измеряли.
По соотношению диаметров приводящего и отводящего отделов нами выявлено 4 основных варианта формы кишечного анастомоза (рис. 3): 1 – расширение приводящего отдела при сужении или неизмененных размерах отводящего; 2 – равномерное расширение обоих отделов анастомоза; 3 – расширение дистального отдела при неизмененных размерах проксимального; 4 – отсутствие расширения приводящего и отводящего отделов (оптимальный вариант, наиболее близкий к физиологическому прообразу). Наиболее распространенной (56,8% всех наблюдений) формой кишечного соустья являлось умеренное равномерное расширение приводящего и отводящего отделов.
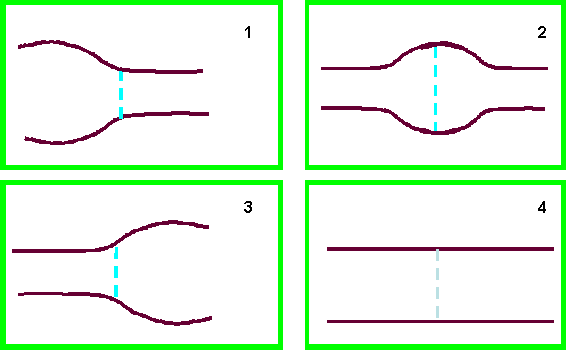
Рис. 3.
Основные варианты конфигурации кишечного анастомоза:
1 –
расширение приводящего отдела, 2 – равномерное расширение обоих отделов анастомоза,
3 – расширение отводящего отдела, 4 – отсутствие расширения приводящего и отводящего
отделов соустья
По углу изгиба продольных осей приводящего и отводящего отделов анастомоза выявлены следующие варианты (рис. 4): 1 – прямая линия (180°) – 46% всех наблюдений; 2 – прямой угол (90°) – 2,7%; 3 – промежуточные варианты (угол от 91 до 179°) – 40,5%; 4 – смещение осей приводящего и отводящего отделов соустья относительно друг друга (излом, «ступенчатый» анастомоз) – 10,8%. Угол изгиба 180° (прямая линия) как наиболее физиологичный вариант оценивали в 0 баллов, угол от 179° до 160° – в 1 балл, от 159° до 140° – в 2 балла. Угол менее 140°, как вызывающий наибольшие затруднения в прохождении перистальтической волны и кишечного содержимого, оценивали в 3 балла. Смещение осей (излом, «ступенчатый» анастомоз) оценивали в 1 балл.
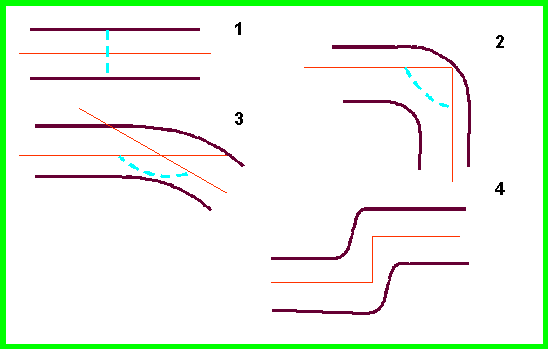
Рис. 4.
Варианты угла изгиба продольных осей кишечного анастомоза:
1 –
прямая линия (180°), 2 – прямой угол (90°), 3 – промежуточные
варианты (91-179°); 4 – смещение осей приводящего и
отводящего отделов анастомоза относительно друг друга
На 3-7 сутки средний угол изгиба кишечного анастомоза в основной группе (169±6°, 0,8±0,3 балла) был близок к прямой линии и достоверно (р<0,05) отличался от контроля (139±9,3°, 2,2±0,4 балла) (табл. 2). Отмечали значительно (р<0,01) меньшую зону деструктивно-некротических изменений анастомозированной кишки (2±0,7мм, 1±0,4 балла) по сравнению с контрольной группой (6,1±0,6 мм, 2,6±0,3 балла) и начало эпителизации с 3-х суток после операции. Средняя сумма баллов оценки качества заживления анастомоза (8±0,7) была достоверно (р<0,01) ниже контроля.
В контрольной группе морфофункциональное состояние соустий расценено как неудовлетворительное (12,8±1,4 балла) вследствие грубой деформации и протяженной зоны некроза. Как правило, отмечали выраженный спаечный процесс с вовлечением сальника, петель тонкой кишки и отдаленных органов. При этом в большинстве случаев наблюдали выраженную воспалительную инфильтрацию кишечной стенки и расширение анастомоза в области швов.
Таблица 2. Макроскопическая характеристика кишечных соустий
|
Критерии сравнения |
Основная
группа |
Контрольная группа |
||
|
3-7сут |
12-14
сут |
3-7сут |
12-14
сут |
|
|
Форма анастомоза, |
0,8±0,2 |
1,1±0,2*** |
1,2±0,2 |
2,4±0,2 |
|
Угол изгиба: градусы
баллы |
169±6* 0,8±0,3* |
176,7±1,9** 0,25±0,1*** |
139±9,3 2,2±0,4 |
144,3±12,1 1,6±0,4 |
|
Ширина зоны
баллы
|
2±0,7** 1±0,4** |
1,8±0,4 0,6±0,2* |
6,1±0,6 2,6±0,3 |
3,3±1,1 1,4±0,3 |
|
Западение/выбухание:
мм
баллы |
2,2±0,4 0,75±0,2 1,5±0,3 |
0,7±0,3 0,2±0,1* 0,5±0,2* |
2,6±0,3 0,9±0,3 1,6±0,4 |
1,4±0,4 0,5±0,1 1,1±0,3 |
|
Эпителизация, баллы |
2,2±0,3 |
0,4±0,2* |
2,6±0,3 |
1,2±0,3 |
|
Сумма баллов |
8±0,7** |
3,5±0,7*** |
12,8±1,4 |
9,2±1,1 |
|
Толщина стенки кишки, в зоне
швов приводящий отдел отводящий
отдел |
1,1±0,2* 0,6±0,1 0,6±0,1 |
1,1±0,1 0,6±0,1 0,6±0,04* |
1,7±0,3 1,1±0,5 0,9±0,3 |
1,4±0,2 0,6±0,1 0,4±0,03 |
|
Диаметр, мм:
приводящий отдел отводящий
отдел |
8,3±1,2 7,5±1,2 7,4±1,2 |
6,4±0,6 6,9±0,7 6,4±0,6 |
12±1,6 10,6±1,8 9,4±1,2 |
8,1±1,7 8,3±1,0 8,1±1,2 |
|
Спайки (баллы) |
1,2±0,4* |
1,1±0,2*** |
3,6±0,9 |
4,7±0,7 |
|
Примечание: * р<0,05 в сравнении с контролем ** р<0,01 в сравнении с контролем ***
р<0,001 в сравнении с контролем |
||||
На 12-14 сутки анастомозы основной группы были близки по форме к физиологическому прообразу – интактной кишке (1,1±0,2 балла) (рис. 5). Большинство соустий (75%) располагались по прямой линии, средний угол изгиба (176,7±1,9°) достоверно (р<0,01) превышал таковой в контроле (144,3±12,1°). К 12-м суткам 68,8% анастомозов были полностью эпителизированы, выраженность спаек была минимальной (рис. 5).
В группе сравнения в 88,9% случаев отмечали грубую
деформацию и асимметрию кишечного соустья в виде выраженного расширения
проксимального или дистального отделов, что приводило к затруднению пассажа
кишечного содержимого (рис. 6). Средние суммы баллов (3,5±0,7 и 9,2±1,1
соответственно) достоверно (p<0,001) различались, свидетельствуя о
лучшем морфофункциональном состоянии соустий основной группы.
Таким образом, применение озона и гипохлорита натрия способствует формированию благоприятных в структурно-функциональном отношении кишечных соустий, что проявляется в близости формы и диаметра анастомозированной кишки к физиологическому прообразу, снижении степени деструктивных и воспалительных изменений в области кишечных швов, активизации репаративной регенерации и минимальной выраженности внутрибрюшного спаечного процесса.
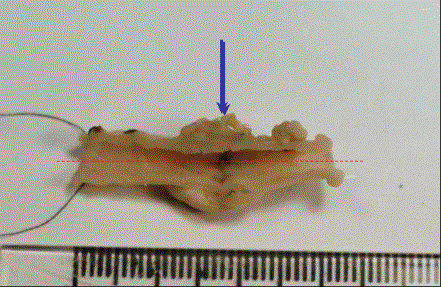
Рис. 5. Макропрепарат кишечного анастомоза основной группы,
12 сут. Оптимальный вариант формы, угол изгиба 180°, полная эпителизация.
Суммарная оценка – 0 баллов. Стрелкой указана линия анастомоза
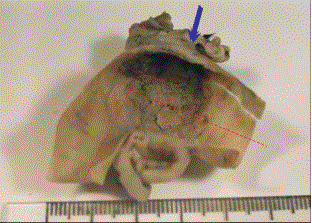
Рис. 6.
Макропрепарат кишечного анастомоза контрольной группы, 14 сут. Выраженная
деформация и расширение соустья, прямой угол изгиба (90°), западение зоны
анастомоза, вторичные язвенно-некротические изменения на поверхности
грануляционной ткани, отсутствие эпителизации, массивный спаечный процесс. Суммарная оценка – 16 баллов.
Стрелкой указана линия анастомоза.
Гистологические исследования показали, что все кишечные анастомозы в большей или меньшей степени заживали вторичным натяжением, проходя все стадии репарации инфицированной раны. В первые 3-е суток после резекции кишки у всех животных выявлена схожая реакция организма на операционную травму и инородное тело (шовный материал). В месте стыка анастомоза наблюдали линейный дефект кишечной стенки с признаками некробиотических и дистрофических изменений в зоне около 100-150 мкм от краев раны. Раневой канал был выполнен серозно-фибринозным экссудатом с умеренной примесью эритроцитов и небольшим количеством лейкоцитов. В последующем в зоне соустья развивались явления серозно-гнойного воспаления с расстройствами микроциркуляции и формированием зон некроза.
Некробиотические и дистрофические процессы были особенно выражены в слизистой оболочке. Отмечены деэпителизация крипт, массивные кровоизлияния, обширные поля слущенного в просвет кишки эпителия, масса телец апоптоза. В подслизистом слое наблюдали отек, полнокровные сосуды с явлениями лейкостаза и лейкодиапедеза. В мышечной оболочке выявлены некробиотические изменения с развитием аутолиза и гетеролиза некротизированной ткани.
При этом в основной группе наблюдали умеренную или слабую инфильтрацию зоны швов нейтрофилами (83,3%), полнокровие, расширение сосудов и незначительный отек, имелись элементы продуктивного воспаления в виде очагового формирования грануляционной ткани. Выраженность воспалительной реакции (1±0,3 балла) была достоверно (р<0,05) меньшей в сравнении с контролем (табл. 3). В фибрин практически везде врастали новообразованные сосуды, образуя довольно густую извилистую сеть капилляров. В 50% случаев имелась активная краевая эпителизация соустья.
В контрольной группе в 77,8% наблюдений развивалась сильно выраженная инфильтрация полиморфноядерными лейкоцитами при наличии зон скопления разрушенных нейтрофилов с формированием микроабсцессов в зоне анастомоза и соседних органах. В межшовных промежутках прослеживались полосы гнойно-некротического детрита до подслизистого слоя, в зоне некроза имелось большое количество колоний бактерий. Наблюдали только начальные признаки образования новых капилляров и незначительное краевое их врастание в фибриновую пленку. Вместе с тем отмечены выраженные дистрофические изменения интрамуральных нервных сплетений. В последующем существенные различия в интенсивности воспалительной реакции и скорости репаративных процессов сохранялись, что определяло характер и сроки эпителизации кишечной раны.
На 5 сутки после операции в месте стыка анастомоза, как правило, возникал валик из новообразованной грануляционной ткани, на вершине которого имелась полоса некроза. В ряде случаев на месте валика определялся язвенно-некротический дефект слизистой оболочки. Однако в основной группе опытов на 5-6 сутки начиналось очищение кишечной раны от детрита и наложений фибрина и прогрессивное снижение интенсивности инфильтрации кишечной стенки полиморфноядерными лейкоцитами. При этом отчетливо увеличивалось количество макрофагов, а затем фибробластов, что сопровождалось образованием зрелой соединительной ткани в месте стыка анастомоза. Высота (118±40 мкм) и ширина (445±135 мкм) зоны некроза были достоверно (р<0,05) меньшими в сравнении с контролем.
Таблица 3. Гистоморфологические показатели состояния кишечных соустий
|
Критерии сравнения |
Основная группа |
Контрольная группа |
||||
|
3 сут |
5-7 сут |
12-14сут |
3 сут |
5-7 сут |
12-14сут |
|
|
Некроз, мкм: высота ширина |
100 1500 |
118±40* 445±135** |
3±3** 59±59* |
187±32 1833±333 |
339±70 3122±706 |
128±55 1217±729 |
|
Валик, мм: |
- - |
0,41±0,1 1,4±0,3 |
0,59±0,1 0,8±0,1 |
- - |
0,55±0,25 1,4±0,65 |
0,79±0,1 1,1±0,3 |
|
Эпителизация, баллы |
2,5±0,2* |
1,9±0,2** |
0,5±0,2** |
3 |
2,7±0,2 |
1,7±0,3 |
|
Воспаление, баллы |
1±0,3* |
0,9±0,1*** |
0,6±0,1* |
2,3±0,3 |
2,3±0,3 |
1,4±0,3 |
|
Грануляции, баллы |
2,5±0,5 |
0,7±0,2** |
0,5±0,1*** |
3 |
1,8±0,3 |
1,7±0,3 |
|
Примечание:
* р<0,05
в сравнении с контролем **
р<0,01 в сравнении с контролем *** р<0,001 в сравнении с контролем |
||||||
В группе сравнения в 88,9%
случаев сохранялись обширные участки некроза
и выраженное гнойно-продуктивное воспаление (2,7±0,2 балла) с явлениями
стойкого гемо- и лимфостаза, множественными участками геморрагий. В дальнейшем,
если не возникала несостоятельность швов, то развивался выраженный фиброз
соустья. В припаянных органах (сальник, петли тонкой кишки, поджелудочная
железа) наблюдали выраженные признаки гнойного воспаления, выявлялись межкишечные
абсцессы.
В основной группе к 12
суткам в 68,4% случаев наступила полная эпителизация анастомоза (рис. 7), происходило формирование
толстокишечных крипт. Воспаление носило преимущественно продуктивный характер и было минимальным по распространенности, имелись
признаки мышечной регенерации. Доминировали зрелые грануляции с преобладанием
фиброцитов и большим количеством коллагена.
Вместе с тем в контрольной группе наблюдали явления стойкого гемо- и лимфостаза, отек подслизистого слоя, длительно сохранялись выраженная лейкоцитарная инфильтрация и участки некроза, что способствовало образованию грубого рубца, деформации и замедлению эпителизации кишечной раны, которая к 12-м суткам в 90% случаев не завершалась полностью (рис. 8).
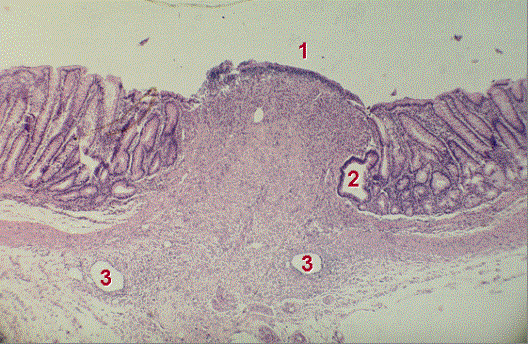
Рис. 7. Микропрепарат (окраска гематоксилин-эозином, ув. 80).
Кишечный анастомоз основной группы, 14 сут. Небольшой валик со зрелой грануляционной тканью и однорядным эпителием (1) на поверхности.
Кистозно
расширенная железа в крае рубца (2). Сосуды в основании рубца (3)
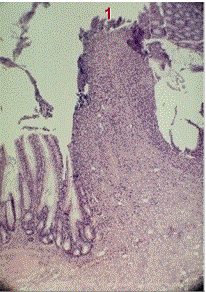
Рис. 8. Микропрепарат (окраска гематоксилин-эозином, ув. 80).
Кишечный анастомоз контрольной группы, 14 сут. Высокий узкий валик, выступающий в просвет кишки с некрозом на поверхности (1)
Таким
образом, использование физико-химических методов позволяет снизить
воспалительную реакцию тканей, способствует образованию более зрелого
соединительнотканного рубца, ускоряет эпителизацию и сокращает сроки заживления
кишечных анастомозов. Полученный позитивный эффект, вероятно, обусловлен
снижением микробной обсемененности зоны анастомоза, улучшением кислородного
метаболизма кишечной раны и нивелированием
тканевой гипоксии, что оптимизирует процессы биосинтеза коллагена с образованием
зрелой грануляционной ткани и формированием прочного и эластичного рубца.
Внутрикишечное введение озонированного масла позволяет улучшить механизм
контактного влияния озона на линию кишечных швов и пролонгировать
ранозаживляющий эффект.
Необходимо отметить, что при значительном
расхождении кишечных швов (7,2%
всех наблюдений), образующийся между краями раны фибриновый
сверток, по-видимому, не мог обеспечить полноценного восполнения дефекта с
восстановлением физической и биологической герметичности зоны соустья. В этих
случаях в пространство между краями стенки кишки спонтанно и активно внедрялся
небольшой фрагмент неповрежденного сальника, самостоятельно обеспечивая
временную целостность кишечной стенки в первые двое суток наблюдения. При этом
в сальнике возникало серозно-гнойное, а в последующем (3-7 сутки) продуктивное
воспаление с большим количеством новообразованных капилляров, формированием
грануляционной ткани, созревающей к 8-14 суткам в зрелую грануляционную и
фиброзную ткань.
Известно, что большой сальник выполняет главным образом защитные функции, являясь «сторожем»
или «полицейским» брюшной полости [3, 15, 16, 41]. В результате эволюции он приобрел
способность перемещаться к месту патологического процесса и создавать
ограничительный вал вокруг интраперитонеального септического очага [3, 15]. Благодаря уникальным анатомо-физиологическим свойствам (пластичность,
мобильность, адгезивность, большая поверхность, богатая васкуляризация и
ангиогенность, способность к инкапсуляции омертвевших тканей и абсорбции
жидкостей и микрочастиц из брюшной полости, способность к фагоцитозу и
иммунологическому реагированию) большой сальник широко используется не только в абдоминальной
хирургии, но и в хирургии других областей, а также в урологии и гинекологии [3,
12, 14, 15, 16, 19, 20, 26, 27, 29, 31, 35].
Обладая хорошо
развитой системой кровеносных сосудов и высокими репаративными способностями,
большой сальник является очень удобным материалом для закрытия дефектов
желудочно-кишечного тракта и защиты соустий полых органов от несостоятельности [3, 15, 16, 19,
20, 26, 27, 29, 31]. Впервые для целей пластик сальник использовал А.Jobert в 1825 г., закрыв им в виде пробки отверстие в
тонкой кишке собаки и сблизив края раны швами. Через 17 дней он убил собаку и
нашел, что сальник прирос
к краям дефекта и не вызвал сужения кишки; воспалительных изменений в брюшной полости не было [16]. В 1887 г. N.Senn высказал идею об
укреплении ненадежных швов кишечной стенки для предовтращения просачивания
через них кишечного содержимого путем укрытия их свободными участками сальника
[3]. В экспериментах на животных он показал, что участок ткани сальника, даже
лишенный кровоснабжения, приживается и сохраняет свои характерные свойства. А.Тietze (1899), укрепив сальник на сосудистой ножке вокруг
соустья тонкой кишки собаки, наложенного всего четырьмя узловыми швами, через 7
недель нашел, что концы кишки срослись «математически ровно» тонким
соединительнотканным рубцом без
сужения просвета кишки в области соустья и при
отсутствии спаек в брюшной полости [16]. Аналогичные опыты поставил J.Zilocchi
(1901), который также не отмечал сужения просвета кишки в месте анастомоза и
констатировал, что пластика сальником «дает абсолютную гарантию при слабых
швах» [16]. S.Bloomhardt et al. (1917)
наложили 5 собакам соустья тонкой кишки однорядным сквозным швом и окутали их
сальником на «ножке», который фиксировали швом к брыжейке кишки. Все собаки
выздоровели, у них обнаружены «анатомически совершенные анастомозы» [16].
В настоящее время
хирурги используют как свободный или на питающей ножке сальник, так и различные
его комбинации с другими биологическими и синтетическими материалами [3, 12, 15, 16,
19, 20, 27, 29, 31, 35]. Доказано, что большой сальник улучшает герметичность
кишечных анастомозов, что обусловлено его фагоцитарными и бактерицидными
свойствами [15, 16, 27]. Дополнительная перитонизация сальником тонко- и
толстокишечных соустий, наложенных однорядным швом, обеспечивает не только их
физическую, но и биологическую герметичность [16]. В первые двое суток после
формирования соустья сальник выполняет защитную функцию, предовтращая
поступление патогенной микрофлоры из просвета кишки в брюшную полость и
развитие микроабсцессов [16, 29]. При
этом изменения ткани сальника над соустьем находятся в прямой зависимости от
проникновения микрофлоры через физически герметичный кишечный шов [16]. Чем
больше ее проникает через шов, тем сильнее выражены изменения ткани сальника. Ко 2-3 суткам начинается прорастание
капилляров в область анастомоза, что является существенным пособием микроциркуляции
зоны соустья [29]. В дальнейшем происходит резорбция жира, кишечные железы врастают
в ткань перемещенного сальника, мукозный слой нарастает на нее со здорового
края кишечной стенки и с течением времени прядь сальника замещается соединительной
тканью с образованием прочного рубца [3, 16, 29].
А.А.Запорожец (1968) считает, что
оментизацию кишечного соустья можно сравнить с наложением на шов самой природой
заготовленного лечебного пластыря из фагоцитарных элементов, который, заклеивая
шов, препятствует проникновению из него инфекции и токсинов в брюшную полость и
одновременно, благодаря своим выраженным целебным (антимикробным,
антитоксическим и васкуляризующим) свойствам, способствует быстрейшему
заживлению кишечной раны [16]. Следует учитывать и то,
что благодаря высокой проницаемости кровеносных сосудов большого сальника, с
развитием воспалительных изменений в области швов соустья на поверхности
сальника, находящейся вблизи анастомоза, липкий фибринозный экссудат образуется
намного быстрее, чем на брюшине контактирующих с соустьем петель кишечника и их
брыжеек, что ведет к тому, что сальник самостоятельно припаивается к соустью
раньше других тканевых образований брюшной полости [16].
По данным ряда
авторов [3, 15, 39], при использовании для наружной защиты кишечного анастомоза
большой сальник не только не препятствует возникновению недостаточности
швов, а может подвергаться в
последующем полной дегенерации и замещаться грубой волокнистой соединительной
тканью, что чревато стенозированием соустья. Свободные трансплантаты сальника сохраняют жизнеспособность, куда бы их
не помещали [3, 31], но во всех случаях они образуют спайки с прилежащими
органами, не являются барьером для просачивания через швы и не предохраняют
подлежащие деваскуляризированные сегменты кишечной стенки от некроза [3].
Имеются данные, что укрепление сальником на сосудистой ножке линии швов тонкого
и толстого кишечника не ускоряет их заживления, а при больших дефектах
сопровождается высокой летальностью [3]. При этом васкуляризация зоны кишечного
анастомоза не улучшается и по сравнению с «неукрепленными» анастомозами
количество перианастомотических абсцессов возрастает.
В наших наблюдениях при выполнении дефекта кишечной
стенки сальником в основной группе опытов на всех сроках выведения животных из
эксперимента не было признаков кишечной непроходимости и/или сужения просвета и
грубой деформации кишечного соустья [17]. У всех животных спаечный процесс
был минимальным и ограничивался припаянным в области кишечных швов сальником.
При использовании традиционных методов внутрибрюшной и кишечной санации
защитная функция большого сальника оказалась недостаточно эффективной и «запаивание»
области анастомоза большим сальником не могло полностью предовтратить
инфицирование брюшной полости через биологически негерметичный кишечный шов.
Сочетанное применение озона
и гипохлорита натрия позволило значительно снизить бактериальную контаминацию
кишечной раны, способствуя уменьшению воспалительных изменений во внедрившемся
в дефект кишечной стенки сальнике и дало возможность эффективно реализовать
естественные биологические защитные механизмы и оптимизировать заживление
кишечного соустья при неблагоприятных условиях его формирования. При этом рубец нередко формировался быстрее, что,
по-видимому, обусловлено лучшим кровоснабжением зоны анастомоза в результате
усиления ангиогенеза, так как сальник обладает развитой системой кровеносных
сосудов и высокими репаративными способностями.
Обнаруженное
биологическое явление мы назвали «сальниковым» типом заживления, так как не
нашли в доступной литературе среди многочисленных свойств сальника описания его
способности
самостоятельно, целенаправленно и «дозированно» проникать в глубину щели между краями стенки
кишки после ушивания кишечной раны с последующим поэтапным развитием различных форм воспаления
одновременно с резорбцией жировой ткани и выраженным ангиогенезом.
До 5 суток на микропрепарате жировая ткань сальника
определяется отчетливо, позднее она исчезает за счет продуктивного воспаления и
к 12-14 суткам остаются отдельные жировые глобулы на разных уровнях
формирующейся на месте сальника фиброзной ткани (рис. 9, 10). Иногда в разных участках одного и того же кишечного соустья
наблюдали сочетание «сальникового» типа заживления с обычным формированием
рубца из типичной фиброзной ткани [17].
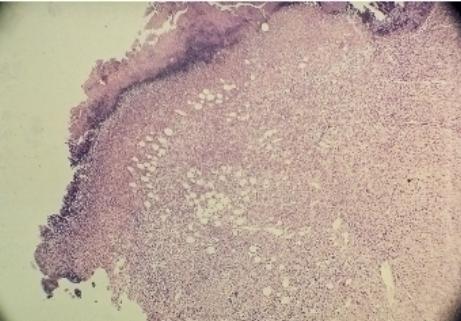
Рис. 9.
Микропрепарат (окраска гематоксилин-эозином, ув. 80). Кишечный анастомоз
контр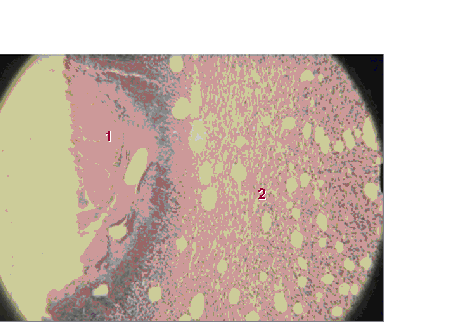 ольной группы, 7 сут.
Общий вид рубца с наличием
ольной группы, 7 сут.
Общий вид рубца с наличием
включений жировой
ткани («сальниковый» тип заживления)

Рис. 10.
Микропрепарат (окраска гематоксилин-эозином, ув. 160). Кишечный анастомоз
контрольной
группы, 7 сут. (фрагмент рис. 33). Некроз, некробиоз, жировая ткань (1),
хроническое
воспаление в жировой ткани (2) при «сальниковом» типе заживления.
Таким образом,
как и ряд авторов [16, 34], мы считаем, что кроме чисто защитной функции, большой
сальник, обладая пластическими свойствами, способствует лучшему кровоснабжению
сшитых участков кишки и улучшению заживления кишечной раны.
Основными
критериями эффективности хирургического лечения острой кишечной непроходимости
являются непосредственные результаты операции, к которым относятся частота
возникновения гнойно-воспалительных осложнений и летальность после резекции
кишки. В основной группе осложнения гнойно-воспалительного характера развились
только в 6 (8,1%) случаях, при этом несостоятельности кишечных швов и
внутрибрюшных гнойных осложнений не было (табл. 4). Анастомозит отмечен у 4
(5,4%) животных, нагноение послеоперационной раны – в 5 (6,8%) наблюдениях.
Таблица 4. Частота развития
гнойно-воспалительных осложнений
|
Осложнения |
Основная
группа |
Контрольная
группа |
|
абс % |
абс % |
|
|
Несостоятельность швов анастомоза и перитонит |
- -* |
9 15,5 |
|
Внутрибрюшные абсцессы |
- -* |
7 12,1 |
|
Анастомозит |
4 5,4* |
10 17,2 |
|
Нагноение послеоперационной
раны |
5 6,8* |
14 24,1 |
|
Сочетание
|
3 4,1* |
11 19 |
|
Общее
число гнойно-воспалительных |
6 8,1* |
26 44,8 |
|
Примечание:* р<0,05 в сравнении с
контролем |
||
В
контрольной группе различные послеоперационные гнойно-воспалительные осложнения
отмечены у 26 (44,8%) крыс, внутрибрюшные гнойные – у 14 (24,1%) животных. Несостоятельность
швов анастомоза развилась в 9 (15,5%) случаях. Анастомозит выявлен у 10 (17,2%) животных. У 7 (12,1%) крыс на
аутопсии обнаружены внутрибрюшные (межкишечные и подпеченочные) абсцессы. Нагноение
лапаротомной раны развилось в 14 (24,1%) наблюдениях, при этом у 2 (3,5%) крыс тотальное нагноение
послеоперационной раны привело к эвентрации кишечника.
В
основной группе внутрибрюшной спаечный процесс, как правило, выглядел в виде
рыхлых плоскостных сращений сальника с кишечным соустьем. Явления спаечной кишечной
непроходимости отмечены лишь в 2 (2,7%) случаях. У большинства крыс контрольной
группы в брюшной полости наблюдали
массивный спаечный процесс с эпицентром в
зоне оперативного вмешательства и вовлечением отдаленных органов. Спаечная
кишечная непроходимость развилась у 7 (12,1%) животных.
В
основной группе погибло 12 (16,2%) животных. В контрольной группе погибло 22
(37,9%) животных, основными причинами летальных исходов явились
несостоятельность швов анастомоза и перитонит.
Полученные данные свидетельствует о высокой эффективности использования
физико-химических методов в хирургическом лечении острой кишечной
непроходимости. Сочетанное применение озона и гипохлорита натрия при острой
кишечной непроходимости и перитоните оказывает выраженный санационный эффект,
способствует заживлению кишечных анастомозов, уменьшению частоты
послеоперационных гнойно-воспалительных осложнений, снижает риск развития
несостоятельности кишечных швов и летальность. Кроме того, полагаем обоснованным и уместным
помимо известного пути заживления кишечного анастомоза, связанного с образованием фибринового свертка на месте повреждения и дефекта ткани,
выделить вариант с активным
внедрением большого сальника в зону повреждения и временным восстановлением
органной целостности – «сальниковый» тип заживления кишечной раны.
Выводы
1.
Внутрибрюшной лаваж 0,05-0,06%
раствором гипохлорита натрия и растворенным озоном в концентрации
4-6 мг/л оказывает выраженный санационный эффект при
моделированной острой странгуляционной толстокишечной непроходимости,
осложненной перитонитом.
2.
Кишечный лаваж растворенным озоном в
концентрации 6-8 мг/л с последующим введением масла «Озонид» обеспечивает
значительное снижение уровня микробной обсемененности зоны кишечного
анастомоза.
3.
Комплексное применение озона и
гипохлорита натрия снижает воспалительную реакцию и ускоряет репаративные
процессы в сформированном кишечном соустье, что способствует сокращению сроков
заживления кишечной раны и более раннему повышению биомеханической прочности
анастомоза.
4.
Сочетанное использование
гипохлорита натрия и озона при резекции кишки в условиях перитонита позволяет
значительно уменьшить число гнойно-воспалительных осложнений, риск развития
несостоятельности кишечного анастомоза и на 21,7% снизить летальность.
5.
Метод контролируемой гидропневмопрессии анастомоза
является информативным способом контроля динамики заживления кишечных швов,
позволяющим объективно оценить эффективность различных технологий, направленных
на улучшение репаративных процессов и снижение риска несостоятельности швов
формируемого кишечного соустья.
6.
Предлагаемый
способ комплексной оценки макро- и
микроструктурных изменений зоны соустья и прилежащих участков кишки позволяет
объективно оценить качество любого кишечного анастомоза, сформированного конец
в конец.
7.
Целесообразно
выделить особый тип заживления ран кишечника – «сальниковый» тип,
характеризующийся целенаправленным, активным, дозированным внедрением
неповрежденного сальника в щель между краями раны (в дефект ткани стенки кишки)
с временным восстановлением герметичности, органной целостности и последующим
развитием в нем поэтапного экссудативного и продуктивного воспаления с
резорбцией жировой ткани и формированием грануляционной ткани с созреванием в
фиброзную ткань рубца и последующей репаративной регенерацией. Таким образом,
внедрившийся фрагмент сальника является своеобразной матрицей – аналогом
фибринового свертка, где параллельно развиваются сложные процессы пато- ,
морфо- и саногенеза.
ЛИТЕРАТУРА
1.
Алиев С.А.
Первично-радикальные оперативные вмешательства при острой непроходимости
ободочной кишки опухолевого генеза у больных пожилого и старческого возраста //
Хирургия. - 2001. - №8. - С. 44-55.
2.
Ашрафов Р.А.
Давыдов М.И. Дренирование и лаваж брюшной полости, декомпрессия и лаваж полых
органов желудочно-кишечного тракта в лечении перитонита // Хирургия. - 2001. -
№2. - С. 56-59.
3.
Большой
сальник: Пер. с англ. / Под ред. Д.Либерманн-Мефферт, Х.Уайта. - М.: Медицина,
1989. - 336 с.
4.
Бояринов Г.А.,
Векслер Н.Ю. Свойства и сферы применения натрия гипохлорита // Эфферентная
терапия.- 1997.- Т.3, №2. - С. 5-14.
5.
Брискин Б.С.,
Смаков Г.М., Бородин А.С., Марченков А.Д. Обтурационная непроходимость при раке
ободочной кишки // Хирургия. - 1999. - №5. - С. 37-40.
6.
Брюсов П.Г.,
Иноятов И.М., Переходов С.Н. Профилактика несостоятельности сигморектальных
анастомозов после передней резекции прямой кишки по поводу рака // Хирургия.
- 1996. - №2. - С. 45-48.
7.
Булынин В.И.,
Ермакова А.И., Глухов А.А., Мошуров И.П. Лечение ран с использованием потока
озонированного раствора под высоким давлением // Хирургия. - 1998. - №8. -С.
23-24.
8.
Буянов В.М.,
Маскин С.С. Современное состояние вопросов диагностики, тактики и методов
хирургического лечения толстокишечной непроходимости //Анналы хирургии. - 1999.
- №2. -С. 23-31.
9.
Буянов
В.М., Маскин С.С., Коровин А.Я. и др. Однорядные кишечные швы и современные
шовные материалы в колоректальной хирургии // Вестн. хирургии. - 1999. - Т.158,
№2. - С. 77-82.
10.
Васильев И.Т., Мумладзе
Р.Б., Якушин В.И. и др. Иммунокоррегирующее действие озона у больных с кишечной
непроходимостью // Матер. 9 Всероссийского съезда хирургов. - Волгоград, 2000.
- С. 150.
11.
Винник Ю.С.,
Перьянова О.В., Якимов С.В. и др. Применение озонированного физиологического
раствора в комплексном лечении гнойных осложнений острого панкреатита // Анналы
хирургической гепатологии. - 2002. - Т.
7, №1. - С. 59-62.
12.
Гатауллин Н.Г.,
Нартайлаков М.А., Плечев В.В. Профилактика послеоперационных
гнойно-воспалительных осложнений в хирургии желудочно-кишечного тракта // Хирургия.
- 1990. - №9. - С. 160-163.
13.
Горский В.А.,
Шуркалин Б.К., Воленко А.В. и др. Вариант укрепления кишечного шва при
перитоните и кишечной непроходимости // Неотложная и специализированная
хирургическая помощь: Первый конгресс московских хирургов. Тезисы докладов. –
М., 2005. - С. 133.
14.
Елизаровский
С.И. Практические возможности оментоорганопексии // Вестн. хирургии. - 1978. -
Т.121, №8. - С. 14-20.
15.
Жетимкаринов
Д.С., Островский В.К. Анатомия и хирургия большого сальника и связок желудка. –
Ульяновск: Изд-во СВНЦ, 1999. - 100 с.
16.
Запорожец А.А.
Инфицирование брюшины через физически герметичный кишечный шов - Минск: Наука и
техника, 1968. - 208 с.
17.
Ивлиев Н.В.
Озонотерапия и гипохлорит натрия в хирургическом лечении острой кишечной
непроходимости (экспериментальное исследование): Дис. … канд. мед. наук. -
Смоленск, 2005. -153 с.
18.
Калиш Ю.И.,
Мадартов К.М., Торкин А.Э. Использование лазера в хирургическом лечении острой
кишечной непроходимости и профилактике спаечной болезни // Хирургия. - 1996.
- №6. - С. 103-108.
19.
Кечеруков А.И.,
Чернов И.А., Алиев Ф.Ш. и др. Проблема хирургического шва толстой кишки //
Хирургия. - 2003. - №9. - С. 68-74.
20.
Корепанов В.И.
Новое в хирургической технике при операциях на пищеводе, желудке и кишечнике
(обзор литературы) // Хирургия. - 1985. - №2. - С. 132-139.
21.
Кудрявцев Б.П.,
Мирошин С.И., Семенов С.В. и др. Озонотерапия распространенного перитонита в
раннем послеоперационном периоде // Хирургия. - 1997. - №3. - С. 36-41.
22.
Лелянов А.Д.
Альтернативные методы детоксикации и иммунокоррекции в лечении
гнойно-воспалительной патологии органов брюшной полости: Дис. … д-ра мед. наук.
- Смоленск, 1999. - 285 с.
23.
Лелянов А.Д.,
Касумьян С.А., Бескосный А.А. Опыт применения гипохлорита натрия и озона в
комплексном лечении распространенного гнойного перитонита // Неотложная и
специализированная хирургическая помощь: Первый конгресс московских хирургов.
Тезисы докладов. – М., 2005. - С. 146-147.
24.
Макарова Н.П.,
Троицкий Б.С., Быков С.Г. Выбор хирургической тактики при обтурационной
толстокишечной непроходимости // Хирургия. - 2000. - №8. - С. 45-48.
25.
Мельник В.М.,
Пойда А.И. Диагностика, лечение и профилактика осложнений, связанных с
формированием анастомозов на толстой кишке // Хирургия. - 2003. - №8. - С.
69-74.
26.
Николадзе Г.Д.,
Сонгулашвили З.Е. Применение большого сальника в хирургии пищевода // Хирургия.
- 1993. - №2. - С. 77-80.
27.
Оноприев В.И.,
Сиюхов Ш.Т., Элозо В.П. и др. Асептический способ и микрохирургическая техника
формирования толстокишечных анастомозов // Клиническая хирургия. - 1981. - №2.
- С. 19-23.
28.
Пархисенко
Ю.А., Глухов А.А. Применение озонотерапии и гидропрессивных технологий в
комплексе интенсивной терапии хирургического сепсиса // Хирургия. - 2001. - №4.
- С. 55-58.
29.
Петров В.И.,
Луцевич О.Э. Способы защиты кишечного анастомоза (Обзор литературы) //
Хирургия. - 1983. - №3. - С. 116-120.
30.
Петров В.П.,
Ерюхин И.А. Кишечная непроходимость. - М.: Медицина, 1989. - 288 с.
31.
Романенко Н.Я.
Использование сальника и париетальной брюшины при операциях на органах брюшной
полости // Хирургия. - 1980. - №7. - С. 33-35.
32.
Тимербулатов
В.М., Хунафин С.Н., Гаттаров И.Х., Кунафин М.С. Клиника и хирургическое лечение
спаечной кишечной непроходимости // Вестн. хирургии. - 1999. -Т.159, №6. - С.
36-39.
33.
Тихонов И.А.,
Басуров Д.В. Способы формирования межкишечных анастомозов в колоректальной
хирургии // Хирургия. - 2002. - №12. - С. 64-67.
34.
Топузов Э.Г.,
Шишкина Г.А., Кокая А.А., Станчиц И.В. Интраоперационный толстокишечный
сорбционный диализ как способ детоксикации при раке толстой кишки, осложненном
непроходимостью // Матер. 9 Всероссийского съезда хирургов. - Волгоград, 2000.
- С. 219.
35.
Федоров В.Д.,
Ривкин В.Л., Тихонов А.М. и др. Межкишечные анастомозы // Советская медицина. -
1975. - №2 - С. 32-37.
36.
Федоровский
Н.М. Непрямая электрохимическая детоксикация: Пособие для последипломной
подготовки врачей. - М.: Медицина, 2004. - 144 с.
37.
Чернов В.Н.,
Белик Б.М. Патогенез, клиническое течение и лечение острой непроходимости кишечника
// Матер. 9 Всероссийского съезда хирургов. - Волгоград, 2000. - С. 232-233.
38.
Шеянов С.Д.
Однорядный прецизионный шов при повреждениях ободочной кишки // Вестн.
хирургии. - 1996. - Т. 155, №4. - С. 118.
39.
Шуркалин Б.К.,
Горский В.А., Леоненко И.В. Проблема надежности кишечного шва // Consilium
medicum. - 2004. - №6. - С.
442-446.
40. Eberhardt
H.G. The efficacy of ozone therapy as an antibiotic // Ozone of Medicine. -
San-Francisco, USA, 1993. - M.-1. - P. 18-31.
41. Eccles W.
The great omentum: notes on its development, anatomy, physiolоgy, and pathology //St. Bаrt. Нosp. Reр. - 1984.
- Vol. 30. - P. 81-110.
42. Hesp W.,
Hendriks T., Lubbers E., de Boer H. Wound healing in the intestinal wall. A comparison
between experimental ileal and colonic anastomoses // Dis. Colon Rectum. -
1984. - Vol. 27. - P. 99-104.
43. Hubens G.,
Totte E., Van-Marck E., Hubbens A. Effect of non-absorbable and rapidly absorbable
suture material on the cyto-kinetics of crypt cells in colonic anastomoses in
the rat // Eur. Surg. Res. - 1992. - Vol. 24, №2. - P. 97-102.
44. Martines
Mas E., Vazques Prado A., Larrocha Grau M. et al. The impact of low-residue enteral
feeding on the healing of colonic anastomoses // Hepatogastroenterology. -
1993. - Vol. 40, №5. - P. 481-484.
45. Murray J.,
Schoetz D., Coller J. et al. Intraoperative colonic lavage and primary
anastomosis an nonelective colon resection // Dis. Colon Rectum. - 1991. - Vol.
34, №7. - P. 527-531.
46. Rilling S.
The basic clinical applications of Ozone therapy // Ozonachrichten. - 1985. -
Vol. 4. - P. 7-17.
47. Testini
M., Scacco S., Loiotila L. et al. Comparison of oxidative phosphorylation in
the anastomosis of the small and large bowel. An experimental study in the
rabbit // Europ. Surg. Res. - 1998. - Vol. 30, №1. - P. 1-7.
48. Viebahn R.
The biochemical processes underlying ozone therapy // Ozone: Sci End. - 1985. -
№7. - P. 275-285.
The role of
ozone and hypochlorite sodium
application
in irrigation of the intestinal
anastomosis
wound
Jvliev
N. V., Bazhenov S. M., Lelyanov A. D., Kasumyan S. A.,
Dubenskaya
L. I., Nikonorova N. M.
The peculiarities of healing experimental intestinal anastomosis were examined. In the research there were used conditions of combined application both ozone and hypochlorite sodium for irrigation of the wound. The original macro and micro criterions of estimation of the anastomosis state were developed. A new “epiploon” type of the intestinal wounds’ healing was presented.
Центральная
научно-исследовательская лаборатория
Кафедра
факультетской хирургии
Смоленская государственная
медицинская академия
Поступила в
редакцию 29.03.2007.