- Математическая морфология.
Электронный математический и
медико-биологический журнал. - Т. 6. -
Вып. 4. - 2007. - URL:
http://www.smolensk.ru/user/sgma/MMORPH/TITL.HTM
http://www.smolensk.ru/user/sgma/MMORPH/N-16-html/TITL-16.htm
http://www.smolensk.ru/user/sgma/MMORPH/N-16-html/cont.htm
УДК 502.085
Иммунная система и иммунокомпьютинг
Ó 2007 г. Блюм В. С. 1, Заболотский В. П. 2
Иммунная система
одна из немногих биологических систем, обладающих способностями
"интеллектуальной" обработки информации. В настоящем обзоре приведены
современные представления о составе, структуре и основных функциях иммунной
системы. Вычислительные
способности иммунной системы исследуются в рамках нового научно-технического
направления, названного иммунокомпьютингом. В обзоре приведены базовые
формализмы иммунокомпьютинга и сформулированы основные задачи данного
направления исследований.— Библ. 54 назв.
Ключевые слова: иммунная система, иммунокомпьютинг
Введение
Только два типа
биологических систем – нервная и иммунная – обладают способностями
"интеллектуальной" обработки информации, включая память, обучение,
распознавание и принятие решений в заранее незнакомых ситуациях. Известно, что свобода – это
осознанная необходимость. Возможно именно этим тезисом руководствовались те,
кто систему охраны и обороны живого организма назвал иммунной системой (от лат.
Immunitas - освобождение). Иммунную систему называют также "вторым мозгом позвоночных" за ее способность
распознать любую потенциально опасную молекулу, даже если последняя никогда до
этого не встречалась на Земле.
В результате непрерывного исполнения функций
распознавания, переработки и устранения чужеродных тел и веществ организм
обладает замечательным свойством –
иммунитетом.
Иммунитет - невосприимчивость, сопротивляемость
организма к инфекционным агентам и чужеродным веществам.
Иммунная система живого организма (в первую очередь, иммунная система человека) нам интересна:
1)
как
объект для математического и компьютерного моделирования с целью выявления ее
уязвимости и поиска эффективных методов борьбы за здоровье человека;
2)
как
источник новых знаний об эффективных алгоритмах и структурах данных для использования в системах информационной
безопасности.
Совет по биотехнологическим и биологическим научным
исследованиям (Biotechnology and Biological Sciences Research Council - BBSRC)
в 2007 году выделил в качестве актуальной проблемы разработку общей модели,
описывающей работу иммунной системы и всех ее компонентов.
Иммунная система является одной
из самых сложных систем организма, о работе которой ученые до сих пор не имеют
исчерпывающего представления.
Новый междисциплинарный подход
к изучению иммунной системы потребует дополнительной информации, описывающей
взаимодействие ее компонентов, которая должна быть представлена в
количественном выражении. В таком виде она будет доступна не только
иммунологам, но и специалистам из других областей науки – математикам, физикам,
инженерам и другим исследователям.
Вычислительные
способности иммунной системы только недавно были оценены как новое
перспективное направление, названное иммунокомпьютингом
(ИК) [1].
Иммунная система
В процессе эволюции живых существ возникли многоклеточные организмы. По
мере усложнения их строения происходила специализация функций разных клеток и
состоящих из них органов: пищеварения, дыхания и других. На определенном этапе
эволюции в многоклеточном организме появились клетки, призванные защищать
организм от микробов-паразитов. Постепенно сформировалась особая система
органов и клеток, обеспечивающих защиту (иммунитет) организма от любых типов
вторжений, которая получила название иммунной системы. Клетки, входящие в
состав иммунной системы, были названы иммунокомпетентными.
Защита осуществляется с
помощью двух систем - неспецифического (врожденного, естественного) и
специфического (приобретенного) иммунитета [5-23]. Это две стадии единого
процесса защиты организма. Неспецифический иммунитет выступает как первая линия
защиты и как заключительная ее стадия. Система приобретенного иммунитета
выполняет промежуточные функции специфического распознавания и запоминания
болезнетворного агента (или чужеродного вещества), после чего подключаются
мощные средства врожденного иммунитета для заключительного этапа борьбы с
вторжениями.
Система врожденного
иммунитета действует на основе воспаления и фагоцитоза. Эта система реагирует
только на корпускулярные агенты (микроорганизмы, занозы) и на токсические
вещества, разрушающие клетки и ткани, вернее, на корпускулярные продукты этого
разрушения.
Cистема
приобретенного иммунитета основана на специфических функциях лимфоцитов, клеток
крови, распознающих чужеродные макромолекулы и реагирующих на них либо
непосредственно, либо путем производства защитных белковых молекул.
Доказано, что
рассматриваемая реакция организма (специфический иммунитет) имеет следующие неразрывно
связанные особенности:
1)
способность
отличать ''свое'' от ''не своего'',
2)
способность
запоминать вторжения, так называемая иммунологическая память,
3)
способность
запоминать вторжения с “большой” точностью, так называемая специфичность,
4)
способность
проявлять терпимость к вторжениям (белкам), произошедшим на ранних стадиях развития организма, так называемая
толерантность.
Открытыми остаются вопросы:
¨
Каким
образом защитные клетки, циркулирующие в крови или осевшие в органах и тканях
иммунной системы, отдаленных от мест уязвимости организма, получают и
воспринимают сигнал опасности микробной агрессии?
¨
Как
обеспечивается строгая последовательность включения отдельных типов клеток в
борьбу с инфекцией?
¨
Откуда
узнает иммунная система, какие именно защитные механизмы следует использовать
при данной инфекции?
¨
Множество
иных вопросов.
Структура и состав иммунной системы
Система информационных каналов. Эта
компонента традиционно не входит в состав иммунной системы, но с позиций
инженерии без ее рассмотрения нельзя ответить на вопросы о маршрутах и трафике
информационных потоков в иммунной системе. Речь идет о работе
сердечно-сосудистой системы, которая не только обеспечивает транспорт
жизнеобеспечивающих материалов, но и создает сеть информационных каналов иммунной
системы с соответствующим
информационным трафиком [3]. Сердечно-сосудистая система (ССС) состоит
из подсистемы магистралей крови (СМК) и подсистемы магистралей лимфы (СМЛ). В
составе ССС можно выделить следующие информационные компоненты (рис.1.):
¨ b1,…,bn – модули биомассы большого круга
кровообращения;
¨ a1,…,am –
модули биомассы малого круга кровообращения;
¨ da –
артериальная чудесная сеть;
¨ dv –
венозная чудесная сеть;
¨ L1,…,Lk –
лимфатические узлы.
Модули биомассы, по нашему
мнению, могут формироваться по критерию диаметра входящего сосуда, например, ![]() мкм.
мкм.
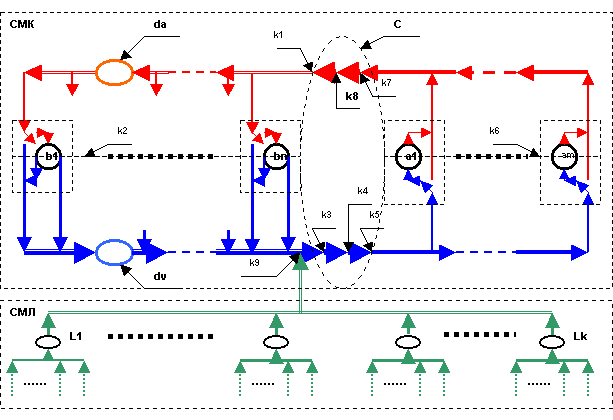

Рис.1. Структура информационных
каналов.
¨
C – сердечная мышца;
¨
сечение
выхода (аортального клапана) желудочка «левого» сердца – ![]() ,
,
¨
сечение
микроциркуляторного русла – ![]() ,
,
¨
сечение
входа предсердия «правого» сердца – ![]() ,
,
¨
сечение
трехстворчатого клапана «правого» сердца – ![]() ,
,
¨
сечение
выхода (легочного клапана) желудочка «правого» сердца – ![]() ,
,
¨
сечение
перехода венозной крови в артериальную – ![]() ,
,
¨
сечение
входа предсердия «левого» сердца – ![]() ,
,
¨
сечение
митрального клапана «левого» сердца – ![]() ,
,
¨
сечение входа лимфатического потока – ![]() .
.
Для
данного ![]() согласно закону
Маррея в теле взрослого человека можно насчитать около 16 тысяч модулей биомассы большого круга
кровообращения – областей микроциркуляторного русла, в каждой из которых
обслуживается порядка
согласно закону
Маррея в теле взрослого человека можно насчитать около 16 тысяч модулей биомассы большого круга
кровообращения – областей микроциркуляторного русла, в каждой из которых
обслуживается порядка ![]() клеток.
клеток.
Система поверхностей
вторжений. Организм
позвоночного животного, в рамках
которого имеет смысл понятие «иммунная система», обладает огромной и
непрерывной, с позиций топологии, поверхностью контактов с внешним миром. Речь
идет, в первую очередь, о поверхностях кожного покрова, органов дыхания и
органов пищеварения. Ограниченное
указанной непрерывной поверхностью 3-х мерное пространство может быть названо
пространством иммунитета, защитой от вторжений в которое занимается иммунная
система. Далее можно говорить о иерархии вложений поверхностей вторжений, имея
ввиду поверхности внутренних органов и поверхности клеточных мембран [4].
Центральные органы иммунной
системы. К
первичным центральным органам относят вилочковую железу (тимус) и сумку
Фабрициуса (bursa of Fabricius),
обнаруженную только у птиц. У человека (и других млекопитающих) роль сумки
Фабрициуса выполняет, очевидно, костный мозг, поставляющий стволовые
клетки-предшественники лимфоцитов. Оба центральных органа иммунной системы
являются местами дифференцировки (выращивания и обучения для конкретных
применений) популяций лимфоцитов. Вилочковая железа поставляет Т-лимфоциты
(тимус-зависимые лимфоциты), а в костном мозге (сумке Фабрициуса) образуются
В-лимфоциты.
Вилочковая железа (тимус) получила название
из-за сходства с вилами и листьями растения тимиана. У человека зачаток тимуса
появляется на шестой неделе эмбрионального развития. Он интенсивно развивается
и его масса по отношению к общей массе тела увеличивается до последней трети
периода внутриутробного развития. B дальнейшем рост тимуса замедляется, и еще
до рождения начинается прогрессивное снижение его относительной массы,
сопровождающееся постепенным уменьшением количества лимфоцитов и телец
вилочковой железы (тельца Гассаля), фиброзом и жировым перерождением. Однако у
молодых людей размеры тимуса еще значительны. Динамика развития тимуса
позволяет предположить что свою основную функцию он осуществляет на ранних этапах
внутриутробного развития.
Костный мозг у млекопитающих состоит из
ретикулярной стромы и находящихся в ней клеток эритроцитарного,
гранулоцитарного и мегакариоцитарного рядов. Костный мозг у человека имеет
общую массу около 3 кг. Расположен в губчатом веществе костей, содержит
кроветворную и жировую ткань в соотношении 1:1. Представлен сетью, образованной
ретикулярной стромой, сосудами, нервными волокнами и эндостом. В ячейках
ретикулярной сети располагаются клеточные элементы. С пятого месяца внутриутробного
развития это основной кроветворный орган у человека. В костном мозге содержатся
предшественники IgM-синтезирующих клеток. Если добавлять к вводимому облученным
животным костному мозгу Т-клетки, то при иммунизации бараньими эритроцитами
титры антител возрастают в десятки раз, т. е. в костном мозге имеется дефицит
Т-клеток.
Центральные
лимфоидные органы заселяют лимфоцитами всю лимфоидную систему, а
иммунологические процессы осуществляются в основном в лимфоидной ткани
вторичных лимфоидных органов - в лимфоузлах, в селезенке, в миндалинах, в
аппендиксе, в скоплениях лимфоидной ткани.
Периферические органы иммунной системы. К периферическим органам
иммунной системы относятся селезенка,
лимфатические узлы, миндалины, а также ассоциированная с
кишечником и бронхами лимфоидная ткань.
К моменту рождения они еще практически не сформированы, поскольку не
контактировали с антигенами. Лимфопоэз в них осуществляется лишь при наличии
антигенной стимуляции. Периферические органы иммунной системы заселяются В- и
Т-лимфоцитами из центральных органов иммунной системы, причем каждая популяция
мигрирует в свою зону – тимусзависимую и тимуснезависимую. После контакта с
антигеном в этих органах лимфоциты включаются в рециркуляцию, поэтому ни один
антиген не остается незамеченным лимфоцитами.
Лимфатические
узлы представляют собой скопления лимфоидной ткани различных размеров губчатой
структуры по ходу лимфатических и кровеносных сосудов. Они распространены по
всему организму и соединены между собой и с другими лимфоидными органами
посредством лимфатических сосудов. Состоят лимфоузлы из лимфоцитов,
расположенных в сети, образованной ретикулярными клетками. Их функция -
элиминация чужеродных частиц из лимфы. У человека и приматов лимфоузлов
значительно больше, чем у других видов животных. У человека имеется 500-1000
лимфоузлов диаметром от 1 до 5 мм. В лимфатическом узле различают корковое и
мозговое вещество, являющиеся тимуснезависимыми зонами, и расположенную между
ними паракортикальную зону. Это тимусзависимая зона, так как после тимэктомии в
ней наступают атрофические изменения. В паракортикальной зоне происходит
пролиферация Т-клеток и кооперативное взаимодействие Т- и В-клеток.
Селезенка располагается в левой
верхней части брюшной полости. Покрыта снаружи соединительнотканной капсулой.
От последней отходят многочисленные трабекулы, образующие структурный каркас
органа. Селезенка является лимфоидным органом и органом кроветворения. В ней
осуществляется деструкция старых, мертвых и поврежденных эритроцитов. Как и в
тимус, в селезенку лимфоциты поступают кровеносным путем. Селезенка не имеет ни
афферентных, ни эфферентных лимфатических сосудов. Артерии проникают в
селезенку через ворота и их ветви расходятся по трабекулам в виде мелких
артерий и артериол, переходящих в паренхиму. В участках, где артерии выходят из
трабекул, они окружены бледно окрашивающейся массой лимфоидной ткани, именуемой
белой пульпой, которая состоит из лимфоцитов, моноцитов, макрофагов и
ретикулярных клеток (лимфоидные муфты). Центральные артериолы дают ответвления
в виде капилляров. Затем кровь переходит в красную пульпу, состоящую из
селезеночных тяжей и синусов. Последние представляют собой длинные сосудистые
каналы, а селезеночные тяжи - это скопления клеток, лежащих между синусами. В
них находятся лимфоциты, макрофаги, нейтрофилы и эритроциты. Как и лимфоузлы,
селезенка продуцирует лимфоциты и плазматические клетки. Особо важное значение
имеет в детском и молодом возрасте, когда лимфоидная система еще не развита.
Небные миндалины. Физиологическая функция
небных миндалин окончательно не установлена, как не решен вопрос о том,
относятся ли они к центральным или периферическим лимфоидным органам. Возможно,
что небные миндалины выполняют несколько важных функций: осуществляют защиту
верхних дыхательных путей от инфекции, снабжают лимфоидную ткань всего
организма коммитированными лимфоцитами и участвуют в формировании микробного
ценоза полости рта и носовой части глотки. Небные миндалины, являющиеся
основным образованием лимфоидного глоточного кольца, находятся у человека между
небными дужками у входа в полость глотки.
Кожа не является лимфоидным
органом, однако в коже имеются антигенпредставляющие дендритные (ретикулярные)
клетки, лимфоциты и лимфоидная ткань. Кожа обеспечивает защиту от патогенных
внутриклеточных микробов и от развития опухолевых клеток. Лимфоидные и
ретикулярные клетки и лимфоидная ткань кожи обеспечивают функцию иммунного
надзора в коже, в частности иммунное распознавание. В осуществлении иммунных
реакций в коже участвуют кератиноциты, клетки Лангерганса и иммунокомпетентные
лимфоциты. Клетки Лангерганса имеют костномозговое происхождение, составляют
около 4 % эпителиальных клеток базального слоя кожи. По морфологии и
способности к экспрессии белков Iа на цитоплазматической мембране они сходны с
дендритными клетками, но отличаются по маркерам и наличию ферментов. Они,
возможно, являются предшественниками дендритных клеток. Клетки Лангерганса
играют важную роль в развитии гиперчувствительности замедленного типа,
противоопухолевого иммунитета и реакций в отношении кожных трансплантатов.
Лимфоидные скопления. Лимфоидная ткань в виде
скоплений ее элементов обнаруживается под слизистой оболочкой кишок, гортани,
бронхов, мочеполовых органов, а также в почках, коже. Такие конгломераты легко
возникают при хроническом воспалении. Лучше других изучены лимфоидные
образования кишок. Лимфоидная ткань кишок синтезирует антитела, что имеет
важное значение в невосприимчивости организма к кишечным инфекциям.
Доказательством может служить проникновение микробов из кишок в кровь у
облученных животных. Лимфатические узлы вдоль кишок и верхних дыхательных путей
- это мелкие скопления лимфоидных элементов и фагоцитирующих клеток,
отличающиеся от лимфоузлов отсутствием капсул. Они участвуют в реакциях
неспецифической резистентности и специфического иммунитета. В них синтезируются
IgE и IgA. Иммунологически компетентные клетки лимфоидной ткани кишок могут
мигрировать в другие ткани и там размножаться.
Все
выше перечисленные органы являются неотъемлимыми участниками сложной функции,
которая названа ИММУННЫМ ОТВЕТОМ
(IMMUNE RESPONSE). ИММУННЫЙ ОТВЕТ - это действия иммунной системы в
ответ на вторжение чужеродных веществ.
В
иммунном ответе участвуют специализированные клетки: лимфоциты, плазмоциты,
ретикулярные клетки, эозинофилы и макрофаги. Лимфоциты и плазмоциты являются
иммунокомпетентными клетками, все остальные - вспомогательными.
Основные операнды процедуры ИММУННОГО ОТВЕТА –
это антигены, антитела, макрофаги, В- и Т-лимфоциты и цитокины.
Антигены - (от анти и греч. génos
- рождение, происхождение), высокомолекулярные коллоидные вещества, которые при
введении в организм животных и человека вызывают образование специфических
реагирующих с ними антител. Непременным условием антигенности является отличие
антигенов от веществ, имеющихся в норме в организме реципиента. К антигенам
относятся прежде всего чужеродные белки, некоторые полисахариды (большей частью
бактериального происхождения), комплексы белков с разнообразными химическими
соединениями. Антигены бывают корпускулярные (например, взвеси бактерий),
дающие с антителами реакцию агглютинации (склеивания), и растворимые (например,
токсины), дающие реакцию преципитации (осаждения). Низкомолекулярные, простые
белки, такие, как желатина, не являются антигенами, яичный и сывороточный
альбумины (молекулярная масса 40000-70000) имеют меньшую антигенность, чем
гамма-глобулины и другие белки с большей молекулярной массой (>160000).
Липиды и углеводы, не обладающие антигенными свойствами и приобретающие их в
соединении с белками, называются гаптенами. Можно искусственно синтезировать
антигены, соединяя те или иные химические вещества с белком. В антигенах
содержатся два компонента: высокомолекулярное вещество, являющееся проводником
антигенного раздражения (большей частью это белок), и небелковая группа,
структура которой определяет специфичность данного антигена. Эти группы
называются детерминантными (или факторами специфичности); они расположены на
поверхности антигена и могут быть отделены от коллоидного носителя. При
некоторых патологических состояниях (например, гемолитической анемии)
собственные белки организма приобретают антигенные свойства, т. е. становятся
аутоантигенами. Т. к. белки имеют индивидуальную специфичность (имеют
генетический код), то белки одного животного являются антигенами для другого
животного того же вида (изоантигены).
Антитела (antibodies)—белки относящиеся к
подклассу гамма-глобулинов, образующиеся в организме при попадании в него
некоторых чужеродных веществ (антигенов) и обладающие способностью избирательно
соединяться с теми же антигенами или (в меньшей степени) со сходными с ними по
строению веществами, вызывая тем самым иммунный ответ организма.
Выделяют
антиинфекционные или антипаразитарные антитела, вызывающие непосредственную
гибель или нарушение жизнедеятельности возбудителя инфекции либо паразита, и
антитоксические антитела, не вызывающие гибели самого возбудителя или паразита,
но обезвреживаюшие вырабатываемые им токсины (яды). Кроме того, выделяют также
так называемые «антитела-свидетели заболевания», наличие которых в организме
сигнализирует о знакомстве иммунной системы с данным возбудителем в прошлом или
о текущем инфицировании этим возбудителем, но которые не играют существенной
роли в борьбе организма с возбудителем (не обезвреживают ни самого возбудителя,
ни его токсины, а связываются со второстепенными белками возбудителя).
Антитела реагируют только с
теми антигенами, которые индуцировали их синтез. Изменения химической или
физической структуры антигенов приводят к образованию иных, видоизмененных
антител. Такое прямое соответствие между антигенами и антителами известно под
названием специфичности.
В настоящее время
представление о том, что комплементарность структуры определенного участка
антигена и активного центра антитела определяет специфичность их
взаимодействия, является общепризнанным.
Форма молекулы антитела и
распределение электрического заряда по ее поверхности делают ее способной
связывать антиген, комплементарный ей по форме и распределению заряда.
Антитело состоит из двух идентичных
пар полипептидных цепей: Н (Heavy - тяжелых) с молекулярным весом примерно
50000 и L (Light - легких) - примерно 25000. Цепи соединены друг с другом
ковалентными (дисульфидными) связями.
Макрофаги — это вид белых кровяных
телец лейкоцитов, известных как фагоциты, получившие свое название от
греческого phago —«есть» и cyt — «клетка». Кроме кровотока, главная территория
макрофагов в организме — это селезенка, костный мозг, лимфатические узлы,
альвеолярные мешочки в легких (легочные альвеолы), брюшина (мембрана брюшной
стенки), печень, соединительная ткань и центральная нервная система. Макрофаги
рождаются в костном мозге, но их резерв рано или поздно исчерпывается, и их
приток в организм прекращается. Сами макрофаги
тоже смертны. Одна клетка делится не более 50-60 раз. Когда они престают
поступать в органы и ткани, начинается старение.
Макрофаги называют
клетками-мусорщиками из-за их способности захватывать, поглощать, убивать и
переваривать все, с чем они соприкасаются. Часть макрофагов ведет оседлый образ
жизни, найдя себе место в селезенке, в одном из лимфоузлов, в печени, в легких
или даже в костях. Другие ведут блуждающий образ жизни, ползая по серозным
оболочкам и передвигаясь внутри рыхлой соединительной ткани. Все они происходят
из моноцитов крови, а те, в свою очередь, из промоноцитов костного мозга,
которые постепенно созревают из более ранних клеток-предшественников. У
макрофагов есть обратная связь с этими клетками-предшественниками: зрелый
макрофаг может продуцировать специальные цитокины - ростовые факторы, которые с
кровью поступают в костный мозг и усиливают процессы деления и созревания
клеток-предшественников. При инфекции, когда многие макрофаги погибают в борьбе
с микробами, им на смену приходят новые молодые макрофаги, ускоренно созревающие
в костном мозге.
Лимфоциты. Различают малые, средние и большие лимфоциты. Малые лимфоциты имеют
диаметр менее 8 мкм. В ядре у них находятся глыбки хроматина. Цитоплазма
располагается вокруг ядра в виде узкого ободка, гомогенна, содержит мало или не
содержит вовсе пиронина и рибосом. Средние лимфоциты имеют сходную с малыми
структуру, размеры их 8-12 мкм. Большие лимфоциты имеют диаметр 12-14 мкм, ядро
большое, светлое, с ядрышком и зернами хроматина, в цитоплазме много рибосом и
пиронина. Лимфоциты составляют основную массу клеточных элементов лимфоидной
ткани, 95 % клеток лимфы и 30 % общего числа лейкоцитов крови.
Обратим внимание на тот факт, что количество лимфоцитов в иммунной
системе имеет, по крайней мере, один порядок величины, что и число нейронов в
нервной системе. Лимфоциты среди прочих клеток нашего тела, распространяемых по
крови и лимфе, имеют наибольшие концентрации в селезенке, лимфоузлах, тимусе и
костном мозге. Но их практически нет в мозге. [THE IMMUNE SYSTEM Nobel lecture, 8 December 1984 by NIELS K. JERNE
]
Т-лимфоциты — это вид белых клеток крови. Незрелые лимфоциты покидают костный мозг и попадают в
кровяное русло. Некоторые из них направляются к тимусу (вилочковой железе),
расположенному у основания шеи, где происходит их созревание. Прошедшие через
тимус лимфоциты известны как Т-лимфоциты, или Т-клетки (Т от «тимус»). Хотя
иммунный ответ запускает макрофаг, и Т-лимфоцитам не обойтись без сигнала
активации, который макрофаг посылает к Т-лимфоцитам через молекулу цитокин
(интерлейкин), только лимфоциты имеют специальные рецепторы для распознавания
чужеродных молекул, получивших название "антигены", и только
лимфоциты обеспечивают иммунный ответ. Одновременно два сигнала активации идут
с поверхности Т-лимфоцитов к ядру: от антиген-распознающего рецептора и от
рецептора, связавшего интерлейкин. Под действием этого двойного сигнала в
геноме Т-лимфоцитов активируются гены как самого интерлейкина, так и гены
рецепторов, специфичных для интерлейкина. После этого продукт Т-лимфоцитов начинает
воздействовать на клетки, в которых он и был синтезирован: в этих клетках
активируется процесс деления и за счет этого усиливаются функции всей популяции
Т-лимфоцитов, участвующих в специфическом иммунном ответе на данный антиген.
Т-лимфоциты держат весь
иммунный ответ под контролем, не допуская чрезмерной активации отдельных
иммунокомпетентных клеток, которая чревата осложнениями. Инструментами такого
контроля служат цитокины, способные не только активировать (усиливать), но и
подавлять (ингибировать) функции других клеток.
Между Т-лимфоцитами и
макрофагами существует двухсторонняя связь, в динамике развития иммунного
ответа протекают цитокиновые диалоги. Первые получают от макрофагов сигнал
активации в виде молекулы интерлейкина-1, для восприятия которого имеют на
поверхности соответствующие рецепторы. От рецепторов идет сигнал активации
генов Т-лимфоцитов, заведующих синтезом интерлейкина-2 и гамма-интерферона.
Рецепторы Т-лимфоцитов распознают интерлейкин-2, а после того, как последний
садится на рецептор, от него поступает сигнал дальнейшей активации синтезов в
клетках Т-лимфоцитов и начала деления клетки. Что касается гамма-интерферона,
то эти молекулы направляются в виде ответного послания макрофагу, на
поверхности которого эту молекулу ждут соответствующие рецепторы.
Гамма-интерферон не зря называют макрофаг-активирующим фактором. Связавшись со
своим рецептором на внешней поверхности клетки макрофага, он посылает к ядру
этой клетки сигналы активации нескольких десятков генов, в том числе гена, ответственного
за синтез интерлейкина-1. В результате Т-лимфоциты получают от активированного
макрофага новую порцию активирующих их молекул интерлейкина-1.
Рецептор лимфоцитов, в
отличие от антител, - гетеродимер, состоящий из пары различных цепей - a и b с молекулярным
весом около 50000, соединенных между собой одной дисульфидной связью. H-, L-,
a- и b-цепи имеют сходный план строения и относятся к одному большому
суперсемейству белков - иммуноглобулинов.
Защита
организма, осуществляемая с помощью Т-клеток, называется клеточным иммунитетом,
так как в ее основе лежит взаимодействие отдельных клеток с антигенами.
B-лимфоциты — это еще один вид белых клеток крови. В
экспериментах на цыплятах было показано, что часть незрелых лимфоцитов
закрепляется и созревает в сумке Фабрициуса – лимфоидном органе около клоаки.
Такие лимфоциты известны как В-лимфоциты, или В-клетки (B от bursa –
сумка). У человека и других млекопитающих В-клетки созревают в лимфатических
узлах и лимфоидной ткани всего организма, эквивалентных сумке Фабрициуса у
птиц.
Контакт
В-клеточных рецепторов со специфическим антигеном и связывание определенного
его количества стимулируют рост этих клеток и последующее многократное деление;
в результате образуются многочисленные клетки двух разновидностей:
плазматические и «клетки памяти». Плазматические клетки синтезируют антитела,
выделяющиеся в кровоток. Клетки памяти являются копиями исходных В-клеток; они
отличаются большой продолжительностью жизни, и их накопление обеспечивает
возможность быстрого иммунного ответа в случае повторного попадания в организм
данного антигена.
Антитела,
вырабатываемые В-клетками и поступающие в кровь и другие жидкости организма,
относят к факторам гуморального иммунитета (от лат. humor – жидкость).
Цитокины - это небольшие белки (мол. масса от 8 до 80 КДа), действующие
аутокринно (т.е. на клетку, которая их продуцирует) или паракринно (на клетки,
расположенные вблизи). Образование и высвобождение этих высокоактивных молекул
происходит кратковременно и жестко регулируется.
Цитокины традиционно подразделяют на несколько
групп:
¨ интерлейкины (факторы взаимодействия
между лейкоцитами),
¨ интерфероны (цитокины с противовирусной
активностью),
¨ факторы
некроза опухолей
(цитокины с цитотоксической активностью),
¨ колониестимулирующие
факторы
(гемопоэтические цитокины).
Цитокины продуцируются
нейтрофилами, макрофагами, лимфоцитами, фибробластами, эндотелиоцитами,
тромбоцитами, кератиноцитами, стромальными и другими клетками. Многие из них
способны вырабатываться разными типами клеток и действовать на разные типы
клеток. Все цитокины существуют в виде растворимых форм и секретируются во
внеклеточное пространство в активной форме, но отдельные из них способны
нековалентно связываться и формировать комплексы с мембранами клеток. В такой
форме, например, существуют интерлейкин-1
и фактор некроза опухолей.
Более всего изучены цитокины кроветворных и иммунокомпетентных клеток, особенно
в плане регуляции гемопоэза, неспецифических защитных реакций и
иммунологического гомеостаза.
При физиологическом
состоянии, в норме спектр цитокинов узок, но при стрессе, воспалении,
повреждении, опухолеобразовании и др. расширяется количественный и качественный
состав цитокинов, обладающих как местной, так и дистантной активностью.
Действие их реализуется по сетевому принципу, то есть передаваемая клеткой информация содержится не в индивидуальном пептиде, а в наборе регуляторных цитокинов. Цитокины каскадно индуцируют выработку друг друга, трансмодулируют поверхностные рецепторы к другим медиаторам. Стимулирующее или ингибирующее действие цитокинов осуществляется посредством связывания их с большим количеством рецепторов на поверхности клеток. Количество рецепторов цитокинов на клетке мишени значительно варьирует в зависимости от цитокина (от 100 до 100000). Одни и те же цитокины могут выполнять различные функции. Этот феномен объясняется плейотропностью и полифункциональностью действия цитокинов, а также множеством клеток - мишеней, на которые они действуют. Также очевидно, что различные цитокины могут выполнять одну функцию.
На сегодня идентифицировано более 100 цитокиновых биомолекул, и есть все основания считать, что это далеко не предел. В крови цитокины определяются в малых концентрациях (пг/мл).
Цитокины самоорганизуются в
цитокиновые сети с разветвленными многоуровневыми
прямыми и обратными связями. Благодаря этому передаваемая через них клеткой
информация содержится не в отдельно взятом цитокине, но в их наборах.
Регуляторные влияния при этом становятся согласованными и выверенными. Действия
однонаправленного характера мультиплицируются, а разнонаправленного
уравновешиваются. При этом они каскадно индуцируют синтез друг друга и
трансмодулируют поверхностные рецепторы друг к другу. Цитокиновая сеть характеризуется высокой
надежностью вследствие избыточности обеспечения основных влияний; условием ее
функционирования служит активация клеток иммунной системы.
Функции иммунного ответа
Иммунный ответ имеет две
важнейшие подфункции: функцию иммунизации и функцию апоптоза.
Функция иммунизации, в свою очередь, имеет две составляющие:
1.
Система
данных и алгоритмов, которые “вшиты” в иммунную систему и передаются по наследству. Это то, что называется неспецифическим
(врожденным) иммунитетом и
обуславливает однотипные реакции на любые чужеродные вторжения. Главным клеточным
компонентом системы неспецифического иммунитета служат фагоциты, основная
функция которых - захватывать и переваривать проникающие извне агенты. Для
возникновения подобной реакции чужеродный агент должен иметь поверхность, т.е.
быть частицей.
2.
Система
данных и алгоритмов, которые формируются и настраиваются в процессе работы
иммунной системы. Это происходит всякий раз, когда происходит вторжение
вещества молекулярно-дисперсного (например: белок, полисахарид, вирус), и при
этом не токсичного и не обладающего физиологической активностью - оно не может
быть нейтрализовано и выведено организмом по вышеописанной схеме. В этом случае
реакцию обеспечивает специфический
иммунитет. Он приобретается в результате контакта организма с антигеном;
имеет приспособительное значение и характеризуется формированием
иммунологической памяти. Его клеточными носителями служат лимфоциты, а
растворимыми - иммуноглобулины (антитела). Специфические
антитела продуцируются специальными клетками – В-лимфоцитами. Причем для
каждого вида антител существует свой тип В-лимфоцитов (клон). Первое
взаимодействие антигена (бактерии или вируса) с лимфоцитом вызывает реакцию,
названную первичным иммунным ответом, в ходе которого лимфоциты начинают
развиваться (пролиферировать) в виде клонов, претерпевая затем дифференцировку:
некоторые из них становятся клетками памяти, другие превращаются в зрелые
клетки, продуцирующие антитела. Главные особенности первичного иммунного ответа
- существование латентного периода до появления антител, затем выработка их
лишь в небольшом количестве. Вторичный иммунный ответ развивается при
последующем контакте с тем же самым антигеном. Основная особенность -
быстрая пролиферация лимфоцитов с дифференцировкой их в зрелые клетки и быстрая
выработка большого количества антител, которые высвобождаются в кровь и
тканевую жидкость, где могут встретиться с антигеном и эффективно побороть
болезнь.
Апоптоз — это активная форма гибели клетки, являющаяся результатом реализации
ее генетической программы или ответом на внешние силы и требующая затрат
энергии и синтеза макромолекул de novo, проявляющаяся в уменьшении ее размера,
конденсации и фрагментации хроматина, уплотнении наружной и цитоплазматических
мембран без выхода содержимого клетки в окружающую среду.
Термин "апоптоз"
(с греч. — опадание листьев) введен в научный обиход в 1972 г. для обозначения
формы гибели клеток, прототипом которой является гибель тимоцитов под действием
глюкокортикоидов. Эта форма клеточной смерти была отождествлена с ранее описанной программированной гибелью клеток:
разница в обозначениях отражает способы идентификации гибели — морфологический
в первом и биохимический во втором случае.
Функция апоптоза необходима
для понимания иммунного гомеостаза. Гибель части клеток в пределах организма
является закономерным и необходимым явлением, и само существование
многоклеточного организма подразумевает баланс жизни и смерти на уровне
составляющих его клеточных популяций.
Апоптоз служит механизмом
поддержания постоянства численности клеток организма. Генетический анализ
позволил выявить 14 генов, детерминирующих 4 уровня реализации и контроля
апоптоза, и их продукты, некоторые из которых имеют гомологи у млекопитающих.
Апоптоз принимает участие в большом числе
физиологических и патологических процессов, но отметим процесс гибели клеток
иммунной системы, как В-, так и Т-лимфоцитов, после истощения запасов
цитокинов, а также гибели аутореактивных Т-клеток при развитии в тимусе.
Иммунная система как система информационной
безопасности
Работа иммунной системы человека
(млекопитающего) в полном объеме начинается еще в утробе матери и выполняется
без перерывов и выходных в течение всей жизни организма.
Взрослый человеческий
организм – это совместное проживание порядка ![]() клеток, каждая из которых является носителем идентификатора организма –
кода ДНК.
клеток, каждая из которых является носителем идентификатора организма –
кода ДНК.
При этом каждая клетка
организма является объектом контроля собственной иммунной системы (ИмС) –
системы информационной безопасности, которая для каждой клетки решает задачи
целостности, конфиденциальности и доступности информации.
Запуск неспецифического
иммунного ответа
Задача информационной целостности клетки решается средствами самой клетки (дублирование информации, защитные свойства мембраны, включение апоптоза и т.п.), а также средствами ИмС, а именно, проверкой с помощью системы комплемента и различных типов лейкоцитов признаков принадлежности данной клетки родительскому организму. Для этого используется, как на современных самолетах, не сложный, но секретный прибор “свой-чужой”. С большой вероятностью можно сказать, что в основе алгоритма данного прибора лежит уникальный для данного организма код ДНК, которым обладает, как контролируемая так контролирующая клетки.
Очевидно, что инициатива в диалоге “свой-чужой” принадлежит контролируемой клетке.
Действительно, если каждая клетка многоклеточного организма не возьмет
на себя обязательство сообщать окружающим о нарушении своей целостности, то ни
у клетки, ни у организма в целом не будет шансов сохраниться в процессе
эволюции. Для организации внешнего контроля целостности клетки и тем более всех
клеток организма необходимы огромные ресурсы.
Сигналы о нарушении целостности клетки в многоклеточном организме формируются внутри каждой клетки.
К сожалению, интенсивность таких сигналов от клеток злокачественных опухолей недостаточна для эффективной работы иммунной системы.
Эти сигналы используются как для управления внутриклеточными процессами регенерации и включения апоптоза, так и для привлечения дополнительных ресурсов организма. Для привлечения внешних ресурсов применяется (известны) два способа связи: во-первых, презентация на мембране клетки активных сигнальных молекул, во-вторых, отправка сообщений путем экспрессии цитокинов.
Алгоритм контроля целостности клетки, если он выполняется внутри клетки, может быть простым, основанным на контроле целостности кода ДНК.
Запуск специфического
иммунного ответа
Пусковым моментом для
включения
специфического иммунного ответа организма является взаимодействие Т-хелпера с
антигенпрезентирующей клеткой (АПК ), на поверхности которой присутствует
антигенный пептид, комплексированный с молекулой МНС II класса. Более того,
инициатива АПК проявляется отправкой сообщения-цитокина ИЛ-2, которого с
нетерпением ждет ближайший лимфоцит, чтобы опробовать свой рецептор в качестве
“ключа” к “замку” антигенного пептида
(эпитопа).
< АПК >&< молекула МНС II >&<антиген> à(ИЛ-2)à < Th0 >
– так можно описать встречу антигена с незрелым (наивным) Т-лимфоцитом [2].
Заметим, что число наивных лимфоцитов в
общей популяции составляет 50-60%. Такая встреча может привести к запуску
процесса, который, в свою очередь, приведет либо к синтезу соответствующих
антител, либо к выращиванию специфических Т-киллеров и появлению новых Т-
клеток памяти.
Возможны и другие варианты встреч антигена с лимфоцитами и каждая из них имеет свое продолжение.
В любом случае, задача иммунной системы состоит в том, чтобы клетка уличенная в нарушении целостности была разрушена, а ее обломки выведены из организма.
Иммунокомпьютинг
Иммунокомпьютинг
(ИК) представляет собой новое направление информатики, базирующееся на
принципах обработки информации молекулами белков и иммунными сетями [1]. ИК
ведет к разработке компьютера нового типа, который предложено назвать иммунокомпьютером по аналогии с
известными нейрокомпьютерами, которые аппаратно реализуют модели нейрона и
нейронной сети.
С ИК связаны три
основных инновации:
1. Новый
математический базис;
2. Новый тип
вычислений;
3. Новый тип
аппаратной реализации.
Новый математический базис сформирован в
результате анализа пространственной структуры молекул белка (рис.1.).
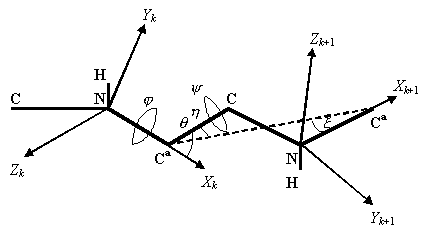
Рис.1.
Экспериментально показана
близость углов ![]() и
и ![]() (Cantor and Schimmel, 1980a), что позволяет считать
(Cantor and Schimmel, 1980a), что позволяет считать ![]() . Тогда
. Тогда
![]()
![]()
![]()
![]()
![]()
![]()
Предложено
математическое определение формального
пептида (ФП):
![]()
который включает следующие компоненты:
1.
Число
связей ![]() ;
;
2.
Множество
углов ![]()
где –p £ jk £ p, –p £ yk £ p ;
3.
Множество
кватернионов ![]() где кватернионы
где кватернионы ![]() определены формулами:
определены формулами:
![]()
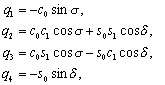
где ![]() – матрицы Паули.
– матрицы Паули.
4.
Результирующий кватернион ФП ![]() определен как:
определен как:
![]()
5.
Множество
коэффициентов ![]() ,
, ![]() ,
, ![]() .
.
Функция v (без индекса), определена
для каждого элемента ![]() следующей
квадратичной формулой:
следующей
квадратичной формулой:
![]()
Последняя функция может быть представлена в векторной-матричной форме:
![]() .
.
Формальная
B-клетка определена как
![]() ,
,
где
![]() - рецептор клетки, который является
также ФП;
- рецептор клетки, который является
также ФП;
![]() - индикатор
состояния рецептора;
- индикатор
состояния рецептора;
![]() - индикатор состояния клетки;
- индикатор состояния клетки;
![]() - индикатор мутации.
- индикатор мутации.
Формальная Т-клетка определена как
![]() ,
,
где
![]() - тип Т-клетки ;
- тип Т-клетки ;
![]() - рецепторы
Т-клетки;
- рецепторы
Т-клетки;
![]() - связанный рецептор Т-клетки;
- связанный рецептор Т-клетки;
Формальная
Иммунная Сеть
(ФИС) определена как объединение В-клеток, Т-клеток и свободных пептидов (СФП):
![]() .
.
Принципиальная
разница между ИК и другими типами вычислений происходит от функций их базовых
элементов, в соответствии с их биологическими прототипами и математическими
моделями. К примеру, если искусственный нейрон считается пороговым сумматором,
соединенным с другими строго фиксированными нейронами, то базовые принципы ИК
совсем иные. Основной принцип – это свободное связывание базовых элементов ИК (формальных протеинов) в рамках формальной иммунной сети (ФИС).
В качестве нового типа вычислений ИК предлагает
следующие новые подходы к задачам ИИ:
¨ распознавание
образов и анализ данных на основе принципов молекулярного узнавания;
¨ представление
языков и вывод решений задач на основе аналогий между словами и биомолекулами;
¨ моделирование
природных и технических систем на основе принципов взаимодействий между
биомолекулами.
Для
реальных задач исходные данные в самом общем случае являются многомерными и
допускают представление в виде массивов (векторов) вещественных и/или целых
чисел. Одной из основных особенностей ИК-алгоритма распознавания образов
является проекция произвольных данных в пространство ФИС. Такое преобразование
обладает следующими преимуществами:
¨ имеет строгое математическое обоснование в терминах
сингулярного разложения (СР) матриц;
¨ существенно снижает размерность данных (до одно- двух-
или трехмерного пространства ФИС);
¨ позволяет наглядно
представить и визуализировать любую ситуацию как точку одно- двух- или
трехмерного пространства.
Распознавание
образов
Определим
образ как n-мерный
вектор-столбец ![]() , где
, где ![]() – вещественные числа и “T” – символ матричного транспонирования.
– вещественные числа и “T” – символ матричного транспонирования.
Определим распознавание образов как отображение ![]() любого образа
любого образа ![]() в одно из целых
чисел
в одно из целых
чисел ![]() , которые представляют классы.
, которые представляют классы.
Задача распознавания образов может быть сформулирована следующим способом.
Дано:
- Число классов ![]() ;
;
- Набор из ![]() обучающих образов:
обучающих образов: ![]() ;
;
- Класс любого обучающего образа: ![]() ;
;
- Произвольный n-мерный вектор ![]() .
.
Найти:
Класс вектора ![]() :
: ![]() =?
=?
Обучение
1. Сформировать обучающую матрицу ![]() размерности
размерности ![]() .
.
2. Вычислить максимальное
сингулярное число ![]() , а также левый и правый сингулярные векторы
, а также левый и правый сингулярные векторы ![]() и
и ![]() обучающей матрицы по
следующей итеративной (эволюционной)
схеме:
обучающей матрицы по
следующей итеративной (эволюционной)
схеме:
![]() ,
,
![]() ,
, ![]() , где
, где ![]() ,
,
![]() ,
, ![]() , где
, где ![]() ,
,
![]() ,
, ![]() ,
,
до
выполнения условия ![]() ,
,
![]() ,
, ![]() ,
, ![]() .
.
3. Хранить сингулярное число ![]() .
.
4. Хранить правый сингулярный вектор ![]() (как “антитело-пробу ”).
(как “антитело-пробу ”).
5. Для всякого ![]() хранить компоненту
хранить компоненту ![]() левого сингулярного
вектора
левого сингулярного
вектора ![]() (как клетку ФИС) и класс
(как клетку ФИС) и класс ![]() соответствующий
обучающему образу
соответствующий
обучающему образу ![]() .
.
Распознавание
6. Для всякого n-
мерного образа ![]() вычислить его энергию связи с
вычислить его энергию связи с ![]() :
:
![]()
(напомним, что ![]() – это хранимое сингулярное число, а
– это хранимое сингулярное число, а ![]() – это хранимый правый сингулярный вектор обучающей матрицы
– это хранимый правый сингулярный вектор обучающей матрицы ![]() ).
).
7. Выбрать ![]() , которая имеет минимальное расстояние
, которая имеет минимальное расстояние ![]() (соответственно,
максимальное сродство
(соответственно,
максимальное сродство ![]() ) с
) с ![]() :
:
![]() ,
, ![]() .
.
8. Считать класс ![]() искомым классом
образа
искомым классом
образа ![]() .
.
Ранее этот подход успешно
применялся для расчета карты комплексной оценки в экологическом атласе
Калининграда, для предсказания риска чумы по результатам экологического и
медицинского мониторинга, для раннего обнаружения вторжений в компьютерные
сети, для оперативной оценки глобальной баллистической ситуации в околоземном
космическом пространстве и т.д. [24-54].
В работах [30,
31] показано, что в реальных задачах распознавания образов (на примерах
экологического мониторинга и лазерной физики) ИК превосходит своих основных
конкурентов (ИНС и ГА), как минимум, в 40 раз по быстродействию и в 2 раза по
безошибочности распознавания. Следует отметить, что данные результаты получены
на задачах сравнительно малой размерности (17×23×6 для экологического
атласа и 19×5 для лазерного диода). Из этих результатов также следует,
что в задачах большой размерности (напр., 51608×41, как при тестировании
программного эмулятора иммуночипа [42] для обнаружения вторжений в типовую
локальную сеть ВВС США) применение ИНС и ГА становится попросту нереальным.
Потенциальные
возможности ИК позволяют достичь такого уровня надежности, гибкости и
быстродействия вычислений, которые недоступны как для традиционных компьютеров,
так и для нейрокомпьютеров. Дальнейшее развитие ИК и его аппаратная реализация могла бы привести к следующим прорывам в
области компьютерных технологий:
¨ ИК способен
преодолеть основные недостатки нейрокомьпютеров (ложные образы, низкая емкость
памяти по отношению к размерам ИНС, невозможность локализации ошибок и т.п.).
За счет этого ИК становится единственным кандидатом для широкого применения в
тех областях, где ошибки слишком дорого стоят (напр., управление космическими
аппаратами, самолетами, кораблями, подводными лодками, а также системы
безопасности, медицина и т.п.).
¨ ИК обеспечивает
наиболее адекватное компьютерное моделирование иммунной системы. Даже
простейшие версии ФИС достаточно хорошо имитируют ключевые свойства иммунного
отклика и иммунной памяти, что могло бы быть очень полезно для применений ИК в
медицине (вплоть до иммунной системы человека, управляемой ИК).
¨ ИК дает
возможность системам технической диагностики обрабатывать громадные объемы
данных в режиме реального времени, обеспечивая при этом надлежащее обнаружение
и предсказание ошибок и критических ситуаций на космических кораблях,
самолетах, атомных станциях и в экологических системах.
¨ ИК может
способствовать развитию области информационной безопасности за счет обеспечения
математически строгого базиса для разработки самообучающихся систем безопасности,
способных противостоять заранее неизвестным вторжениям (вирусам,
неавторизованным пользователям и т.п.) и обеспечить программно-аппаратную
реализацию таких систем.
¨ ИК способен
значительно улучшить надежность и гибкость поведения автономно управляемых
мобильных объектов (роботов и др.) в непредсказуемых ситуациях.
¨ ИК может
улучшить анализ финансовой безопасности путем обнаружения малых отклонений от
нормального поведения в громадных потоках данных (биржевых трендов, подделок
кредитных карт, закладных и пр.).
Приоритет в разработке
иммунокомпьютинга как нового типа вычислений на базе принципов обработки
информации молекулами белков и иммунными сетями принадлежит России. Понятия
иммуночип и иммунокомпьютер как новые типы вычислительных систем также впервые
предложены русскими учеными (по аналогии с известными нейрочипами и
нейрокомпьютерами). На мировом уровне этот приоритет признан и подтвержден
публикациями многих статей, а также официальным участием в ряде международных
исследовательских проектов Еврокомиссии, Европейского бюро аэрокосмических
исследований (EOARD) и ВВС США (AFRL).
В России теорией и практикой
иммуннокомпьютинга и иммунокомпьютерами занимается Тараканов Александр
Олегович (д-р физ.-мат. наук /Санкт-Петербургский институт информатики и
автоматизации РАН (СПИИРАН)).
Заключение
Иммунокомпьютинг призван собрать и объединить следующие
количественные характеристики иммунной системы:
¨ Параметры и топологию
пространства иммунитета, т.е. свойства ограниченного 3-х мерного пространства,
в котором иммунная система выполняет функции обнаружения и ликвидации
вторжений.
¨ Параметры и информационные
свойства поверхностей вторжений: от кожного покрова до цитоплазматических
мембран.
¨ Параметры распределения,
информационные и динамические характеристики фагоцитов – основных клеточных
неспецифических агентов в пространстве
иммунитета.
¨ Параметры распределения,
информационные и динамические характеристики системы комплементы – основных
белковых неспецифических агентов в пространстве иммунитета.
¨ Параметры и топологию
вложенной системы информационных каналов – модель систем лимфо и кровообращения
в пространстве иммунитета.
¨ Информационные
характеристики и топологию вложенной костной системы – источника
предшественников лейкоцитов (фагоцитов и лимфоцитов) в пространстве иммунитета.
¨ Параметры распределения,
типологию, информационные и динамические характеристики Т-лимфоцитов в
пространстве иммунитета.
¨ Информационные
характеристики и алгоритмы формирования специфических рецепторов Т-лимфоцитов в
пространстве иммунитета.
¨ Параметры распределения,
типологию, информационные и динамические характеристики В-лимфоцитов в
пространстве иммунитета.
¨ Информационные
характеристики рецепторов В-лимфоцитов, алгоритмы формирования специфических
рецепторов В-лимфоцитов и синтеза антител (иммуноглобулинов).
¨ Параметры распределения,
информационные и динамические характеристики иммунных комплексов
(антиген+антитело) в пространстве иммунитета.
¨ Параметры распределения,
информационные и динамические характеристики сети цитокинов, регуляторов
иммунной активности в пространстве иммунитета.
Решение (количественные оценки и алгоритмы) указанных проблем биологии и медицины неизбежно приведет к созданию принципиально новых вычислителей: иммуночипов и иммунокомпьютеров.
ЛИТЕРАТУРА
1. Tarakanov A. O., Skormin V. A.,
Sokolova S. P. Immunocomputing: Principles and Applications. New
York.: Springer, 2003, 230 р.
2.
Блюм В.С., Заболотский В.П. Особенности обеспечения
информационной безопасности в биологических системах. Труды конференции
«Информационная безопасность регионов России», СПб., 2005. C 71-77.
3.
Блюм В. С.
Роль динамической иерархии замкнутых информационных каналов в обеспечении
информационной безопасности
биологических систем // V Санкт-Петербургская межрегиональная конференция «ИНФОРМАЦИОННАЯ БЕЗОПАСНОСТЬ
РЕГИОНОВ РОССИИ (ИБРР–2007)». Материалы конференции – СПб., 2007. С
24-33.
4.
Блюм В. С.,
Заболотский В. П. Конструирование моделей
биологических мембран для 3-мерного симулятора иммунной системы // Первая
Международная Конференция «Математическая биология и биоинформатика» — Пущино,
2006.
5.
Абелев
Г.И. Основы иммунитета // Соросовский Образовательный Журнал. 1996. N 5.
с. 4–10.
6.
Иммунология.
Под ред. У. Пола. М.: Мир, 1988. Т. 1-3.
7.
Хаитов
Р.М., Игнатьева Г.А., Сидорович И.Г., Иммунология. – М., Медицина, 2000.
8.
Клиническая
иммунология и аллергология Под ред. Г. Лолора-младшего, Т.Фишера, Д.Адельмана.
Пер. с англ. – М., Практика, 2000, -806 с.
9.
Ярилин
А.А. Основы иммунологии. – М., Медицина, 1999.
10.
Галактионов
В.Г. Графические модели в иммунологии. М.: Медицина, 1986.
11. Зарецкая Ю.М., Хамагонова
Е.Г., Губарев М.И. Иммунология и иммуногенетика человека, Триада, Москва, 2002.
128 c.
12. Peakman M. and Vergani D. Basic and clinical immunology. NY: Churchill
Livingstone, 1997. – 338 p.
13.
Janeway Ch., Travers P. Immunobiology. 3 ed.
Curr. Biol. Ltd.,
1997.
14.
Новиков Д.К. Медицинская иммунология. ВГМУ; 1998.
15. Кудрявцев И.В., Полевщиков
А.В. ЭВОЛЮЦИЯ КАСКАДА КОМПЛЕМЕНТА: РАННИЕ ЭТАПЫ // Цитокины и воспаление. 2005.
Т. 4, № 1. С. 11-21.
16. Logic (ISMVL '97).
17. Tang, T, Proceedings of the 27th International Symposium on
Multiple-Valued.
18.
Ройт
А. Основы иммунологии (пер. с англ.). М.: Мир, 1991. 328 с.
19.
Кетлинский
С.А., Симбирцев А.С., Воробьев А.А. Эндогенные иммуномодуляторы. СПб.:
Гиппократ, 1992. 256 с.
20.
Фрейдлин
И.С. Система мононуклеарных фагоцитов. М.: Медицина, 1984. 272 с.
21.
Маянский
А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге. Новосибирск: Наука, 1989.
340 с.
22.
Албертс
Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология
клетки. М.: Мир, 1994. Т. 2. С. 287 - 301.
23.
Молекулярная
биология. Структура и биосинтез нуклеиновых кислот / Под ред. акад. А.С.
Спирина. М.: Высшая школа, 1990. С. 44 - 73.
24.
Льюин
Б. Гены. М.: Мир, 1987. С. 396 - 431.
25.
Соколова
С.П. и др. (ред. Тараканов А.О.) Интеллектуальные системы охраны. Алматы,
Академия МВД РК, 2000.
26.
Kuznetsov V.I., Milyaev V.B., Tarakanov A.O. Mathematical Basis of Complex Ecological
Evaluation. St.
Petersburg University Press, 1999.
27.
Кузнецов
В.И., Миляев В.Б., Тараканов А.О. Математический
аппарат комплексной экологической оценки. СПб, Северо-балтийский
экологический фонд, 1998.
28.
Тараканов
А.О., Туманов М.В. (ред. Р.М.Юсупов). Современные
математические методы комплексного оценивания здоровья. СПб, СПИИРАН, 1998.
29.
Тараканов
А.О. Математические модели ключевых
молекулярно-биологических механизмов обработки информации. СПб, СПИИРАН,
1998.
30.
Кузнецов
В. И., Губанов А. Ф., Кузнецов В. В., Тараканов А. О., Чертов О. Г. Карта
комплексной оценки состояния окружающей среды г. Калининграда. Калининград: Экологический атлас. СПб,
Мониторинг, 1999 (11 карт).
31. Tarakanov A.O., Tarakanov Y.A. A comparison of immune and genetic
algorithms for two real-life tasks of pattern recognition. Int. J. of Unconventional Computing (in press).
32. Tarakanov A.O., Tarakanov Y.A. A comparison of immune and neural
computing for two real-life tasks of pattern recognition. Lecture Notes in Computer Science, 2004, 3239, 236-249.
33. Goncharova L.B., Melnikov Y., Tarakanov A.O. Biomolecular
immunocomputing. Lecture Notes in Computer Science, 2003, 2787, 102-110.
34. Atreas N.D., Karanikas C.G., Tarakanov A.O. Signal processing by an
immune type tree transform. Lecture Notes in Computer Science, 2003,
2787, 111-119.
35. Sokolova L.A. Index design by immunocomputing. Lecture Notes in
Computer Science, 2003, 2787, 120-127.
36. Melnikov Y., Tarakanov A. Immunocomputing model of intrusion detection. Lecture
Notes in Computer Science, 2003, 2776, 453-456.
37. Tarakanov, A.O. Spatial formal immune network. Lecture Notes in Computer Science, 2003, 2723, 248-249.
38.
Соколова Л. А. Индекс риска чумы по иммунокомпьютингу.
Труды СПИИРАН, 2003, 1(3), 137-141.
39. Tarakanov A., Adamatzky A. Virtual clothing in hybrid cellular automata.
Kybernetes (Int. J. of Systems &
Cybernetics), 2002, 31 (7/8), 1059-1072.
40. Tarakanov A., Penev G., Madani K. Formal neuro-immune network. Advances
in Soft Computing: Neural Networks and Soft Computing. Physica-Verlag,
Berlin, 2002, 644-649.
41. Tarakanov A., Goncharova L., Gupalova T., Kvachev S., Sukhorukov A.
Immunocomputing for bioarrays. 1st Int. Conf. on Artificial Immune Systems
(ICARIS-2002). Univ. of Kent at Canterbury, UK, September 9-11, 2002, 32-40.
42. Sokolova S. P., Sokolova L. A.
Immunocomputing for complex interval objects. 1st Int. Conf. on Artificial
Immune Systems (ICARIS-2002). 2002, 222-230.
43. Tarakanov A., Dasgupta D. An immunochip architecture and its emulation. NASA/DoD Conf. on Evolvable Hardware
(EH-2002). Alexandria, Virginia, July 15-18, 2002, 261-265.
44. Tarakanov A., Skormin V. Pattern recognition by immunocomputing. World
Congress on Computational Intelligence,
CEC-2002. Honolulu, Hawaii, May 12-17, 2002, 1, 938-943.
45.
Тараканов
А.О., Гончарова Л.Б. Иммунокомпьютинг – биочип – биокомпьютер. Труды СПИИРАН, 2002, 1(2), 92-104.
46. Tarakanov A.O. Information security with formal immune networks. Lecture Notes in Computer Science, 2001,
2052, 115-126.
47. Skormin V.A., Delgado-Frias J.G., McGee D.L., Giordano J.V., Popyack
L.J., Gorodetski V.I., Tarakanov A.O. BASIS: a biological approach to system
information security. Lecture Notes in
Computer Science, 2001, 2052, 127-142.
48. Tarakanov A., Dasgupta D. A formal model of an artificial immune system.
BioSystems (Int. J. of Biological and
Information Processing Sciences), 2000, 55(1-3), 151-158.
49. Тараканов А.О. Возможности
использования иммунокомпьютеров для управления роботами. 1-я междунар. конф. по мехатронике и робототехнике (МиР'2000). СПб, 2000, 2, 314-318.
50. Tarakanov A., Sokolova S., Abramov B., Aikimbayev A. Immunocomputing of
the natural plague foci. Genetic and
Evolutionary Computation Conference (GECCO-2000), Workshop on Artificial Immune
Systems. Las Vegas, Nevada, July 8, 2000, 38-41.
51. Tarakanov A.O. Formal peptide as a basic agent of immune networks: from
natural prototype to mathematical theory and applications. 1st Int. Workshop of Central and Eastern Europe on Multi-Agent Systems
(CEEMAS’99). St. Petersburg, Russia, June 1-4, 1999, 281-292.
52. Tarakanov A.O. Complex ecologic evaluation by mathematical model of
molecular recognition. Int. Workshop
Tools for Mathematical Modeling (MATHTOOLS’97). St. Petersburg, Russia,
1998, 62-67.
53.
Тараканов
А.О. Метод расчета комплексной экологической оценки. Комплексная оценка экологической ситуации (ред. Миляев В.Б.,
Кузнецов В.И.). СПб, НИИ Атмосфера, 1998, 119-126.
54.
Тараканов
А.О. Формальные иммунные сети: математическая теория и технология
искусственного интеллекта. Теоретические
основы и прикладные задачи интеллектуальных информационных технологий (ред.
Юсупов Р.М.). СПб, СПИИРАН, 1998, 65-70.
55.
Тараканов
А.О. Математические модели биомолекулярной обработки информации: формальный
пептид вместо формального нейрона. Проблемы
информатизации, 1998, 1, 46-51.
Immune system and immunocomputing
Blum V. S.,
Zabolotski V.P.
Immune system one of few biological systems
having abilities of "intellectual" processing of the information. In the present review modern representations about structure, structure
and the basic functions of immune system are given.
Computing abilities of immune system are investigated within the framework of
the new scientific and technical direction named immunocomputing. In the review mathematical bases immunocomputing are given and primary goals of the given direction of
researches are formulated. — Bibl. 54 items.
Key
words: Immune
system, immunocomputing.
Россия, С-Петербург,
Санкт-Петербургский институт информатики и
автоматизации РАН
СПИИРАН, 14-я линия ВО, д. 39, Санкт-Петербург, 199178
1<vlad@blum.spb.su>,2<lai@iias.spb.su>
Поступила в редакцию 13.12.2007.
|
№ |
Фамилия Имя Отчество автора
(полностью) |
Должность (сокращённо) |
Ученая степень |
Ученое звание |
Организация (сокращённо) |
|
1 |
Заболотский Вадим Петрович |
в.н.с. |
д.т.н. |
проф. |
СПИИРАН |
|
2 |
Блюм Владислав Станиславович |
с.н.с. |
к.т.н. |
с.н.с. |
СПИИРАН |