На правах рукописи

КУРОТЧЕНКО Людмила Владимировна
СИСТЕМНЫЙ АНАЛИЗ СОЧЕТАННОГО ВОЗДЕЙСТВИЯ ЭЛЕКТРОМАГНИТНОГО ИЗУЧЕНИЯ
КРАЙНЕ ВЫСОКОЙ ЧАСТОТЫ И НЕФРОТОКСИЧНЫХ ПРЕПАРАТОВ НА БИОЛОГИЧЕСКИЕ ОБЪЕКТЫ
(экспериментальное исследование)
05.13.01 – Системный анализ, управление и
обработка информации
(медицинские науки)
АВТОРЕФЕРАТ
диссертации на соискание
ученой степени
кандидата медицинских наук
Тула 2008
Работа
выполнена на кафедре медико-биологических дисциплин медицинского института ГОУ
ВПО “Тульский государственный университет”.
Научный
руководитель: доктор медицинских
наук, профессор
СУББОТИНА
ТАТЬЯНА ИГОРЕВНА
Официальные
оппоненты: доктор
медицинских наук, профессор
ЖУРАВЛЕВ
БОРИС ВАСИЛЬЕВИЧ
доктор медицинских наук, профессор
ЗАРУБИНА
ТАТЬЯНА ВАСИЛЬЕВНА
Ведущая
организация: ГОУ ВПО “Московская медицинская
академия
им. И.М. Сеченова Росздрава”
Защита состоится 5 ноября 2008 г. в 12 часов на заседании диссертационного совета Д 212.271.06 при ГОУ ВПО "Тульский государственный университет" по адресу: 300600, г. Тула, пр. Ленина, 92, корп. 9, ауд. 101.
С диссертацией можно ознакомиться в
библиотеке ГОУ ВПО "Тульский государственный университет" по адресу:
300600, г. Тула, пр. Ленина, 92.
Автореферат разослан 4 октября 2008 г.

Ученый секретарь диссертационного совета
доктор медицинских наук, профессор О.Н. Борисова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Актуальность исследования обусловлена необходимостью
изучения специфики воздействия внешних электромагнитных полей миллиметрового
диапазона на живые организмы в сочетании с другими экзогенными и эндогенными
факторами, вызывающими формирование патологических морфо-функциональных
изменений. Широкое внедрение на производстве и в бытовых условиях технических
средств, являющихся источником электромагнитного излучения миллиметрового
диапазона, обусловило распространение неконтролируемого контакта с
электромагнитным излучением крайне высокой частоты (ЭМИ КВЧ) людей различных
возрастных категорий, в том числе, страдающих различными острыми либо
хроническими заболеваниями и принимающих лекарственные препараты, которые
обладают побочными эффектами, а также подвергающиеся негативному воздействию
прочих экзогенных либо эндогенных факторов. Создателями современной
магнитобиологии и терапии электромагнитным излучением крайне высокой и
сверхвысокой частоты (ЭМИ КВЧ и СВЧ) являются такие известные ученые, как Н.К.
Чемерис, 1989-2008; О.В. Бецкий, 1991-2008; Н.Д. Девятков, 1981-1994; Е.Е.
Фесенко, 1986-2008; А.А. Яшин, 1992-2008; L. Furia, 1984-1996; W.R. Adey, 1975-1989 и многие другие.
Исследования
в области взаимодействия ЭМИ КВЧ с живыми организмами свидетельствуют о том,
что ЭМИ КВЧ, как самостоятельный фактор может приводить к формированию
процессов крайне противоположных по своей биологической значимости.
Зарегистрировано формирование как реакций компенсации и адаптации, направленных
на восстановление структуры и функции, и, соответственно, обладающих
саногенными эффектами, так и крайне тяжелых необратимых реакций повреждения,
ведущих к гибели организма. Неоднозначность ответных реакций организма на
воздействие ЭМИ КВЧ определяется физическими параметрами излучения, но
очевидно, что развитие конкретной ответной реакции организма во многом
определяется его индивидуальными особенностями, в том числе наличием
предшествующих патологических процессов на уровне различных органов и систем. В
связи с чем актуальным является изучение реакции организма при воздействии ЭМИ
КВЧ на фоне формирования патологического процесса, вызванного другими факторами
с известными механизмами повреждающего действия, и исследование возможности
развития таких негативных последствий как формирование резистентности
патологического процесса к проводимой терапии, усиление побочных эффектов,
вызванных лекарственными препаратами и как следствие, прогрессирование
заболевания.
Актуальность
исследования сочетанного воздействия на организм ЭМИ КВЧ и гентамицина
объясняется тем, что данный антибиотик широко применяется в медицинской
практике для лечения острых и хронических воспалительных процессов различной
этиологии и одновременно обладает выраженным нефротоксичным эффектом. Исследования
реакции организма и динамики патологического процесса при сочетанном
воздействии ЭМИ КВЧ и антибиотиков, в том числе гентамицина, до настоящего
времени не проводились. Таким образом,
изучение реакции организма при сочетанном воздействии ЭМИ КВЧ и антибиотиков,
вызывающих негативные побочные эффекты, является актуальным, позволяющим
выработать обоснованные подходы к прогнозированию развития патологических
процессов, тактики лечения и предотвращения возможных ранних и отдаленных
осложнений и побочных эффектов сочетанной лекарственной терапии и физиотерапии.
Цель исследования. Целью исследования является системный анализ
закономерностей развития морфофункциональных изменений в эксперименте на
животных при сочетанном воздействии ЭМИ КВЧ и нефротоксичного антибиотика
гентамицина, а также их гармоничного соотношения.
Задачи
исследования:
1.
Выявить морфологические и функциональные показатели, отражающие состояние почек
у лабораторных животных при сочетанном воздействии ЭМИ КВЧ и нефротоксичного препарата
гентамицина в сравнении с морфофункциональными эффектами, обусловленными изолированным воздействием ЭМИ КВЧ и
гентамицина.
2.
Провести сравнительный анализ тяжести морфо-функциональных изменений,
отражающих состояние почек при изолированном и сочетанном воздействии ЭМИ КВЧ и
гентамицина.
3.
Использовать правило “золотого сечения” для выявления особенностей и
закономерностей развития патологических процессов на системном уровне.
4.
Исследовать относительную энтропию основных морфометрических признаков и
установить близость полученных значений энтропии к “золотым” соотношениям, как
показателям стремления к норме.
5. Провести факторный, корреляционный и
регрессионный анализ результатов морфометрических и функциональных
исследований. Разработать математические
модели, отражающие достоверность полученных результатов и позволяющих
прогнозировать последствия сочетанного воздействия ЭМИ КВЧ и нефротоксических
препаратов на функцию почек, а также
изолированного воздействия одного из названных факторов.
Основные положения, выносимые на защиту:
1.
Сочетанное воздействие ЭМИ КВЧ и гентамицина характеризуется усилением
нефротоксического эффекта.
2.
Морфофункциональные изменения почек характеризуются сочетанием взаимозависимых
патологических процессов типичных как для изолированного воздействия ЭМИ КВЧ,
так и нефротоксических эффектов гентамицина.
3.
Динамика тяжести морфофункциональных изменений почек зависит от суммарного
времени воздействия ЭМИ КВЧ и дозы гентамицина.
4.
Правило золотого сечения отражает реакцию организма на повреждающее воздействие
и позволяет выявить основные закономерности течения патологических процессов
как при сочетанном, так и при унитарном воздействии факторов ЭМИ КВЧ и
гентамицина.
Научная новизна:
1.
Достоверно выявлены особенности морфофункциональных изменений в тканях почек
лабораторных животных при сочетанном воздействии ЭМИ КВЧ и нефротоксических
препаратов
2.
Впервые применено правило “золотого сечения”, установлены особенности
соблюдения данного правила в развитии
патологического процесса при сочетанном
и изолированном воздействии повреждающих факторов.
3.
При помощи факторного, корреляционного и регрессионного анализа
систематизирована в динамике тяжесть морфофункциональных изменений при
сочетанном воздействии ЭМИ КВЧ и нефротоксических препаратов.
4.
Построены регрессионные модели высокой прогнозной точности, позволяющие
прогнозировать течение патологических процессов в почках млекопитающих при
длительном воздействии повреждающих факторов.
Научно-практическая значимость работы. Научно-практическая значимость работы заключается в
том, что полученные результаты экспериментальных исследований являются основой
для выработки новых подходов к проблеме
сочетанного воздействия на организм человека ЭМИ КВЧ и гентамицина. В экспериментах
на животных выявлены эффекты, результаты которых являются основанием для
теоретических выводов и практических рекомендаций о сочетанном воздействии ЭМИ
КВЧ и гентамицина на функцию почек. Использование математических методов, таких
как факторный и регрессионный анализ, правило «золотого сечения», обработки результатов позволяют строить
прогностические модели для оценки степени развития компенсаторных механизмов и
прогнозирования формирования необратимых патологических процессов.
Публикации. По теме диссертации опубликовано 8 печатных работ, из
них 3 в ведущем рецензируемом журнале, рекомендованном ВАК России, 2 монографии.
Апробация
работы. Основные результаты
диссертационной работы докладывались и обсуждались на конференциях:
-
первая Всероссийская университетская научно-практическая конференция молодых
ученых и студентов по медицине (Тула,2003 г).
-
XI международный симпозиум «Эколого-физиологические
проблемы адаптации» (Москва, 2003 г).
-
межрегиональная научно-техническая конференция «Интеллектуальные и
информационные системы» (Тула,2004).
-
XX любищевские чтения «Современные проблемы эволюции»
(Ульяновск,2006г).
-
международная научная конференция «Излучение и рассеяние электромагнитных волн»
ИРЭМВ-2007 (Таганрог, 2007 г).
-
первый международный экологический конгресс (Третья международная
научно-техническая конференция) ELPIT-2007
(Тольятти, 2007 г).
-
вторая магистерская научно-техническая конференция (Тула, 2007)
-
третья магистерская научно-техническая конференция (Тула, 2008)
Внедрение результатов работы. Результаты исследования внедрены в учебный процесс
кафедры морфологии и физиологии человека Тульского государственного
педагогического университета им. Л.Н. Толстого, кафедры МБД медицинского факультета ГОУ ВПО “Тульский
государственный университет”, в учебный процесс и научно-исследовательскую
работу Волгоградского государственного университета, в практику научной работы
ГУП “Исток” (Фрязино) и НИИ Новых медицинских технологий (г. Тула), Курского
государственного технического университета, кафедр ИИБМТ и БМПЭ Рязанского
государственного радиотехнического университета.
Личный вклад автора заключается в разработке задач исследования,
проведения литературного обзора и анализа основных биологических эффектов,
которые вызывает ЭМИ КВЧ у различных
организмов, разработке методик сочетанного и изолированного воздействия,
постановке экспериментов и статистической обработке результатов исследования.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования
Для
изучения сочетанного воздействия крайневысокочастотного излучения в качестве
биологических объектов были выбраны лабораторные крысы линии Wistar.
Методы исследования
Для проведения экспериментальных исследований использовались крысы линии Wistar обоих полов одного возраста, из которых случайным образом было сформировано четыре группы. Три группы крыс были экспериментальными, а четвертая – контрольная. В каждой экспериментальной группе проводилось три серии экспериментов. В качестве контроля использовались интактные крысы, не подвергавшиеся экспериментальным воздействиям и находившиеся в прочих равных с экспериментальными группами стандартных условиях содержания в виварии. Нефротоксичный эффект в опытных группах достигался путем внутримышечного введения антибиотика гентамицина.
Крысам
первой экспериментальной группы внутримышечно вводили гентамицин в дозировке
0,3 мл 1 раз в неделю на протяжении трех недель. Кроме того, крысы подвергались воздействию КВЧ-излучения с
частотой 37 ГГц и мощностью менее 0,1 мВт/см2 при разовой экспозиции
30 минут по 3 раза в неделю на
протяжении трех недель. Таким образом, экспозиция ЭМИ КВЧ в течение недели
составила 90 минут, а суммарная экспозиция по прошествии трех недель
эксперимента составила 270 минут.
Крысы
второй экспериментальной группы подвергались КВЧ-излучению частотой 37 ГГц той
же мощности при разовой экспозиции 30 минут по 3 раза в неделю без введения гентамицина. Недельная
экспозиция также составила 90 минут, а суммарное время экспозиции за три недели
– 270 минут.
Крысам
третьей экспериментальной группы вводили
гентамицин в дозировке 0,3 мл 1 раз в неделю без воздействия
КВЧ-излучения.
До
проведения воздействия факторов у всех экспериментальных групп и контрольной
группы, а также через каждые 7 дней
эксперимента у всех крыс проводили забор крови для исследования содержания
гемоглобина и креатинина. Исследование содержания гемоглобина обосновано тем,
что изменение данного показателя является универсальным критерием, отражающим
как развитие патологических изменений в почках, так и общее воздействие воздействия КВЧ-излучения на организм. В
этот же день из каждой экспериментальной группы случайным образом выбирали по
одной крысе с целью взятия материала почки для патоморфологического
исследования.
Забор
материала осуществлялся методом секционной биопсии. Усыпление животных
осуществлялось путем внутримышечного введения 0,1 мл 2% дитилина. Материал
фиксировался в 10% формалине с последующей проводкой и заливкой в парафиновые
блоки по стандартной методике. Препараты окрашивались гематоксилином и эозином.
Исследование проводилось при увеличении от 10x15 до 40x15.
Снимки
микропрепаратов были получены на микроскопе Nikon Eclipse
E-400. Площадь участков ткани на снимках
варьировалась от 460 x 370 мкм при увеличении 10x15 до 115 x 92,5мкм
при увеличении 40x15.
Морфометрические данные получены по методике Г.Г.
Автандилова. Площадь клеточных структур почки определялась на двадцатикратном
увеличении объектива, при этом площадь фотографируемых участков ткани составила
230 x 185 мкм. Были получены изображения с разрешением 700 x 565 пикселей. Для морфометрического исследования шаг
сетки Автандилова выбирался равным 10 пикселям, что соответствовало площади
одной клетки сетки Автандилова 10,8 мкм2.
Определение
содержания креатинина в крови крыс линии Wistar проводилось
при помощи набора реактивов CREAT 100,
выпускаемых фирмой PLIVA – Lachema a.s. по
методике, описанной в инструкции.
Определение
содержания креатинина в моче крыс также осуществляли при помощи набора
реактивов CREAT 100 по методике,
описанной в инструкции.
Определение
содержания гемоглобина проводилось с помощью стандартного унифицированного
гемиглобинцианидного метода (1974), основанного на окислении гемоглобина в
метгемоглобин железосинеродистым калием с образованием окрашенного цианметгемоглобина, содержание
которого определяли колориметрически при помощи фотоэлектроколориметра.
Методы математической обработки
результатов
Для
математической обработки и анализа результатов биохимических и морфометрических
исследований в работе использовались методы математической статистики, такие,
как факторный и корреляционный анализы, а также составлялись уравнения
множественной регрессии, которые позволяют предсказывать значения одного из
показателей по ряду других показателей. По найденным уравнениям множественной
регрессии были построены поверхности регрессии. Расчеты производились в
системах MathCAD 2000 Professional и Statistica 6.0 for Windows. При
оценке статистических гипотез работе принимались следующие уровни значимости: p = 0,05; p = 0,01.
Также применяли правило “золотого сечения”, находили вурфы и сравнивали
полученные значения с “золотым” вурфом для оценки нормы и патологии, а также находили значение относительной
энтропии.
РЕЗУЛЬТАТЫ
ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Результаты исследования
крыс контрольной группы
Морфологическое
исследование ткани почек у крыс контрольной группы показало, что структура
паренхимы почек не изменена (рис. 1).
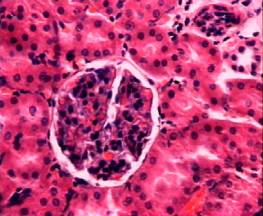
Рис. 1. Фотография микропрепарата почки крысы из контрольной
группы. Увеличение 20 x 15.
Почечные
клубочки с четкими границами, имелось умеренное полнокровие сосудистых петель.
Капсулы Шумлянского без патологических изменений. Структура дистальных и
проксимальных почечных канальцев сохранена. Эпителиальные клетки не изменены. Ядра
эпителиальных клеток имеют четкие границы. В просвете дистальных и
проксимальных почечных канальцев содержимое отсутствует. Заключение:
гистологическая картина почки у крыс контрольной группы в норме.
Далее
были проведены функциональные исследования. Исследовалось содержание креатинина
в крови и моче животных, рассчитывались значения клиренса креатинина, а также
определялось содержание гемоглобина в крови. Все найденные показатели
соответствовали норме.
В
результате корреляционного анализа основных морфологических показателей
почечных канальцев в почках крыс контрольной группы было установлено, что
парные линейные коэффициенты корреляции между этими показателями были очень
высокими и изменялись в диапазоне от 0,8 до 0,95.
Проведенный
регрессионный анализ позволил найти уравнения регрессии исследуемых показателей
и построить поверхности регрессии. Регрессионная модель зависимости площади
ядер JADRO от площади цитоплазмы SITOPLAZ, площади полости POLOST и количества ядер COLVJADR была
получена в следующем виде:
JADRO=-2,15227+0,142930*SITOPLAZ+0,231614*POLOST+1,126351*COLVJADR (1)
Коэффициент
детерминации для данной модели равен 0,84679,
что указывает на её высокую точность. Коэффициент корреляции, равный 0,92021
(p<0,00001), указывает на наличие сильной зависимости площади
ядер от перечисленных выше показателей.
Высокую
точность также даёт уравнение регрессии, описывающее зависимость площади ядер
от площади полости и количества ядер:
JADRO = -8,39538 + 0,489499*POLOST + 2,734135*COLVJADR (2)
Поверхность
регрессии, построенная по данному уравнению, представлена на рис. 2.
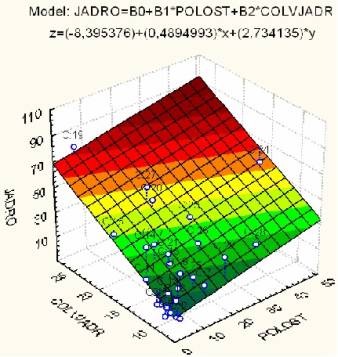
Рис. 2. Поверхность регрессии, описывающая прогнозный эффект
для показателя JADRO, в зависимости от площади полости и количества ядер.
Здесь
коэффициент корреляции немного ниже, чем для предыдущего уравнения регрессии R=0,86519 (p<0,00001).
Доля «объяснённой» дисперсии составляет 74,856%,
что также указывает на высокую точность модели.
Более
точной является регрессионная модель зависимости площади ядер от площади
цитоплазмы и площади полости:
JADRO = 4,849889 + 0,206856*SITOPLAZ + 0,165128*POLOST (3)
Множественный
коэффициент корреляции между такими показателями, как площадь ядер, площадь
цитоплазмы и площадь полости, равен R=0,90333 (p<0,00001), а доля
«объяснённой» дисперсии составляет 81,601%.
Также
было получено уравнение регрессии, выражающее значение площади цитоплазмы SITOPLAZ
через площадь полости POLOST и количество ядер COLVJADR:
SITOPLAZ = -43,6793 + 1,804269*POLOST + 11,24872*COLVJADR (4)
Эта
модель обладает высокой прогнозной точностью. Коэффициент детерминации для неё
составляет 0,71673, а множественный
коэффициент корреляции равен R=0,84660 (p<0,00001).
Анализ соотношений между гемоглобином и
креатинином с позиций «золотого сечения» в крови крыс контрольной группы
показал, что пропорциональные соотношения между этими показателями составили
соответственно 0,74 и 0,26, что достаточно
далеко от классической «золотой пропорции» (0,618 и 0,382). Таким образом, в данном случае, «золотое
сечение» выступает не как показатель нормы, а как показатель стремления системы
к норме, то есть аварийного регулирования системы.
Сравнивая соотношения между
площадью полости, площадью ядер и площадью нормальной цитоплазмы, приходим к выводу, что
«золотое сечение» встречается здесь неоднократно. Во-первых, отношение площади нормальной цитоплазмы к сумме
площади ядер и площади нормальной
цитоплазмы равно 0,594, что очень близко к «золотому сечению» (0,618). В
свою очередь, отношение площади полости к сумме площади полости и площади ядер
равно 0,588, что также близко к «золотой» пропорции. Во-вторых,
отношение площади полости к сумме площадей полости, ядер и нормальной
цитоплазмы равно 0,367, а отношение
площади нормальной цитоплазмы к сумме площадей полости, ядер и нормальной
цитоплазмы равно 0,376. Эти значения также очень близко к «золотой пропорции» (0,618 к 0,382).
Таким образом, в норме площадь полости, площадь нормальной цитоплазмы и площадь ядер образуют гармоническое
соотношение. По результатам
исследования можно сделать следующий вывод: классическое «золотое сечение» для морфометрических показателей ткани
почек является характеристикой нормы и проявляется в контрольной группе
во всех основных пропорциональных соотношениях этих показателей.
Значение относительной
энтропии для основных морфометрических признаков почек в контрольной группе животных составило
0,674, что также близко к классическому
золотому сечению 0,618.
Результаты исследования крыс при
сочетанном воздействии ЭМИ КВЧ и гентамицина
Исследование в динамике структурных изменений в ткани почек у крыс,
подвергшихся сочетанному воздействию ЭМИ КВЧ и гентамицина, позволила выявить
динамику морфологических изменений через семь суток от начала эксперимента при
суммарном времени воздействия ЭМИ КВЧ 90 минут и исходной введенной дозе
гентамицина 0,3 мл (рис. 3, а).
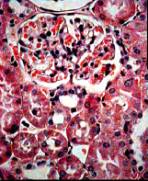
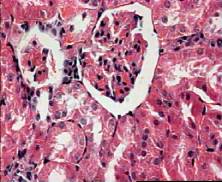
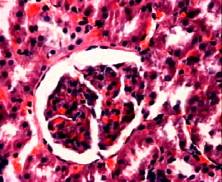
а) 1 неделя б) 2
недели в) 3 недели
Рис. 3. Фотографии микропрепаратов
почек крыс из группы 1 (сочетанное воздействие ЭМИ КВЧ и гентамицина) при
различной длительности эксперимента. Увеличение 20 x 15.
В ткани почек формировалась гипертрофия
клубочков, капиллярные петли расширены, полнокровны, наблюдаются фокальные
некрозы клубочков. Гистологическая структура канальцев сохранена, в эпителии
канальцев формируется очаговая зернистая и гидропическая дистрофия.
Некрозы канальциевого эпителия
отсутствуют. Фотография микропрепарата почки крысы, подверженной сочетанному воздействию ЭМИ
КВЧ и гентамицина на первой неделе эксперимента приведена на рис.
На четырнадцатые сутки от начала
эксперимента, при суммарном времени облучения 180 минут и введенной дозе
гентамицина 0,6 мл наблюдалось прогрессирование патологических изменений в
ткани почек (рис. 3, б).
Патоморфологические изменения характеризовались прогрессирующими
некробиотическими и некротическими изменениями нефронов. Клубочки почек
уменьшены в размерах, “сморщены”. Единичные клубочки гипертрофированы.
Гипертрофия клубочков сочетается с расширением просвета канальцев, что
указывает на формирование компенсаторных морфологических процессов. Капиллярные
петли полнокровны с явлениями стаза и слайджа. Наблюдается диффузная
гидропическая дистрофия и множественные некрозы канальциевого эпителия. В
просвете канальцев содержится некротизированный эпителий и эритроциты. В
корковом слое почек формируется очаговая нейтрофильная инфильтрация. Выявленные
изменения свидетельствуют о формировании необратимых патоморфологических процессов,
сопровождающихся развитием воспалительного процесса в паренхиме почек.
На 21 сутки от начала эксперимента, при
суммарном времени воздействия ЭМИ КВЧ 270 минут и суммарной введенной дозе
гентамицина 0,9 мл, выявлены патоморфологические изменения, свидетельствующие о
формировании тотальных некробиотических и некротических изменений в нефронах
(рис. 3, в). Наблюдается диффузное сморщивание клубочков почек. Полнокровие
капилляров сочетается с развитием стаза и слайджа, множественные кровоизлияния
в просвет капсулы Шумлянского-Баумана. Канальцы почек неравномерно расширены,
эпителий некротизирован. Просвет канальцев обтюрирован отслоившимся эпителием и
эритроцитами. Множественные крупноочаговые некрозы, локализирующиеся преимущественно в корковом слое, не
позволяющие четко выделить структуру нефронов.
Выявленная динамика структурных изменений свидетельствует о том, что при заданных параметрах
экспериментального воздействия ЭМИ КВЧ и гентамицина патоморфологические
изменения в ткани почек начинают формироваться в течение первой недели от
начала эксперимента. Необратимые патоморфологические изменения появляются на
второй неделе и достигают максимума на третьей неделе от начала эксперимента.
Коэффициенты
корреляции между такими показателями, как площадь ядер, площадь нормальной
цитоплазмы, площадь полости, количество ядер, ядерно-цитоплазматический индекс
для почечных канальцев в почках крыс,
подвергавшихся комплексному воздействию ЭМИ КВЧ и гентамицином, в отличие от
аналогичных коэффициентов корреляции для контрольной группы, имели более низкие
значения, не превышавшие 0,7.
Значимыми
для данной группы являются коэффициенты корреляции между площадью полости и
площадью цитоплазмы (0,57), площадью ядер и площадью цитоплазмы (0,67). Для
этих показателей построена следующая регрессионная модель:
SITOPLAZ = -12,1560 + 5,156325*JADRO + 1,588054*POLOST (6)
Множественный
коэффициент корреляции здесь равен R=0,74100 (p<0,0008), доля «объяснённой» дисперсии составляет 54,909%, что указывает на достаточную прогнозную
точность модели.
Как
и в рассмотренных выше группах, в группе, подвергавшейся комплексному
воздействию ЭМИ КВЧ и гентамицина, был получен значимый коэффициент корреляции
для ЯЦИ и площади цитоплазмы (-0,70), что указывает на сильную линейную зависимость
между этими показателями.
Высокую
точность прогноза даёт уравнение зависимости ядерно-цитоплазматического индекса
INDEKS
от площади ядер JADRO и площади цитоплазмы SITOPLAZ:
INDEKS = 0,221137 + 0,016046*JADRO - 0,002754*SITOPLAZ (8)
Здесь множественный
коэффициент корреляции равен R=0,87005 (p<0,00001), а доля
«объяснённой» дисперсии составляет 75,698%.
Поверхность регрессии для данной модели изображена на рис. 4.
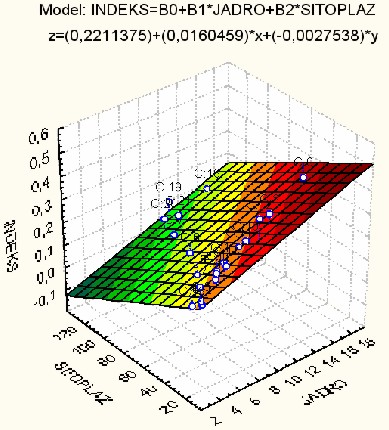
Рис. 4. Поверхность регрессии, описывающая прогнозный эффект
для показателя INDEKS, в зависимости от площади ядер и площади цитоплазмы.
В
отличие от других экспериментальных групп, в группе, подвергавшейся сочетанному
воздействию ЭМИ КВЧ и гентамицина, значимым является также коэффициент
корреляции для ЯЦИ и площади полости, который составляет -0,54. В связи с этим
получено уравнение регрессии, связывающее значения ядерно-цитоплазматического
индекса INDEKS и такие показатели, как площадь ядер JADRO,
площадь цитоплазмы SITOPLAZ и площадь полости POLOST:
INDEKS = 0,238105 + 0,016483*JADRO – 0,002445*SITOPLAZ
– 0,002701*POLOST (9)
Эта модель обладает
наибольшей прогнозной точностью по сравнению со всеми уравнениями регрессии,
составленными для ядерно-цитоплазматического индекса. Доля «объяснённой»
дисперсии для данной модели составляет 79,939%,
а множественный коэффициент корреляции равен R=0,89408 (p<0,00001).
В группе крыс,
облученных ЭМИ КВЧ в сочетании с внутримышечным введением гентамицина, отношения значений суммы гемоглобина
и креатинина не только удовлетворяют
закону «золотого сечения» для экспозиций 90, 180 и 270 минут, но и наиболее
близки к «золотым» числам 0,618 и 0,382 по
сравнению с другими группами.
Разница между приведёнными выше «золотыми» числами и полученными результатами
составляет не более 2,1%. При этом почти совпадает с «золотым» числом 0,618
отношение суммарного значения гемоглобина к сумме значений гемоглобина и
креатинина, полученной за время экспозиций 180 и 270 минут.
Изменение содержания
гемоглобина и креатинина в крови в зависимости от времени для данной группы
также удовлетворяет гармоническим соотношениям. Отношения содержания в крови гемоглобина для времени
экспозиции 180 минут к суммарному значению гемоглобина для экспозиций 180 и 270
минут значительно отличается от «золотого» числа 0,382, но значения соответствующих
отношений для креатинина и для суммы значений гемоглобина и креатинина близки к
этому числу.
В группе,
подвергавшейся сочетанному воздействию ЭМИ КВЧ и гентамицином, все четыре
соотношения, включающие в себя основные морфометрические признаки тканей
почек, образуют «золотые сечения».
Так, отношение площади нормальной цитоплазмы к сумме значений площади
полости с площадью ядер составляет в среднем 0,375 и 0,625. В свою очередь, отношение площади полости и площади
ядер составляет 0,582 и 0,418. Отношение площади полости к сумме площади
нормальной цитоплазмы и площади ядер составляет 0,364 и 0,637, а отношение
площади нормальной цитоплазмы и площади ядер составляет 0,59 и 0,41.
Значение относительной
энтропии, рассчитанной для основных морфометрических признаков почек крыс,
подверженных сочетанному воздействию ЭМИ КВЧ и гентамицина, также находились
достаточно близко к “золотому” числу 0,618. Так по окончании 1 недели
эксперимента относительная энтропия составила 0,752, через 2 недели
эксперимента 0,747, а после 3 недель эксперимента 0,784.
Результаты
исследований у крыс при изолированном воздействии ЭМИ КВЧ
Морфологические
исследования ткани почек спустя семь дней от начала эксперимента при суммарной
экспозиции ЭМИ КВЧ 90 минут позволили выявить следующие особенности
морфологических изменений. Гистологическая структура нефронов не изменена.
Капилляры расширены, полнокровны. Морфологические признаки, свидетельствующие о
формировании необратимых изменений в сосудах клубочков, таких как стаз, слайдж,
тромбообразование отсутствуют. Эпителий канальцев почек не изменен (рис. 5, а).
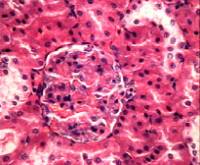
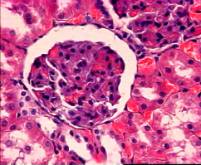
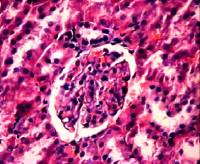
а) 1 неделя б) 2
недели в) 3 недели
Рис. 5 Фотографии микропрепаратов почек крыс из группы 2 (Воздействие ЭМИ КВЧ) при различной длительности
эксперимента. Увеличение 20 x 15.
По
окончании второй недели после начала эксперимента, при суммарном времени
экспозиции 180 минут наблюдалось прогрессирующее увеличение полнокровия
капилляров, что сопровождалось гипертрофией клубочков почек и формированием
кровоизлияний в просвете капсулы Шумлянского-Боумена (рис. 5, б). Просвет
канальцев неравномерно расширен, эпителий гипертрофирован. Некротические изменения
в клетках канальциевого эпителия отсутствуют.
На
21-е сутки эксперимента при суммарном времени воздействия 270 минут,
морфологические изменения также характеризовались явлениями полнокровия
капилляров, гипертрофией клубочков и эпителия канальцев, что хорошо видно
на рис. 5, в.
Выявленная динамика структурных изменений свидетельствует о том, что при изолированном воздействии ЭМИ КВЧ
изменения в гистологической структуре ткани почек начинают формироваться в
течение первой недели от начала эксперимента, достигают максимума на второй
неделе от начала эксперимента. Стабилизация процесса наступает на третьей
неделе эксперимента. Выявленные изменения носят адаптивный, а не патологический
характер.
Здесь,
как и в контрольной группе, значимая корреляционная зависимость получена для
площади ядер, хотя коэффициенты корреляции более низкие, чем в контрольной
группе. Коэффициент корреляции для площади ядер и площади цитоплазмы составляет
0,47, для площади ядер и площади полости канальцев 0,57, для площади ядер и количества
ядер 0,54. Все эти коэффициенты значимы с уровнем значимости p<0,05.
Значения 0,57, 0,54 и 0,47 указывают на наличие средней корреляции между
показателями.
Регрессионная
модель зависимости площади ядер JADRO от площади цитоплазмы SITOPLAZ и
площади полости POLOST имеет следующий вид:
JADRO = 8,180224 + 0,178381*SITOPLAZ + 0,201424*POLOST (10)
Множественный
коэффициент корреляции здесь равен R=0,71357 (p<0,002), доля «объяснённой» дисперсии составляет 50,918%, что указывает на достаточно высокую
прогнозную точность модели. Поверхность регрессии для данной модели изображена
на рис. 6.
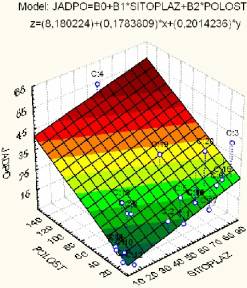
Рис.6. Поверхность регрессии, описывающая прогнозный эффект для показателя JADRO, в
зависимости от площади полости и площади цитоплазмы.
Относительно
высокий коэффициент корреляции, равный 0,53, получен для площади полости POLOST и
количества ядер COLVJADR. Этот коэффициент указывает на наличие средней
линейной зависимости между данными показателями. Также значимые коэффициенты
корреляции получены для таких показателей, как ядерно-цитоплазматический индекс
(ЯЦИ) и площадь цитоплазмы (-0,51), ЯЦИ и площадь изменённой цитоплазмы
(-0,53). Уравнение регрессионной зависимости ядерно-цитоплазматического индекса
INDEKS
от площади ядер JADRO, площади цитоплазмы SITOPLAZ и площади изменённой цитоплазмы IZMSITOP
приведено ниже:
INDEKS
= 0,501405+0,011306*JADPO - 0,004769*SITOPLAZ - 0,005295*IZMSITOP (11)
Доля
«объяснённой» дисперсии здесь составляет 77,427%. Таким образом, эта модель
более точная, чем рассмотренное выше уравнение регрессии. Коэффициент
корреляции равен R=0,87993 (p<0,00001).
Для группы крыс,
подверженных ЭМИ КВЧ, отношение между
значениями гемоглобина и креатинина
подчиняется закону «золотого сечения» независимо от времени экспозиции (90
мин, 180 мин, 270 мин). Следует
отметить, что значения, полученные в результате экспозиции 90 мин ближе
к «золотой» пропорции 0,618 и 0,382, чем последующие значения. Так, для
экспозиции 90 мин содержание гемоглобина составляет 0,598 в общей сумме значений
гемоглобина и креатинина, а содержание креатинина, соответственно 0,402; для
экспозиции 180 мин содержание гемоглобина составляет 0,644, а содержание
креатинина – 0,356; для экспозиции 270 мин содержание гемоглобина составляет
0,653, а содержание креатинина – 0,347. Также близко к «золотому» числу 0,618
отношение суммарного значения гемоглобина к сумме значений гемоглобина и
креатинина, полученного за время экспозиций 180 и 270 мин. Для данной группы изменение значений гемоглобина и креатинина в зависимости от времени экспозиции не подчиняется закону
«золотого сечения». Отношения значений гемоглобина и креатинина для
времени экспозиции 180 мин к суммарному значению гемоглобина и креатинина для
экспозиций 180 мин и 270 мин не являются гармоническими пропорциями. Такой же
вывод можно сделать
относительно изменения суммы гемоглобина и креатинина в зависимости от времени экспозиции. В рассматриваемой группе животных закону «золотого сечения» удовлетворяет
одно соотношение морфометрических показателей в тканях почек. Это отношение
площади нормальной цитоплазмы к сумме
площади полости и площади ядер, которые составляют в среднем 0,423 и
0,577, причем с увеличением времени
экспозиции отклонение от нормы даже для этого отношения увеличивается. Все остальные отношения не образуют «золотую» пропорцию, что косвенно указывает на развитие
патологии в почках крыс под воздействием КВЧ.
По
сравнению с группой крыс, подверженных сочетанному воздействию ЭМИ КВЧ и
гентамицина, значения относительной энтропии для основных морфометрических
признаков почек крыс, подверженных изолированному воздействию ЭМИ КВЧ составили
0,994, 0,992 и 0,992 соответственно после одной, двух и трех недель
эксперимента, что очень далеко от
“золотой” пропорции 0,618:0,382.
Особенности морфофункциональных
изменений при изолированном воздействии гентамицина на организм млекопитающих
На
основании проведенных морфологических исследований тканей почек крыс,
подверженных воздействию гентамицина по прошествии 7 суток эксперимента были
получены следующие результаты. На фотографии микропрепарата почки (рис. 7, а)
видно, что почечные клубочки увеличены, капиллярные петли расширены,
полнокровны. Наблюдаются явления стаза, слайджа. Наблюдается сморщивание
отдельных клубочков. Капсула сохранена, без выраженных патологических
изменений. Структура почечных канальцев изменена, их просвет расширен.
Наблюдаются острые дистрофические и некротические изменения эпителия, а также
отслоение эпителия в просвет канальцев.
По
прошествии двух недель от начала эксперимента в почках наблюдаются изменения
формы капсул клубочков. На фотографии микропрепарата почки крысы из группы,
подверженной воздействию гентамицина (рис. 7, б) отчетливо видно, что
капиллярные петли местами расширены, наблюдается полнокровие с явлениями стаза.
В канальцах обнаружены дистрофические и
некротические изменения эпителия, просвет канальцев расширен. В просвете
имеются эпителиальные клетки.
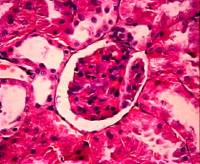
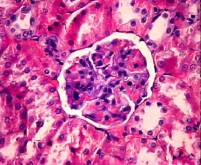
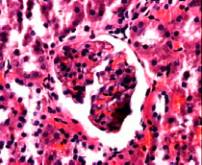
а)
1 неделя
б) 2 недели в) 3 недели
Рис. 7. Фотографии микропрепаратов почек крыс из группы 3
(введение гентамицина) при различной длительности эксперимента. Увеличение 20 x 15.
На
третьей неделе эксперимента изменения в почках становятся более выраженными, по
сравнению с изменениями в течение двух предыдущих недель, о чем свидетельствует
фотография микропрепарата почки, изображенная на рис. 7, в. Наблюдается
сморщивание клубочков, а также выраженное полнокровие капилляров. Большая часть
капилляров подверглась некрозу. В некоторых участках микропрепарата отсутствует
четкая гистологическая структура канальцев. Структура эпителия нечеткая,
наблюдаются некротические изменения эпителия и отслоение эпителия в просвет
канальцев.
После
проведения корреляционного анализ основных морфологических показателей, как и в
других группах, здесь значимыми являются коэффициент корреляции для площади
ядер и площади цитоплазмы (0,55), для площади ядер и площади полости канальцев
(0,50), для площади ядер и количества ядер (0,57). Все эти значения указывают
на наличие средней корреляционной
зависимости между показателями. Значения коэффициентов корреляции для этой
группы также ниже, чем соответствующие значения, полученные для контрольной
группы. В этой группе получены также значимые коэффициенты корреляции для таких показателей, как площадь полости и
площадь цитоплазмы (0,58), а также площадь полости и количество ядер (0,56).
Полученные значения указывают на среднюю зависимость между показателями.
В
отличие от группы, облучённой ЭМИ КВЧ, для группы, которая подвергалась воздействию
гентамицином, характерна сильная корреляция между площадью ядер и площадью
изменённой цитоплазмы. Коэффициент корреляции для этих показателей составляет
0,75. Уравнение регрессионной зависимости площади ядер JADRO от
площади изменённой цитоплазмы IZMSITOP имеет следующий вид:
JADRO = 12,84058 + 0,321458*IZMSITOP (12)
Доля
«объяснённой» дисперсии для данной модели составляет 55,871%, что указывает на её достаточную прогнозную точность.
На
основании проведённого выше корреляционного анализа получено уравнение
регрессии, выражающее площадь ядер JADRO через площадь полости POLOST и площадь изменённой цитоплазмы IZMSITOP:
JADRO = 7,100209 + 0,287955*IZMSITOP + 0,147019*POLOST (13)
На
рис. 8 изображена поверхность регрессии для рассматриваемой математической
модели.
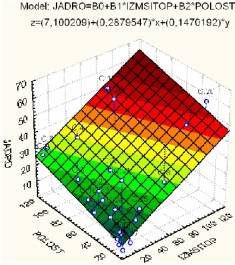
Рис. 8. Поверхность регрессии, описывающая прогнозный эффект
для показателя JADRO, в зависимости от площади полости и площади изменённой
цитоплазмы.
Множественный
коэффициент корреляции здесь равен R=0,82483 (p<0,00001), доля «объяснённой» дисперсии составляет 68,034%, что указывает на достаточную
точность модели.
Также
была составлена модель, описывающая прогнозный эффект для показателя POLOST, в
зависимости от площади цитоплазмы и количества ядер. Регрессионная модель для
данных показателей имеет следующий вид:
POLOST =-18,3369 + 1,000783*SITOPLAZ + 2,657578*JADRCOLV (14)
Коэффициент
детерминации для данной модели равен 0,55008,
что указывает на её достаточную точность. Множественный коэффициент корреляции,
равный R=0,74168 (p<0,0001), указывает на наличие сильной зависимости между
перечисленными показателями.
Как
и в группе, облучённой ЭМИ КВЧ, значимые коэффициенты корреляции были получены
для таких показателей, как ЯЦИ и площадь цитоплазмы (-0,55), ЯЦИ и площадь
изменённой цитоплазмы (-0,40). Уравнение регрессионной зависимости
ядерно-цитоплазматического индекса INDEKS от площади ядер JADRO, площади цитоплазмы SITOPLAZ и площади изменённой цитоплазмы IZMSITOP имеет вид:
INDEKS=0,5355+0,014333*JADRO - 0,004953*IZMSITOP -0,008442*SITOPLAZ (15)
Доля
«объяснённой» дисперсии здесь составляет 76,024%.
Таким образом, эта модель менее точная, чем аналогичная регрессионная модель,
полученная для группы крыс, облучённых ЭМИ КВЧ. Множественный коэффициент
корреляции для данной модели равен R=0,87191 (p<0,00001).
По истечении 90 мин после введения гентамицина отношение гемоглобина и креатинина близко к гармоническому соотношению (0,403 и 0,597). В дальнейшем, по прошествии 180 мин и 270 мин воздействия гентамицином, закон «золотого сечения» между содержанием гемоглобина и креатинина нарушается, отношение гемоглобина к суммарному значению гемоглобина и креатинина равно соответственно 0,440 и 0,478, что значительно отличается от показателя «золотого сечения» (0,382). Как следствие, и суммарные значения гемоглобина и креатинина после 180 мин и 270 мин воздействия не удовлетворяют гармоническому соотношению.
Закону «золотого сечения» подчиняется не
только отношение между гемоглобином и креатинином, но и изменение каждого из
этих показателей. Так,
суммируя значения гемоглобина по прошествии 180 мин и 270 мин воздействия
гентамицином. а затем, находя отношение содержания гемоглобина в крови,
соответствующее времени 180 мин к найденной сумме, получаем значение 0,389,
очень близко к «золотому» числу 0,382. Такой же результат получен для отношения значения креатинина,
соответствующего времени 180 мин, к сумме значений креатинина для
времени 180 мин и 270 мин. Значение 0,426 также достаточно близко к золотому
числу 0,382, что указывает на наличие
гармонического соотношения. Находя отношение суммарного значения
гемоглобина и креатинина, соответствующего времени воздействия 180 мин к общему значению суммы гемоглобина и
креатинина для времени воздействия 180 мин и 270 мин, получаем число 0,408,
близко к «золотому» (0,382), что также указывает
на наличие гармонического соотношения.
Отношение площади
нормальной цитоплазмы к сумме площади полости и площади ядер образуют «золотую» пропорцию (в среднем
0,346 и 0,654). Площадь полости и сумма площади нормальной цитоплазмы и площади
ядер также образуют «золотую» пропорцию (в среднем 0,331 и 0,669). При этом с
увеличением времени экспозиции, для этих
соотношений наблюдается все большее отклонение от «золотых» чисел 0,618
и 0,382. Так, для времени экспозиции 270 минут получаем соотношение между
площадью полости и суммой площади нормальной цитоплазмы с площадью ядер, составляющее соответственно
0,328 и 0,672, что уже существенно
отличается от классического «золотого сечения».
Значения
относительной энтропии для основных морфометрических признаков почек крыс,
подверженных изолированному воздействию гентамицина составили 0,803, 0,974,
0,848 соответственно после одной, двух и трех недель эксперимента, что также очень далеко от “золотой” пропорции.
Выводы
1. В результате проведенных исследований выявлены особенности формирования морфофункциональных
изменений, отражающих состояние почек у экспериментальных животных, вследствие сочетанного воздействия ЭМИ КВЧ и нефротоксичного препарата
гентамицина, по сравнению с изолированным воздействием данных факторов.
2.
Сравнительный анализ тяжести морфофункциональных изменений в различных
экспериментальных группах показал, что наиболее тяжелые патологические процессы,
формирующиеся при сочетанном воздействии ЭМИ КВЧ и гентамицина, характеризуются
взаимозависимым усилением патологических реакций, типичных как для ЭМИ КВЧ, так
и для гентамицина. Динамика их развития
зависит от суммарного времени воздействия повреждающих факторов, наиболее
тяжелые и необратимые изменения выявляются к третьей неделе от начала
эксперимента. При изолированном воздействии ЭМИ КВЧ или гентамицина
регистрируются менее тяжелые изменения, которые соответствуют типичным реакциям
организма на действие указанных факторов.
3.
Установлено, что к “золотому” сечению и “золотому” вурфу приближалось
большинство соотношений между морфологическими и функциональными показателями в
контрольной группе и группе крыс, подверженных
сочетанному воздействию ЭМИ КВЧ и гентамицина, из чего следует, что
“золотое” сечение и “золотой” вурф типичны
не только для показателей нормы, но и отражают формирование равновесного
состояния в условиях сформировавшегося необратимого патологического процесса.
4.
У животных, подвергшихся изолированному воздействию ЭМИ КВЧ или гентамицина,
значения относительной энтропии для основных морфофункциональных показателей не
соответствовали классическому “золотому сечению”. Наиболее удалены от “золотого
сечения” были морфофункциональные показатели, отражающие как реакции
повреждения, так и развитие ответных компенсаторных реакций. Данный факт
подтверждает формирование неравновесной системы на определенном этапе развития
патологического процесса и объясняет несоответствие показателей золотого
сечения при условии развития выраженных механизмов компенсации.
5.
На основании факторного и регрессионно-корреляционного анализа установлено, что
наиболее высокие коэффициенты корреляции наблюдались между значимыми
параметрами в контрольной группе животных (0,9), что типично для показателей
нормы. Коэффициенты корреляции для аналогичных показателей у животных,
подвергшихся сочетанному воздействию ЭМИ КВЧ и гентамицина были несколько ниже
и не превышали 0,7. Наиболее низкий коэффициент корреляции (0,57) выявлен при
изолированном воздействии ЭМИ КВЧ и гентамицина. Выявленная особенность
характеризует высокую корреляцию между сформировавшимися тяжелыми
патологическими процессами в группе с сочетанным воздействием и относительно
низкую корреляцию между процессами, отражающими развитие повреждения и
противодействующих механизмов компенсации в группах с изолированным
воздействием ЭМИ КВЧ и гентамицина.
Практические
рекомендации
1. В связи с тем,
что сочетанное воздействие ЭМИ КВЧ и гентамицина приводит к формированию
тяжелых изменений структуры ткани почек, рекомендуется не допускать
использование сочетания указанных факторов в терапевтических целях.
2. Результаты
экспериментальных исследований, факторного и регрессионного анализа
рекомендуется использовать в качестве моделей, позволяющих прогнозировать
развитие морфо-функциональных изменений при применении гентамицина у лиц контактирующих с ЭМИ КВЧ.
3. Данные
результатов, отражающие особенности соблюдения правила «золотого сечения» с
учетом динамики развития патологического процесса, могут быть использованы как
прогностические для оценки развития компенсаторных механизмов и необратимых
патологических изменений.
СПИСОК
РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Монографии
1. Экспериментальная
магнитобиология: воздействие полей сложной структуры: Монография / М.В. Грязев, Л.В. Куротченко,
С.П. Куротченко, Ю.А. Луценко, Т.И. Субботина, А.А. Хадарцев, А.А. Яшин; Под
ред. Т.И. Субботиной и А.А. Яшина: Москва – Тверь – Тула: ООО «Издательство
«Триада», 2007. – 112 с. (Серия монографий «Экспериментальная
электромагнитобиология», вып. 2).
2. Воздействие право- и левовращающихся
магнитных полей на биообъекты: физические модели и эксперимент: Монография /
М.Е. Архипов, Л.В. Куротченко, А.С. Новиков, Т.И. Субботина, А.А. Хадарцев,
А.А. Яшин; под ред. Т.И. Субботиной и А.А. Яшина: ГУП “НИИ НМТ”, ООО “НИЦ
“Матрикс”. – Москва – Тула – Тверь: ООО “Издательство “Триада”, 2007. – 200 с.
(Серия монографий “Экспериментальная электромагнитобиология”. Вып. 7).
Статьи в журналах, рекомендованных ВАК
3. Куротченко Л.В., Яшин А.А., Иванов В.Б., Субботина Т.И. Морфологические реакции на
воздействие электромагнитного излучения нетепловой интенсивности как фактор
изменения протеолитической активности пепсина // Вестник новых медицинских
технологий. – 2002. – Т. IХ, № 2. – С. 11
– 12.
4. Куротченко Л.В., Яшин А.А., Субботина Т.И. Эффекты
воздействия электромагнитного КВЧ-излучения, прошедшего через биологические
матрицы на живой организм // Вестник новых медицинских технологий. – 2002. – Т.
IХ, № 2. – С. 12 – 13.
5. Куротченко Л.В. Исследование побочных эффектов у
лабораторных животных, подвергшихся сочетанному действию нефротоксических
препаратов и КВЧ-излучения // Вестник новых медицинских технологий. – 2007. –
Т. XIV., №1. – С. 181 – 183.
Статьи в материалах конференций
6. Куротченко Л.В., Яшин А.А., Субботина Т.И. Влияние
низкоинтенсивного КВЧ-излучения на красный костный мозг и клетки крови при
экранировании минералом шунгит // Проблемы экологии в науке и образовании:
Матер. Межвуз. Науч. конф. – Курск: Изд. центр «ЮМЭКС», 2004. – С. 38 – 41.
7. Куротченко Л.В., Исаева Н.М., Субботина Т.И.
Исследование соотношений между гемоглобином и креатинином в крови лабораторных
крыс // Естествознание и гуманизм: Сб. науч. работ. – Томск: Изд-во Сиб. гос.
мед. ун-та, 2007. Т.4, №2 – С. 92 – 93.
8. Куротченко Л.В., Исаева Н.М., Субботина Т.И. Сравнение
информационной энтропии для различных групп лабораторных крыс // Естествознание
и гуманизм: Сб. науч. работ. – Томск: Изд-во Сиб. гос. мед. ун-та, 2007. Т.4,
№3 – С. 107.
СПИСОК
СОКРАЩЕНИЙ
КВЧ
– крайне высокая частота
ЭМИ
– электромагнитное излучение
ЭМИ
КВЧ – электромагнитное излучение крайне высокой частоты
ЯЦИ
– ядерно-цитоплазматический индекс
COLVJADR - количество ядер
GEMOGLOB – гемоглобин
INDEKS – ядерно-цитоплазматический индекс
IZMSITOP - площадь изменённой цитоплазмы
JADRO - площадь ядер
KREATINI – креатинин
POLOST - площадь полости
PROSVET - площадь
просвета
SITOPLAZ - площадь цитоплазмы
VREMJA - время экспозиции
ЛР № 040905 от
22 июля 1998 г.
ПД № 00188 от 3
декабря 1999 г.
Формат бумаги
60x84/16.
Бумага офс. Гарнитура «Times New
Roman».
Печать риз.
Усл. печ. л. 1,4. Уч.-изд. л. 1,5.
Тираж 100 экз.
Заказ № 936.
Отпечатано
в ОАО «Тульский полиграфист».
300600, г.
Тула, ул. Каминского,33.
Поступил в редакцию 4.10.2008.