1. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ БИОСТРУКТУР
1.1. Лазерная
диагностика
Применение лазеров в биологии и медицине
основано на использовании широкого круга явлений, связанных с разнообразными
проявлениями взаимодействия света с биологическими объектами. Лазерное
излучение, так же как и обычный свет, может отражаться, поглощаться,
рассеиваться, переизлучаться биологической средой, и каждый из этих процессов
несет информацию о микро- и макроструктуре этой среды, движении и форме
отдельных ее составляющих. В отличие от остальных источников излучения, лазеры обусловлены уникальными физическими
свойствами: когерентность, монохроматичность, поляризованность, изотропность,
высокая спектральная плотность энергии, высокой стабильностью интенсивности
лазерного излучения в стационарном режиме, возможностью генерации очень
коротких световых импульсов. Видимый и УФ свет могут оказывать
фотобиохимическое действие. Яркими примерами этого являются фотосинтез растений
и бактерий, а также механизм зрения. Высокоинтенсивное световое излучение УФ,
видимого и ИК диапазонов длин волн оказывает разрушающее (деструктивное)
действие на биологические объекты.
Таким образом, в зависимости от характера взаимодействия лазерного
излучения с биологическими тканями различают три вида фотобиологических
эффектов:
1.
Фотодеструктивное воздействие, при котором тепловой, гидродинамический,
фотохимический эффекты света вызывают деструкцию тканей. Этот вид лазерного
взаимодействия использует в лазерной хирургии.
2. Фотофизическое и
фотохимическое воздействие, при котором поглощенный биотканями свет возбуждает
в них атомы и молекулы, вызывает фотохимические и фотофизические реакции. На
этом виде взаимодействия основывается применение лазерного излучения как
терапевтического.
3. Невозмущающее воздействие, когда биосубстанция не меняет своих свойств, в процессе взаимодействия со
светом. Это такие эффекты, как рассеивание, отражение и проникновение. Этот вид
используют для диагностики (например - лазерная спектроскопия). На рис. 1.1 представлена
классификация основных принципов применения лазеров в биологии и медицине,
учитывающая указанные группы процессов.
Поскольку мы
имеем дело с живыми объектами, то помимо физико-химических проявлений действия
лазерного излучения необходимо учитывать его влияние и на функционирование
живой материи. Это влияние определяется степенью гомеостаза живого объекта.
Степень гомеостаза характеризует состояния и процессы, обеспечивающие
устойчивость организма к внешним возмущениям, она является функцией
эволюционного развития и оказывается наинизшей у биологических молекул и наивысшей
у позвоночных животных. Свет малой интенсивности не запускает адаптационные
механизмы биосистемы. По мере роста интенсивности сначала затрагивается
гомеостаз живой системы на локальном уровне, затем включаются общие
адаптационные и регуляционные механизмы системы, полностью ее
восстанавливающие, далее они уже не справляются с полным восстановлением и
частично происходят необратимые процессы, которые нарастают и приводят к
разрушениям в системе. Однако объект можно еще считать «живым». При высоких
интенсивностях разрушения оказываются настолько значительными, что объект уже
не может считаться «живым».
Методы
лазерной диагностики делятся на микродиагностические (на уровне атомов и
молекул) и макродиагностические (на уровне клеток и органов). Микродиагностика использует все средства
линейной и нелинейной лазерной спектроскопии, а макродиагностика — методы упругого и квазиупругого рассеяния,
интерферометрию и голографию.
Традиционно,
спектральный анализ широко применяется в биологии для анализа, например,
следовых концентраций веществ при изучении метаболизма живых организмов и в токсикологии.
Однако нелазерные источники света позволяют в лучшем случае обеспечить
детектирование сигнала от 1010 атомов или молекул одного сорта. С использованием
лазеров удается реализовать сверхчувствительные методы, позволяющие
детектировать даже отдельные атомы или молекулы, проводить атомный анализ
непосредственно на реальных объектах, не прибегая к их предварительной
подготовке. Одним из примеров является метод прямой резонансной фотоионизации, успешно примененной к определению
следовых концентраций алюминия в крови человека.
Сочетание
резонансной фотоионизации молекул с
традиционной Масс-спектрометрией позволяет существенно повысить
чувствительность и получать ее для случая определения содержания триптофана в
воде на уровне 10-14 г.
Лазерная
спектроскопия оказывается особенно эффективной при исследовании загрязнений
окружающей среды (флоры и фауны, пищевых продуктов и пр.) токсическими и
патогенными веществами и анализе путей их проникновения в человеческий
организм. Даже сравнительно простой флуоресцентный
анализ в комбинации с хроматографией при использовании лазеров
оказывается очень чувствительным. Лазерно-флуоресцентная
спектроскопия с применением сенсибилизаторов патологических тканей,
например производных гематопорфирина, оказывается очень эффективной при ранней
диагностике раковых и других заболеваний.
Оптико-акустическая спектроскопия имеет свои особые
преимущества при исследовании биологических объектов, главное из которых
состоит в малом влиянии рассеяния на результаты измерения спектров поглощения,
что очень важно для неоднородных по структуре биологических сред. Лазерное
возбуждение обеспечивает и здесь высокое спектральное разрешение, локальность и
дистанционность анализа, возможность использования волоконной техники.
Жесткая
фокусировка мощных лазерных пучков используется в целом ряде методик,
реализующих микроспектральный анализ биологических
объектов. Лазерный отбор микропробы с поверхности биообъекта путем испарения
микрообъема вещества (1 мкм3) с последующим масс-спектральным
анализом этого пара лежит в основе лазерной
микроаналитической
масс-спектроскопии (ЛАММА-метод) и промышленных лазерных
масс-анализаторов.
Существуют и
неразрушающие методы микроспектрального анализа биообъектов, например лазерная микро-флуориметрия отдельных живых клеток или органелл.
Пространственное и временное разрешение метода составляет, соответственно, 0,3
мкм и 0,2 нс. Он может быть полезен при флуоресцентном картировании генов. Для
прямого наблюдения первичной структуры ДНК может оказаться наиболее подходящим
комбинированный метод, сочетающий селективную лазерную ионизацию молекул хромофоров с ионно-полевой микроскопией.
Изотопически-селективное детектирование отдельных атомов может быть
использовано для анализа путей метаболизма живых организмов in vivo, в том числе на клеточном уровне.
Лазерные
импульсы пикосекундной и субпикосекундной длительности нашли самое широкое
применение для изучения первичных процессов фотосинтеза, зрения и биохимических
реакций с участием гемоглобина, ДНК и других биологически важных молекул. Ультрабыстрые
процессы являются характерными для биологии, причем для одного и того же
объекта времена фотофизических и фотохимических процессов могут занимать очень
широкий диапазон, например, для гемоглобина 10-5– 10-15
с. Исследования этих процессов требуют применения импульсных лазеров и новых
методик спектроскопии, включая спектроскопию комбинационного рассеяния в наносекундном и пикосекундном
диапазонах, быстродействующие абсорбционные
методы во временном масштабе от наносекунд до фемтосекунд и пикосекундную флуоресцентную спектроскопию.
В основе
биомедицинской макродиагностики лежит
использование высокой монохроматичности и когерентности лазерного излучения,
которая позволяет измерять положение, скорость, малые перемещения и форму
различных компонентов биологических объектов. Заметим, что большинство из
перечисленных ниже примеров в принципе не может быть реализовано с помощью
тепловых источников света.
Одним из первых
эффективных применений лазеров
в биомедицине была пролетная цитометрия, когда лазер был
применен для ускорения анализов и сепарации отдельных клеток млекопитающих за
счет точных измерений их оптических свойств — характеристик вызванной лазером
флуоресценции. Цитофлуориметры первого поколения на основе Аr лазеров с λ=488 нм выпускаются промышленностью.
Готовятся к выпуску цитофлуориметры второго поколения на основе более
коротковолнового Не – Cd лазера с λ=441,6
нм.
Другое
не менее эффективное применение лазеров — это лазерная анемометрия, которая заключается в измерении малых скоростей
движения биологических жидкостей (например, скорости кровотока в сосудах,
подвижности бактерий, сперматозоидов и пр.). Этот метод основан на измерении
доплеровского сдвига частоты излучения лазера, который возникает при обратном
рассеянии света от движущихся частиц микронного размера.
Голография и интерферометрия являются мощными
средствами диагностики вообще и биомедицинской в частности. Голографические методы
позволяют получать трехмерные изображения биообъектов, контуры этих объектов
могут быть картированы, а их деформации проанализированы в реальном масштабе
времени. Эти новые возможности могут оказать влияние на развитие многих
разделов медицины: ортопедию, радиологию, офтальмологию, урологию и отологию.
Большие потенциальные возможности в этом смысле имеет классическая
интерферометрия при использовании лазерных источников (например, при создании
ретинометров — устройств для определения ретинальной остроты зрения), а также
спекл-интерферометрия (например, для определения структуры и шероховатости
некоторых биотканей).
Упругое рассеяние при использовании лазерных источников
света в сочетании с полным анализом поляризационных характеристик индикатрисы
рассеяния позволяет эффективно изучать слабопоглощающие анизотропные
двухкомпонентные биоткани, например ткани глаза. Упругое светорассеяние
оказывается также эффективным в ряде задач иммунологии, вирусологии и
гематологии. Применение лазеров в этих исследованиях позволяет существенно
упростить измерения и повысить их надежность.
Лазерная
диагностика в биологии и медицине — новое перспективное направление в
фотобиологии, являющееся эффективным средством изучения биологических систем
различной степени организации — от биомолекул до клеток, биотканей и отдельных
органов животных и человека.
Методы
лазерной макро- и микродиагностики обладают высокой чувствительностью,
значительным пространственным разрешением и универсальностью. Они перспективны
для ранней диагностики рака, катаракты, различных заболеваний крови и др. Их
используют для анализа загрязнений окружающей среды токсическими и патогенными
веществами. С их помощью изучают сверхбыстрые процессы фотосинтеза и
фотобиохимических реакций, а также определяют малые скорости кровотока в
сосудах, подвижность бактерий и пр.
Из-за
сложности биообъектов с помощью неразрушающих методов микродиагностики
зачастую удается получить лишь качественную информацию о составе вещества, наличии
примесей и пр. В связи с этим интенсивно развиваются методы лазерной
аналитической спектроскопии, основанные на эффектах лазерного фотовозбуждения
и фотоионизации предварительно подготовленных проб биообъектов путем
локального испарения или распыления лазерным, электронным или ионным пучками,
их атомизации в пламени, термической атомизации в вакууме или инертном газе.
Эти методы обладают высокой чувствительностью и позволяют получить
количественную информацию о содержании различных, например токсических,
примесей в биообъектах [1].
1.2. Естественная оптическая и магнитная
оптическая активности
Оптическая
активность — способность хиральной среды поворачивать плоскость поляризации проходящего
света — была открыта Араго в
1811 г. Как показал Френель, оптическая активность есть результат кругового двулучепреломления, т.
е. разных скоростей распространения в среде света, поляризованного по кругу
вправо и влево.
В
правой волне вектор напряженности электрического поля в луче, идущем в глаз
наблюдателя, вращается по часовой стрелке, в левой — против часовой стрелки.
Линейно поляризованную волну можно разложить на правую и левую волны,
поляризованные по кругу — электрический вектор, колеблющийся вдоль одного направления, есть сумма двух
векторов, вращающихся по
кругу по и против часовой стрелки (рис. 1.2,а).
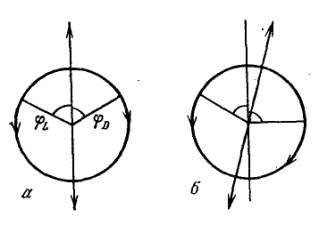
Рис. 1.2. Разложение плоско-поляризованной волны: а) на
волны, поляризованные по кругу вправо и влево; б) поворот плоскости поляризации
в результате кругового лучепреломления
Если одна из
этих волн распространяется быстрее другой, то суммарный вектор поворачивается
на угол, тем большие, чем больше разность скоростей (рис. 1.2, б), т. е. показателей
преломления. При прохождении луча через слой вещества толщиной l плоскость поляризаций
поворачивается на угол
![]() , (1.1)
, (1.1)
где ![]() — длина волны света
— длина волны света
![]() и
и
![]() — показатели преломления для левой и правой волн.
— показатели преломления для левой и правой волн.
Удельным
вращением раствора, содержащего с (г/см3) оптически активного вещества, называется
величина
![]() .
(1.2)
.
(1.2)
Биополимеры
хиральны и, следовательно, обладают естественной оптической активностью, т. е.
вращают плоскость поляризации света, и круговым
дихроизмом.
Применительно
к полимерам рационально выражать оптическое вращение
круговой
дихроизм в величинах, отнесенных к одному мономеру. Среднее вращение мономера определяется как:
![]() , (2.3)
, (2.3)
где М0 — средняя молярная масса мономера.
Биополимеры
в ряде случаев обладают двоякой хиральностью — хиральностью мономерных звеньев
и хиральностью α-спиралей белков и полипептидов или двуспиральных участков
нуклеиновых кислот. При полной денатурации, т. е. при переходах спираль —
клубок, сохраняется лишь хиральность мономеров. Соответственно эти переходы сопровождаются
резкими изменениями вращения и кругового дихроизма. Эти характеристики очень
чувствительны к изменениям конформаций. С помощью аномальной дисперсии
оптического вращения и кругового дихроизма удается получать ценные сведения о
конформациях биополимеров и их изменениях.
Магнитная
оптическая активность. В 1845 г.
Фарадей записал в своем дневнике «...в конце концов, мне удалось намагнитить и
наэлектризовать луч света и осветить магнитную силовую линию». Речь шла об
открытии магнитного вращения плоскости поляризации света, распространяющегося
вдоль направления магнитного поля. Это явление получило название эффекта Фарадея. Приведенные слова
имеют лишь фигуральный смысл — магнитное поле действует не на свет, а на
вещество, которое обретает в поле круговое двулучепреломление. Сравнительно
недавно эффект Фарадея — магнитное
оптическое вращение и магнитный
круговой дихроизм — нашли важные применения в молекулярной биофизике.
Угол
вращения φ, выраженный формулой (2.4), пропорционален напряженности магнитного
поля Н (формула Беккереля):
![]() , (2.4)
, (2.4)
где
V — константа магнитного вращения (постоянная Верде).
Относительные
значения магнитного кругового дихроизма различных органических соединений
характеризуются следующими величинами: для порфиринов ~ 100, аннуленов ~3,
пуринов ~0,2, циклогсксанона ~0,00002. Эффект Фарадея для гемсодержащих белков
сильно зависит от электронных состояний гема и конформаций белка. Высокая
чувствительность аномальной дисперсии кругового дихроизма и магнитного
кругового дихроизма позволяет изучать различные цитохромы во взвесях
субмитохондриальных частиц. Спектры поглощения такой возможности не дают. При
очень низких температурах удается наблюдать неравновесные возбужденные
конформации [2].
1.3.
Исследование биологических тканей в поляризованном свете
Рассматривая
прозрачные биологические объекты в микроскопе, трудно выявить различные
структуры, поэтому приходится применять некоторые специальные методики; в их
числе поляризационная микроскопия.
Поляризационный
(петрографический)
микроскоп аналогичен обычному биологическому микроскопу, но имеет поляризатор
перед конденсором и анализатор в тубусе между объективом и окуляром. Предметный
столик может вращаться вокруг
оптической оси микроскопа. Таким образом, объект освещают
поляризованными лучами и рассматривают через анализатор.
Если
скрестить поляризатор и анализатор, то поле зрения будет темным, таким же оно
останется при помещении на предметный столик изотропных прозрачных тел.
Анизотропные предметы изменяют поле зрения в соответствии с тем влиянием,
которое они окажут на направление плоскости колебаний поляризованного света.
Так
как некоторые ткани (мышечная, костная, нервная) обладают оптической
анизотропией, то возможна поляризационная микроскопия биологических объектов.
При скрещенных поляризаторе и анализаторе будут видны только те волокна,
анизотропия которых изменяет поляризованный свет.
Поляризованный
свет можно использовать в модельных условиях для оценки механических
напряжений, возникающих в костных тканях. Этот метод основан на явлении фотоупругости, которое заключается в
возникновении оптической анизотропии
в первоначально изотропных твердых телах под
действием механических нагрузок [3].
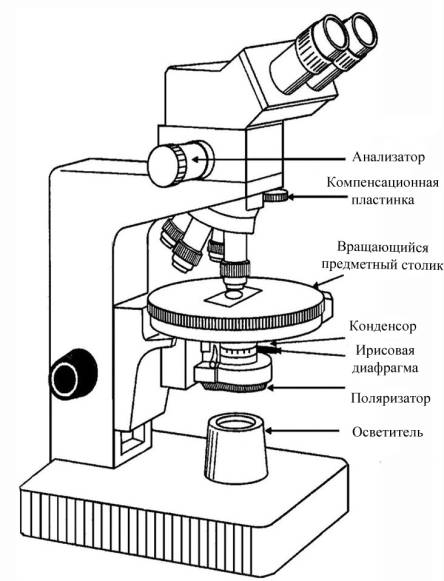
Рис. 1.3. Общий
вид поляризационного микроскопа фирмы Leitz [4]
Из прозрачного
изотропного материала, например плексигласа, создают плоскую модель кости. В скрещенных
поляроидах эта модель незаметна, так как выглядит темной. Прикладывая нагрузку,
вызывают анизотропию плексигласа, что становится заметным по
характерной картине полос и пятен. По этой картине, а также по ее изменению
при увеличении или уменьшении нагрузки можно делать выводы о механических
напряжениях, возникающих в модели, а, следовательно, и в натуре [3].
1.4. Голографический
метод исследования биоструктур
Голография — метод записи и восстановления волнового
поля, основанный
на интерференции и дифракции волн.
Идея
голографии была впервые высказана Д. Табором в 1948 г., однако ее практическое
использование оказалось возможным после появления лазеров.
Изложение основ голографии уместно начать сравнением с фотографией. При фотографировании на фотопленке фиксируется интенсивность световых волн, отраженных предметом. Изображение в этом случае является совокупностью темных и светлых точек. Фазы рассеиваемых волн не регистрируются, и таким образом пропадает значительная часть информации о предмете.
Голография
позволяет регистрировать и воспроизводить более полную информацию об объекте с
учетом амплитуд и фаз волн, рассеянных предметом. Регистрация фазы возможна
вследствие интерференции волн. С этой целью на светофиксирующую поверхность посылают
две когерентные волны: опорную, идущую
непосредственно от источника света или зеркал, которые используют как
вспомогательные устройства, и сигнальную,
которая появляется при рассеянии (отражении) части опорной волны предметом
и содержит соответствующую информацию о нем.
Интерференционную картину, образованную сложением
сигнальной и опорной волн и зафиксированную на светочувствительной пластинке,
называют голограммой. Для
восстановления изображения голограмму освещают той же опорной волной.
При
восстановлении изображения можно изменить длину опорной волны. Так, например,
голограмму, образованную невидимыми электромагнитными волнами
(ультрафиолетовыми, инфракрасными и рентгеновскими), можно восстановить
видимым светом. Так как условия отражения и поглощения электромагнитных волн
телами зависят, в частности, от длины волны, то эта особенность голографии
позволяет использовать ее как метод внутривидения,
или интроскопии.
Особо
интересные и важные перспективы открываются в связи с ультразвуковой
голографией. Получив голограмму в ультразвуковых механических волнах, можно
восстановить ее видимым светом. Ультразвуковая голография в перспективе может
быть использована в медицине для рассматривания внутренних органов человека с
диагностической целью. Учитывая большую информативность этого метода и
существенно меньший вред ультразвука по сравнению с рентгеновским излучением,
можно ожидать, что в будущем ультразвуковая голографическая интроскопия заменит
традиционную рентгенодиагностику.
Еще одно медико-биологическое приложение голографии связано с голографическим
микроскопом. Один из первых способов
построения голографического микроскопа основан на том, что изображение предмета
получается увеличенным, если голограмму, записанную с плоской опорной волной, осветить расходящейся сферической волной.
Рассмотрим
голографический микроскоп с предварительным увеличением (рис.1.4).
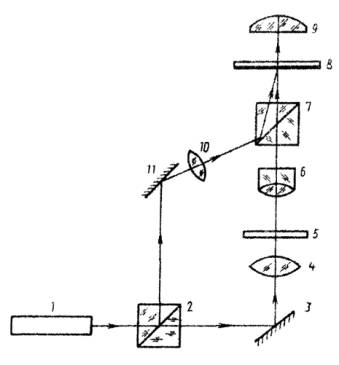
Рис.
1.4. Схема
голографического микроскопа
с предварительным увеличением: 1-лазер; 2,7-светоделители; 3,11-зеркала; 4-конденсор; 5-объект;
6-объектив; 8-голограмма; 9-окуляр
Полупрозрачный объект 5 помещают
на предметном стекле и освещают расположенным вплотную к нему конденсором 4 светом лазера 1. Объектив
микроскопа 6 создает
увеличенное действительное изображение объекта, регистрируемое вместе с опорным
пучком на голограмме 8, помещаемой
между объективом и окуляром 9.
Объектив и фокусирующую
линзу 10 подбирают
так, чтобы обеспечить максимальное совпадение кривизны создаваемых ими волновых
фронтов при заданном угле падения на голограмму для уменьшения пространственной
частоты регистрируемой интерференционной структуры. Угол между опорными и
предметными пучками выбирают достаточно малым из тех же соображений.
Восстановленное
изображение изучается через окуляр микроскопа, который можно перестраивать по
глубине и перемещать по полю зарегистрированного изображения. Подобная схема
микроскопа обеспечивает достижение разрешения около 1 мкм. В голографической
схеме с использованием микрообъектива для создания увеличенного изображения
предмета требования к разрешающей способности минимальны, но поле зрения и
глубина регистрируемого пространства определяются свойствами применяемого
микрообъектива и весьма малы [4].
1.5.
Люминесцентные методы
Люминесцентный анализ — совокупность методов анализа,
основанных на наблюдении люминесценции. Для возбуждения люминесценции
исследуемый объект подвергается действию ультрафиолетового света. Наблюдение свечения
производится в темном помещении визуально или при помощи специальных приборов
(флюорометров).
Качественный люминесцентный
анализ основан на различии цвета люминесценции, производимой веществами разной
химической природы; количественный люминесцентный анализ — на измерении
интенсивности люминесценции при помощи флюорометров или путем регистрации
спектров люминесценции специальными спектрографами [5].
Одним
из наиболее эффективных дополнительных методов контроля гомеостаза живых систем
является флуоресцентный метод. Флуоресценция – это испускание, происходящее при
возвращении спаренного электрона на более низкую орбиталь. Спектр испускания
вещества представляет собой зависимость интенсивности испускания от длины волны
при фиксированной длине волны возбуждения света.
Методы
исследования флуоресценции конкретных веществ обладают высокой чувствительностью, а также удобным временным диапазоном, так как испускание
флуоресценции происходит через 10-9 с (10 нс) после поглощения
света. За это время происходит множество различных молекулярных процессов,
которые влияют на спектральные характеристики флуоресцирующего соединения. В
настоящее время созданы приборы, позволяющие измерять флуоресценцию 10-18 с зонда в живой
клетке за время около 10-5 с, что намного превосходит
чувствительность и быстродействие даже таких чувствительных методов, как
радиоизотопный и иммуноферментный. Кроме того, исследование флуоресценции
позволяет получить информацию о состоянии живых систем, не повреждая их, и не
требует большого количества биологического материала. Имея такие преимущества,
флуоресцентные методы позволяют просто и экономично решить многие задачи
клинической диагностики, экологического контроля и физико-химического анализа и
все шире применяются в медицинских и биохимических исследованиях.
Многие
молекулы биологических веществ являются природными или естественными
флуорофорами, т. е. веществами, способными флуоресцировать в определенном
диапазоне длин волн при соответствующих условиях возбуждения, например белки.
Установлено, что флуоресцировать в белках способны только ароматические
аминокислоты, обладающие системой сопряженных двойных связей. Основным
флуоресцирующим компонентом в них является триптофан, который обусловливает
около 90% всей белковой флуоресценции. Спектр флуоресценции триптофана в водном
растворе представляет собой широкую бесструктурную полосу с максимумом при 348
нм и полушириной в 60 мкм, а его форма и положение максимума определяются
преимущественно индольным кольцом молекулы. Триптофансодержащие белки поглощают
свет вблизи 280 нм, а спектры флуоресценции сдвинуты в коротковолновую сторону
по сравнению со спектрами триптофана в воде. Соответственно значения их
максимумов могут изменяться от 343 нм (сывороточный альбумин) до 308 нм (азурин).
Основной причиной этого является наличие процессов ориентационного
взаимодействия, при которых положение спектра определяется полярностью и
жесткостью микроокружения
хромофора. Сдвиг максимума
в коротковолновую область
характерен для малополярного окружения, в длинноволновую – для
полярного. Максимумы испускания белков отражают среднюю доступность их
триптофановых остатков в водной фазе. Некоторое влияние на положение спектров
оказывает комплексообразование с окружающими соединениями. Спектральные
сдвиги часто являются следствием связывания лигандов, ассоциации «белок-белок»
и денатурации. Конформационно-чувствительными оказались и другие параметры
флуоресценции триптофан-содержащих белков: квантовый выход, длительность
возбужденного состояния, степень поляризации.
Флуоресценция
белков, не содержащих остатков триптофана, но имеющих в своем составе
фенилаланин и тирозин, обусловлена только остатками тирозина, который также
является природным флуорофором и имеет максимум спектра флуоресценции при 303–304
нм, а его интенсивность на порядок ниже, чем у триптофана. На положении
максимума флуоресценции тирозина, в отличие от триптофана, не сказываются
конформационные перестройки макромолекулы. Тирозин интенсивно
флуоресцирует в растворе
и при денатурации белков, сохраняя положение максимума. Его включение
в состав белка сопровождается лишь эффектом тушения флуоресценции и падением
квантового выхода. Свечение фенилаланина можно наблюдать только у тех немногих
белков, которые не содержат других ароматических аминокислот – триптофана и
тирозина (например, преальбумин мышц рыбы, гепатокупреин лошади, рибосомальный
белок). Спектр флуоресценции фенилаланина имеет максимум при 282 нм, и его
квантовый выход еще на порядок ниже, чем у тирозина.
Но
если в состав белка входят все три аминокислоты, то в спектре флуоресценции
проявляется только один триптофановый максимум. Даже в сывороточном альбумине
человека, содержащем 17 остатков тирозина и только один остаток триптофана,
свечение тирозина проявляется лишь в виде «плеча» на коротковолновом склоне
полосы флуоресценции триптофана. Оказывается, что значительная доля энергии
возбуждения, полученная тирозиновыми остатками, может мигрировать на
триптофанилы и высвечиваться в качестве триптофанового компонента.
К
природным флуорофорам относятся также нуклеиновые кислоты, коферменты и
витамины, продукты окисления и пигменты. При обычных условиях водные растворы
флуоресцируют слабо, с низким квантовым выходом. Например, для растворов
нуклеиновых кислот свечение усиливается в кислой среде. Положение максимума
флуоресценции различно для разных веществ, например для ДНК составляет 358 нм и
совпадает с максимумом гуанина. Увеличение интенсивности флуоресценции
оснований нуклеиновых кислот происходит также при низкой температуре. Примером
свечения коферментов и витаминов может служить флуоресценция пиридиннуклеотидов
– никотинамидадениндинуклеотида в восстановленной форме (в водном растворе
имеет максимум при 470 нм) и витамина А (максимум флуоресценции при 510 нм в
этаноле) [6].
Изменение
спектра собственной флуоресценции биологических жидкостей при различных
заболеваниях. За последние годы
существенно расширилось представление
о функциональной системе
крови. Значительное внимание
уделяется вопросам ее регуляции и выявлению механизмов регулирования при
различных заболеваниях. Известно, что развитие злокачественных образований,
заболеваний печени, суставов и другие патологические процессы вызывают в плазме
и сыворотке крови целый ряд отклонений от нормы. Это относится как к
количественному, так иногда и к качественному составу плазменных белков,
гормонов и т. д. Кроме того, такая биологическая жидкость, как кровь, является
очень удобным объектом для изучения флуоресцентными методами.
Специфические изменения параметров флуоресценции
сыворотки крови были обнаружены при злокачественных новообразованиях. В
экспериментах на крысах с перевитой лимфосаркомой Плисса показано, что развитие
опухоли приводит к увеличению интенсивности ультрафиолетовой флуоресценции
сыворотки крови на 19–41% и к сдвигу ее спектров на 4–5 нм в коротковолновую
область. Другие авторы проводили исследование сыворотки крови при возбуждении
ее светом с длиной волны 313 нм и регистрировали спектр сыворотки с максимумами
испускания 350 и
470 нм. Диагностически полезным оказался коэффициент, равный отношению
интенсивностей этих двух максимумов. Сравнивались флуориметрические данные и
окончательный клинический диагноз для различных локализаций злокачественных
опухолей. Было показано, что процент совпадения диагностических заключений,
сделанных флуориметрическим и клинико-морфологическим способами, зависит от
вида опухоли, ее локализации и размера. Наиболее эффективным данный метод
оказался для выявления лимфогранулематоза – 90% совпадений, а для большинства
локализаций – не хуже, чем при диагностике с помощью определения в крови
больного раково-эмбрионального антигена. Аналогичные исследования спектра
флуоресценции сыворотки крови были проведены при гемобластозах и различных
опухолевых заболеваниях системы крови и также выявили изменения данного
специального флуориметрического коэффициента.
Обнаружена связь между величиной интенсивности
флуоресценции триптофана в сыворотке крови у хирургических больных и экспериментальных
животных с местной и общей гнойной инфекцией, у обожженных в динамике
заболевания. Наблюдалась корреляция между увеличением флуоресценции триптофана
в безбелковой фракции гомогенатов ряда органов (мышцы, легкие, сердце, печень)
и увеличением флуоресценции триптофана в безбелковой фракции сыворотки крови у
животных с генерализованной гнойной инфекцией. Более того, наблюдаемые
изменения уровня флуоресценции триптофана в терапии больных с общей гнойной
инфекцией предшествовали изменениям в клинической картине заболевания и давали
возможность контролировать эффективность проводимого лечения. Была также
обнаружена корреляция между интенсивностью протеолитических процессов в ране и
уровнем флуоресценции триптофана в сыворотке крови. Исходя из этого сделан
вывод о том, что интенсивный распад триптофан-содержащих структур под действием
протеолитических ферментов приводит к увеличению содержания флуоресцентно
определяемого триптофана в крови.
На данный момент изучены спектры собственной
флуоресценции сыворотки крови
больных распространенным гнойным перитонитом.
Наблюдались достоверные различия между показателями интенсивности
флуоресценции сыворотки крови у таких пациентов по сравнению с контрольной
группой, причем при гнойном перитоните с развитием процесса собственная
флуоресценция сыворотки крови возрастала. Более детальное исследование спектров
флуоресценции сыворотки крови больных перитонитом показало, что высокие
показатели интенсивности флуоресценции (по сравнению с контрольной группой)
достоверно изменяются в динамике заболевания, отражая, таким образом, степень
его тяжести (реактивная, токсическая стадии и стадия полиорганной
недостаточности). Кроме того, рост флуоресценции у больных перитонитом на всех
стадиях сопровождался изменением протеолитической и ингибиторной активности
сыворотки крови (обратная корреляция).
При ревматоидном артрите степень собственной
флуоресценции сыворотки крови уменьшалась по сравнению с флуоресценцией у лиц
контрольной группы. Изучение спектров флуоресценции синовиальной жидкости
больных артритом показало, что по некоторым ее параметрам можно
дифференцировать различные стадии данного заболевания.
Флуоресцентные
методы позволяют также исследовать влияние различных воздействий на состояние
белков. Было установлено, что предварительное действие низкоинтенсивного
лазерного излучения на растворитель (воду) снижает интенсивность флуоресценции
триптофана и эффект тушения сохраняется в температурном диапазоне 8–50оС,
что является следствием изменения свойств растворителя под влиянием
электромагнитного излучения при взаимодействии с растворенным веществом. При
изучении интенсивности флуоресценции воды и водно-солевых растворов при
воздействии комбинированными постоянными и низкочастотными переменными магнитными
полями установлено увеличение интенсивности флуоресценции в растворах под
действием данных полей и формирование флуоресцирующих ассоциатов. Полученные
результаты позволяют предположить, что структурные изменения водных растворов
возникли под влиянием слабых электромагнитных полей, проявление которых зависит
от химического состава исследуемых
растворов и условий хроматографирования [6].
Флуоресцентные зонды, используемые в медицине. Исследование
собственной флуоресценции биологических материалов не всегда позволяет получить
желаемую информацию об объекте. В таком случае используют искусственные
флуорофоры, т. е. специально синтезированные вещества, имеющие специфический
спектр флуоресценции либо в свободном состоянии, либо при связывании с тем или
иным объектом исследования. Флуоресценция таких веществ (зондов), как правило,
обладает высоким квантовым выходом и достаточно большим временем жизни.
С
помощью флуоресцентных зондов можно исследовать молекулярные механизмы
возникновения и развития патологических процессов, действие на организм
биологически активных веществ и лекарственных препаратов. Флуоресцентные зонды
применяются также для диагностики и прогноза развития заболеваний, выявления
факторов риска и контроля эффективности лечения. Зондовая флуоресценция
чувствительна к структурно-функциональным изменениям в биологических мембранах,
микровязкости ее липидного
бислоя, связыванию с белками и другими веществами, структурным
перестройкам в белках, изменению мембранного потенциала и концентрации внутри-клеточного
кальция и др. Анализируя спектр флуоресценции клеток и мембран, связанных с
зондом, можно определить полярность микроокружения флуорофора. Интенсивность и
время жизни флуоресценции зонда характеризуют подвижность сольватной оболочки,
поляризация флуоресценции – вращательную подвижность, ориентацию и вязкость
микроокружения зонда. Тушение флуоресценции зонда посторонними веществами
позволяет установить доступность флуорофора для тушителя, его локализацию в
белках и мембранах клеток и их проницаемость для тушителей, скорость диффузии.
По переносу энергии возбуждения с мембранных белков на флуоресцентный зонд и по
степени эксимеризации зонда можно определить расстояние между флуорофорами и
вязкость среды, окружающей зонд.
Одним из важнейших звеньев в молекулярном
механизме действия на организм биологически активных соединений является
мембрана. С помощью мембранных зондов можно определить сродство лиганда к
мембране, скорость
проникновения через нее
и его локализацию в клетках и тканях, выяснить связь проницаемости лиганда с
его активностью, изучить его действие на структуру и физико-химические свойства
мембраны и др. К мембранным зондам относятся такие вещества, как
1-анилинонафталин-8-сульфонат, пирен, перилен, 4-(n-диметиламиностирил)-N-метилпиридиния,
n-толуолсульфонат 4-(n-диметиламиностирил)-1-гексилпиридиния
и т. д. Такие зонды позволяют непосредственно наблюдать за процессом
проникновения веществ через мембрану, встраиваясь в нее и меняя свою
флуоресценцию под действием различных факторов и соединений.
Основным
механизмом, позволяющим с помощью зондов получить информацию об исследуемом
объекте – мембране, является индуктивно-резонансный перенос энергии, т. е.
энергии возбужденного состояния от донора к акцептору, который определяется в основном
диполь-дипольными взаимодействиями между ними. Такой обмен энергии может
осуществляться либо между различными молекулами, либо между частями одной и той
же молекулы.
Скорость переноса энергии зависит от степени
перекрывания спектра испускания донора со спектром поглощения акцептора,
относительной ориентации дипольных моментов переходов и расстояния между
молекулами. Данный перенос энергии является безызлучательным и содержит богатую
информацию, касающуюся строения молекул донорно-акцепторных пар. Любые явления,
влияющие на расстояние между донором и акцептором, будут воздействовать на
скорость переноса энергии, а следовательно, позволят их количественно
охарактеризовать.
Так, на основании изучения
индуктивно-резонансного переноса энергии между двумя хромофорами,
локализованными в разных участках эритроцитарной мембраны, было сделано
заключение, что под действием радиации в ней уменьшается эффективная толщина
гидрофобной области. В дальнейшем оно подтверждено исследованием параметров
флуоресценции зондов – пирена и 1,6-дифенил-1,3,5-гексатриена в облученных
мембранах эритроцитов крыс. После облучения происходило уменьшение
флуоресценции зондов и времени жизни возбужденного состояния по сравнению с
контрольной группой вследствие динамического тушения водой. При исследовании
физико-химического состояния мембран жировой ткани и печени крыс в отдаленные
сроки после γ-облучения и структурных изменений мембран было обнаружено
следующее. За счет переноса энергии с мембранных триптофанилов на пирен при
длине волны возбуждения 286 нм наблюдают флуоресценцию зонда, локализованного в
прибелковой части липидного бислоя (аннулярный липид), при возбуждении с длиной
волны 330 нм – пирена, локализованного как вблизи белка, так и в липидном слое
(общий липид). Рассчитанный коэффициент эксимеризации пирена позволил
установить структурную модификацию плазматических мембран жировой ткани и
печени крыс после однократного γ-облучения в дозе 1 г, выражающуюся в
увеличении микровязкости липидной фазы мембран как в прибелковой области, так и
в области суммарного липида. Для изучения структурных перестроек в мембранах
эритроцитов, митохондрий, жировой ткани и печени крыс после радиационного
воздействия использовался не только пирен, но и другие флуоресцентные
мембранные зонды (2-n-толуидиннафталин-6-сульфоновая
кислота, 4-диметиламинохалкон, перилен).
С помощью механизма индуктивно-резонансного
переноса энергии было изучено структурное и физико-химическое состояние мембран
эритроцитов у пациентов с хроническими заболеваниями печени. Выявлено
уменьшение эффективности переноса энергии с мембранных триптофанилов на пирен у
этих больных по сравнению с контрольной группой, что выражалось в снижении
количества белка, доступного тушению зондом. Уменьшение параметра эксимеризации
пирена свидетельствовало об увеличении микровязкости липидного бислоя мембран и
уменьшении его текучести. Полученные данные позволили сделать вывод о том, что
при хронических заболеваниях печени происходят значительные структурные
перестройки в белках мембран эритроцитов.
Мембранные
зонды можно использовать при диагностике таких заболеваний, как инфаркт
миокарда, нестабильная стенокардия, нейроциркуляторная дистония по
гипертензивному типу, хронический алкоголизм. Анализ параметров связывания
зондов ДСМ и ДСП-6 с мембранами эритроцитов позволил выявить
структурно-функциональные изменения мембран и дифференцировать отдельные группы
больных при перечисленных заболеваниях.
При
гипоксическом синдроме также были зафиксированы изменения в микровязкости
мембран эритроцитов и уменьшение интенсивности флуоресценции мембранного зонда
пирена.
Такие
зонды, как пирен, использовались для выявления нарушений в структуре мембран
клеток и изменения мембранного потенциала при гипертонической болезни,
экспериментальном гипертиреозе и миокардите, химическом канцерогенезе. С
помощью пирена обнаружены нарушения структуры микросом печени при авитаминозе
А. С помощью флуоресцентного зонда нистатина у больных гломерулонефритом было
показано снижение интенсивности
флуоресценции зонда в суспензии эритроцитов, что также позволило
оценить структурно-функциональное состояние мембран.
Нарушение переноса кальция через мембраны
лимфоцитов было выявлено при бронхиальной астме и других пульмонологических
заболеваниях с помощью зонда тетрациклина. С помощью (3-метоксибензантрон) и
пирена различали популяции Т- и В-лимфоцитов, а также субпопуляции Т-лимфоцитов
при бронхиальной астме. Выявлено снижение интенсивности флуоресценции зонда в
лимфоцитах в разной степени в зависимости от формы заболевания. Данный тест
позволил также оценить характер терапевтических воздействий. Акридиновый
оранжевый эффективно применялся для
оценки стадии аллергического процесса и определения чувствительности человека к
конкретному антигену.
Для
исследования злокачественных новообразований применялись такие зонды, как
тетрациклин, флуоресцеин, риодипин. Высокая чувствительность флуоресцентного
метода была продемонстрирована в определении ингибиторов холинэстеразы.
Авторами оценивалась интенсивность флуоресценции комплекса обратимого
ингибитора-флуорофора – этидиум бромида с бутирилхолинэстеразой в присутствии
ингибитора такрина. Определение активности холинэстеразы широко используется
при разработке лекарственных препаратов для лечения болезни Альцгеймера,
контроля содержания фосфорорганических пестицидов, обладающих
антихолинэстеразным действием в воде и пищевых продуктах.
Одним из используемых в медицине методов
является флуоресцентный метод определения эффективной концентрации альбумина в
крови. Альбумин в крови выполняет функцию связывания и транспорта к органам и
тканям различных веществ, таких как билирубин, жирные кислоты, стероидные
гормоны, производные аминокислот, лекарственные препараты, ксенобиотики и др.
Известно, что нарушение связывающей способности альбумина является причиной
различных патологических процессов. В основе данного флуоресцентного метода
лежит использование специального флуоресцентного красителя –
N-карбоксифенилимида диметиламинонафталевой кислоты (К-35), интенсивность
флуоресценции которого в сыворотке (плазме) крови пропорциональна числу
свободных центров связывания молекулы альбумина. Эта величина значительно
снижается при многих заболеваниях, но особенно сильно – при печеночной
недостаточности. Выявлено также существенное снижение этих показателей при
клинической характеристике эндогенной интоксикации при острых вирусных
гепатитах и оценено влияние сопутствующих заболеваний на флуоресцентные
показатели.
Были проведены также исследования флуоресцентных
показателей для определения общей и эффективной концентрации альбумина в
сыворотке и выпоте брюшной полости у больных перитонитом, которые выявили
изменения данных показателей в динамике заболевания как в выпоте, так и в
сыворотке. По результатам исследования сделан вывод о снижении концентрации альбумина
в крови и выходе его в экссудат в измененном состоянии. Аналогичным методом был
проведен сравнительный анализ альбумина и других клинико-лабораторных
показателей при гнойном перитоните. Показано значительное уменьшение
флуоресцентных показателей связывающей способности альбумина и увеличение
индекса токсичности. Причем в большинстве случаев данные флуоресцентного
анализа во многом превосходили общепринятые клинико-лабораторные тесты при
оценке тяжести состояния больного и по прогнозу развития заболевания.
Прогностическая
ценность альбуминового флуоресцентного теста была также подтверждена оценкой
исхода острых отравлений психотропными средствами.
Свойства
связывающих центров молекулы альбумина изучены у больных тревожной депрессией.
С целью более детального исследования кроме флуоресцентного теста на альбумин
применяли метод тушения флуоресценции зонда К-35 ионами нитрата. Выявлено
достоверное уменьшение константы тушения флуоресценции и его доли, доступной
тушению, в сыворотке больных по сравнению с контрольной группой, что
свидетельствует о значительных изменениях в связывающих центрах альбумина при
данной патологии.
Установлено
также нарушение микровязкости липидного бислоя при окислении диамидом белков
мембран эритроцитов. Повышение структурированности зоны аннулярных липидов и
снижение полярности липидного бислоя выявлено при изучении мембран эритроцитов
при воздействии перфтораном, обладающим кислородтранспортной функцией [6].
Макроскопический флуоресцентный анализ позволяет определить степень
микробиологического разложения (фоссилизации) костного материала. Метод основан
на способности коллагена к фотофлуоресценции.
При минерализации
(фоссилизации) происходит разложение органического компонента кости и замещение
гидроксиапатита апатитом и солями тяжёлых металлов. Так как это процесс
происходит при участии сапротрофных бактерий, в фоссилизированных костях могут
накапливаться биологические материалы бактериального происхождения.
Коллаген относят к
флуоресцентным белкам II класса. Его способность к флуоресценции определяется
наличием в структуре ароматических аминокислот: тирозина и фенилаланина.
Денатурация флуоресцентных белков всегда сопровождается потерей способности к
флуоресценции.
При освещении
ультрафиолетовой лампой, участки кости, в которых сохраняется вторичная
структура коллагена, флуоресцируют ярко-голубым светом, резко контрастиующим
как с бурой окраской фоссилизированной кости, так и с нерганическими
веществами, дающими тёмно-фиолетовую или красно-фиолетовую флуоресценцию.
Способность коллагена к ультрафиолетовой
флуоресценции позволяет контролировать процесс минерализации скелетного
материала, и выявить участки кости
пригодные для дальнейших
биохимических и генетических исследований [7].
Выводы: оптические методы
исследования биоструктур (тканей, клеток, белков) основаны на использовании
законов оптики, касающихся природы, распространения и взаимодействия с
веществом электромагнитного излучения оптического диапазона (видимый свет,
ультрафиолетовое и инфракрасное излучение).
Все
основные биохимические и клеточные компоненты тканей и крови обладают
характерными «индивидуальными» спектрами поглощения, отражения, рассеяния и
люминесценции. Эти спектры различны для разных мягких тканей и областей
уплотнений в них, для окисленного и восстановленного состояния молекул в
клетках ткани. Общее же процентное соотношение разных биохимических и
анатомо-морфологических компонент в тканях различно для состояния нормы и
заболевания органов и систем организма. Следовательно, общее функциональное и
патофизиологическое состояние тканей отражается на их общих оптических
свойствах, которые могут быть зарегистрированы методами лазерного и
люминесцентного анализа.
Поляризационная микроскопия
является одним из гистологических
методов микробиологической диагностики и находит
применение в цитологических исследованиях. При этом в поляризованном свете можно исследовать как
окрашенные, так и неокрашенные срезы тканей. Поляризационная микроскопия
необходима для изучения строения тканей, выявления патологических изменений и
болезнетворных микроорганизмов в клетках.
Голографический
метод позволяет регистрировать и воспроизводить более полную информацию об объекте.
Голограмму, образованную невидимыми электромагнитными волнами
(ультрафиолетовыми, инфракрасными и рентгеновскими), можно восстановить
видимым светом, меняя опорную длину волны. Эта особенность голографии позволяет
использовать ее как метод внутривидения.
Естественная
оптическая и магнитная оптическая активности позволяют получать ценные
сведения о конформациях биополимеров и их изменениях вследствие вращения
плоскости поляризации света.
Среди
современных оптических методов исследования биологических тканей особое место
занимают методы флуоресцентной спектроскопии. Флуоресценция биоткани несёт
информацию о концентрации и пространственном распределении её хромофоров и
флуорофоров, что позволяет судить о структуре биоткани, об интенсивности происходящих
в ней метаболических процессов и др.
Спектры
флуоресценции часто дают детальную информацию о флуоресцирующих молекулах, их
конформациях, комплексах, местах связывания и взаимодействиях с клетками и
тканями.
Достоинствами
метода атомно-флуоресцентного анализа являются сравнительно низкий уровень
фона; высокая селективность измерений; малые спектральные помехи, что позволяет
детектировать слабые аналитические сигналы и соответственно очень малые
абсолютные количества элементов; высокая чувствительность и быстродействие,
превышающая чувствительность таких методов, как радиоизотопный и
иммуноферментный. Кроме того, методы исследования флуоресценции относятся к
неразрушающим, а также не требуют большого объема пробы.
2.
ПРИБОРЫ ДЛЯ
ЛЮМИНЕСЦЕНТНОЙ ДИАГНОСТИКИ БИОСТРУКТУР
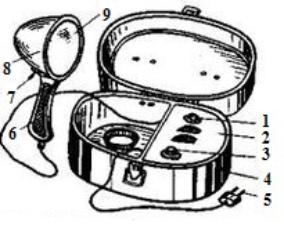
2.1. Ультрафиолетовый осветитель ОЛД-41
Осветитель для люминесцентной
диагностики ОЛД-41 предназначен для диагностики заболеваний методом
макроскопического люминесцентного анализа в условиях стационара.
Рис. 2.1. Конструкция осветителя «ОЛД-41»: 1-
сигнальная лампочка; 2- панель блока питания; 3- предохранитель-переключатель
напряжения; 4- футляр; 5- вилка сетевого провода; 6- рукоятка рефлектора; 7- выключатель рефлектора; 8- корпус
рефлектора; 9- светофильтр УФС-6
Источником ультрафиолетовых лучей в
осветителе ОЛД-41 служит газоразрядная ртутная лампа низкого давления ЛУФ-4
(УФО 4А) с фильтром из увиолевого стекла
марки УФС 6.
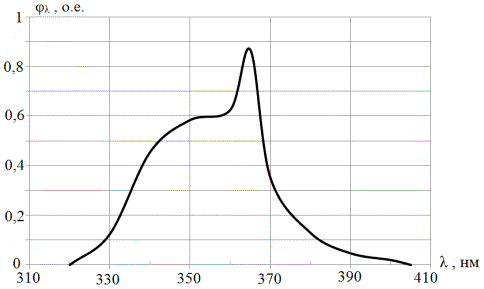
Рис. 2.2. Спектральная
характеристика осветителя ОЛД-41
Осветитель работает от сети
переменного тока напряжением 127 и 220 В. В блок питания входят понижающий
трансформатор, выпрямитель на полупроводниках, сигнальная лампа (9) и
предохранитель (7), который одновременно является переключателем напряжения с
220 на 127 В [8].
2.2. Спектрофлуориметрическое
оборудование
Поскольку флуоресцентный метод является очень
чувствительным, то для его применения необходимы не менее чувствительные
проборы. В лабораторной и научно-исследовательской практике для регистрации
спектров флуоресценции применяют спектрофлуориметры. Основными их узлами
являются источник возбуждающего света, монохроматоры для выделения как
возбуждающего, так и испускаемого света, фотоумножители и регистрирующее сигнал
электронное устройство (компьютер). Спектрофлуориметр должен быть снабжен
универсальными и надежными оптическими деталями – затворами, системой
расщепления светового пучка, поляризаторами, дифракционными решетками,
оптическими фильтрами и др. В свою очередь каждый из узлов прибора должен
соответствовать максимальным требованиям, предъявляемым к работе идеального
спектрофлуориметра:
1) источник света должен иметь постоянный выход
фотонов на всех длинах волн;
2) монохроматор должен пропускать фотоны всех
длин волн с равной эффективностью;
3) эффективность монохроматора не должна
зависеть от поляризации;
4) приемник (фотоумножитель) должен
регистрировать фотоны всех длин волн с одинаковой эффективностью.
К сожалению, выполнить одновременно поставленные
задачи невозможно. Поэтому в настоящее время для получения и регистрации
спектров флуоресценции используют различные виды спектрофлуориметров.
Спектрофлуориметр CM 2203
Полностью управляемый от компьютера спектрофлуориметр для ультрафиолетовой и видимой области спектра, обеспечивающий высокочувствительные и стабильные измерения спектров возбуждения, испускания, синхронных, поляризации, температурных, квантового выхода, поглощения жидких и твердых образцов. Производитель – СОЛАР (Беларусь).
Внешний вид прибора представлен на рис.2.3, а
его технические характеристики приведены в табл.2.1.

Рис.2.3.
Спектрофлуориметр CM
2203
Таблица
2.1
Технические
характеристики CM 2203
|
Характеристика |
Описание |
|
Монохроматор |
Двойной
со сложением дисперсии |
|
Выделяемый спектральный интервал |
Произвольный:
0–15 нм |
|
Точность
установки длины волны |
±0,5
нм |
|
Спектральный
диапазон |
200–820
нм |
|
Кюветное отделение |
Однопозиционный кюветодержатель |
|
Минимальный объем образца |
1
мл в стандартной 10 мм кювете |
|
Интерфейс |
RS232 |
|
Габариты |
608´644´271
мм |
|
Вес |
30
кг |
|
Энергопотребление |
220
(±10 %) В, 50Гц |
Измерительные функции:
¾ измерение спектров
испускания, возбуждения, поляризации, поглощения и пропускания;
¾ кинетические измерения
на одной, двух, трех длинах волн;
¾ измерения относительного
квантового выхода;
¾ многоволновые измерения
люминесценции и поглощения;
¾ измерение спектров
зависимости люминесценции от температуры;
¾ коррекция спектров
возбуждения и испускания;
¾ дифференцирование,
интегрирование, сглаживание, интерполяция;
¾ представление спектров в
шкале длин волн или волновых чисел;
¾ арифметические действия
между спектрами;
¾ автоматический поиск
максимумов и минимумов в спектре;
¾ автоматический и ручной
выбор масштаба изображения;
¾ создание и хранение
методик с последующим выполнением по ним конкретных заданий.
Высокая чувствительность, надежность,
широкая спектральная область работы и универсальный набор измерительных и
программных функций обеспечивают применение спектрофлуориметра СМ 2203 в различных областях: медицине,
биохимии, фармакологии, пищевой промышленности, экологии, химии, криминалистике
(измерения на уровне следов аминов, аминокислот, витаминов, ароматических
углеводородов, ферментов и других веществ) [9].
Спектрофлуориметр Флюорат-02-Панорама

Рис.2.4. Спектрофлуориметр
Флюорат-02-Панорама
Флюорат-02-Панорама – классический исследовательский спектрофлуориметр.
Имеются модификации прибора, позволяющие проводить измерения массовой
концентрации веществ в соответствии с утвержденными методиками. Производитель –
LUMEX (Россия).
Внешний
вид прибора представлен на рис.2.4, а его технические характеристики приведены
в табл.2.2.
Таблица 2.2
Технические
характеристики Флюорат-02-Панорама
|
Характеристика |
Описание |
|
Спектральный
диапазон в канале возбуждения |
210–840
нм |
|
Спектральный
диапазон в канале пропускания |
210–840
нм |
|
Спектральный
диапазон в канале люминесценции |
210–690
нм |
|
Спектральное
разрешение монохроматоров для
спектральных применений для
хроматографических |
–
не более 8 нм, –
не более 15 нм |
|
Погрешность
установки монохроматоров |
Не
более 3 нм |
|
Отношение
сигнал/шум для
приборов с разрешением 8 нм |
100:1 200:1
|
|
Объем
анализируемой пробы |
3
мл |
|
Питание |
110–220
В, 50–60 Гц |
|
Потребляемая
мощность |
Не
более 40 Вт |
|
Габаритные
размеры |
400×355×150
мм |
|
Масса |
13
кг |
Достоинства прибора:
¾ наличие монохроматоров в
каналах возбуждения и регистрации люминесценции;
¾ многофункциональность
прибора;
¾ реализованы режимы
хроматографических и спектральных измерений, измерений кинетики затухания
люминесценции;
¾ возможность сканирования
по каждому из монохроматоров как независимо, так и в режимах синхронного,
асинхронного и двумерного спектрального сканирования;
¾ измерение кинетики
фосфоресценции с шагом 0,05 мкс до 7000 мкс.
Принципы
метода:
¾ флюориметрический и
фотометрический;
¾ измерение спектров люминесценции
и/или оптического пропускания образцов;
¾ измерение времени
затухания люминесценции;
¾ спектральная селекция
осуществляется встроенными монохроматорами.
Процедура работы.
При флуориметрических исследованиях
производится измерение спектральных характеристик возбуждения и/или испускания
люминесценции исследуемых объектов в момент воздействия импульсов возбуждающего
света. При исследовании задержанной люминесценции (фосфоресценции)
анализируется кинетика затухания свечения при заранее выбранных условиях
возбуждения и регистрации люминесценции.
Прибор может использоваться в качестве внешнего
спектрофлуориметрического детектора систем ВЭЖХ,
капиллярного электрофореза и т.п. с возможностью перенастроек монохроматоров
для детектирования очередного пика в оптимальных условиях его регистрации.
При фотометрических исследованиях проводятся
измерения спектральных характеристик поглощения зондирующего излучения в
анализируемых объектах.
Широкое использование жгутов волоконных
световодов, соединяющих спектрофлуориметр с различными приставками, позволяет
создавать специализированные аналитические комплексы, ориентированные на
исследование спектрально-временных характеристик объектов, не помещающихся в
кюветное отделение прибора, в том числе объектов, замороженных до температуры
жидкого азота.
Спектральные области в каналах возбуждения и
регистрации люминесценции анализатора задаются встроенными светосильными
монохроматорами. Монохроматоры управляются независимо, аналитик может
запрограммировать любую функцию их состояний в процессе измерения, в частности,
можно проводить синхронное сканирование спектров. Оригинальная оптическая схема
обеспечивает высокую чувствительность прибора, особенно в ультрафиолетовой
области спектра, где фильтровая спектральная селекция затруднена.
Особенности применения.
Как сертифицированный анализатор, спектрофлуориметр «Панорама»
применяется для аналитического
контроля объектов
окружающей среды, санитарного контроля и контроля технологических
процессов.
Экологические
исследования – анализ
спектральных характеристик, растворенных/диспергированных в водных средах
нефтепродуктов, идентификация источников загрязнения нефтепродуктами акваторий
портов, рек и водоемов. Исследования процессов биодеградации нефтепродуктов в
природных водоемах вод воздействием внешних факторов. Исследования
биопродуктивности водоемов по флуоресценции хлорофилла-А.
Научные исследования – измерение спектральных
характеристик свечения (спектры возбуждения, фотолюминесценции, синхронные
спектры), определение времени затухания фосфоресценции. Исследования
органических и неорганических люминесцирующих веществ, люминесцентных меток,
внедренных в биологические объекты.
Медицинские
исследования –
исследования свечения биопрепаратов, бактерий, вирусов, в том числе с
возможностью использования ПЦР-технологии (с приставкой МИКРОСКАН).
Технология – контроль спектральных
характеристик бумаги, в том числе используемой для печатания банкнот и ценных
бумаг. Анализ спектральной чистоты люминофоров, иных люминесцирующих порошков.
Геология – исследования гидрогеологических процессов
методом «флуоресцирующей метки» [10].
2.3. Микроспектрофлуориметрические приборы
Микроспектрофлуориметр
на базе стандартных деталей и узлов является
наиболее простым в изготовлении и заслуживает описания, так как его
принципиальная схема, приведенная на рис. 2.5, послужила основой нескольких
модификаций.
Основным элементом оптической схемы
прибора служит трехпризменный светосильный спектрограф ИСП-51 со стеклянной
оптикой на область спектра от 370 до 1000 нм. Сочленение спектрографа 1 с микрообъективом 14, достигается
тем, что входная щель 7
спектрографа помещена в плоскость промежуточного изображения
микроскопа, состоящего из микрообъектива 14 и окуляра Гюйгенса
4 (линзы 6 и 8).
Оптическая система микроспектрофлуориметра при регистрации
спектров люминесценции
клеток работает следующим образом. Источник света - ртутная
дуговая лампа 25
типа ДРШ-250 (или ДРШ-100) - освещает
коллекторную линзу 24,
действующие размеры которой ограничиваются диафрагмой 23. После
этого световой поток проходит через водный теплофильтр 22 (4%-ный раствор СuSO4) и светофильтры 21, выделяющие необходимую для возбуждения люминесценции линию
излучения ртути. Все эти детали представляют
собой единый узел 20, в качестве которого используется система освещения люминесцентного
осветителя ОСЛ-1. Возбуждающее люминесценцию излучение отражается
опак-иллюминатором ОИ-17 с интерференционной светоделительной пластинкой 12 и микрообъективом 14, установленным
в стандартном револьверном держателе от любого биологического микроскопа,
направляется на микрообъект 15. При этом в
плоскость микрообъекта проецируется изображение диафрагмы 23, являющейся, таким образом, полевой диафрагмой.
Свет люминесценции препарата, собранный высокоапертурным
микрообъективом 14
и прошедший через пластинку 12 с
интерференционным покрытием, поворотным зеркалом 11 (деталь осветителя
ОСЛ-1) и линзой 6,
направляется в спектрограф ИСП-51. При этом в плоскости
входной щели 7 спектрографа находится промежуточное люминесцентное изображение
микрообъекта. Таким образом, входная щель 7 спектрографа вырезает требуемый
участок увеличенного изображения исследуемой клетки. Этот участок и его
расположение во входной щели спектрографа можно визуально наблюдать при
введении в ход лучей поворотной призмы 3. В этом положении
призма 3 вместе с линзами 6 и 8 представляет собой видоизмененный окуляр Гюйгенса, в
плоскости полевой диафрагмы которого размещена входная щель спектрографа.
Промежуточное изображение объекта исследования в плоскости
полевой диафрагмы окуляра Гюйгенса (входной щели 7 спектрографа)
рассматривается с помощью визирной трубки 4 от фотонасадки типа МФН-1. При этом окончательно выбирается
для исследования участок микрообъекта. Затем поворотная призма 3 выводится из хода лучей и световой
поток из входной щели поступает в коллиматор спектрографа. В качестве узла
поворотной призмы 3 может быть
использован с незначительной переделкой узел призм насадки сравнения ОКС-1.
Свет люминесценции выбранного участка объекта исследования, ограниченного
входной щелью, разлагается призмами в спектр, изображение которого фокусируется
выходным объективом фотокамеры в плоскость кассеты для фотопластинок, где
устанавливается выходная щель спектрографа. Непосредственно за ней находится
фотокатод фотоэлектронного умножителя типа ФЭУ-51 со спектральной
чувствительностью от 400 до 800 нм.
Таким образом, регистрирующий узел вместе с выходной щелью и
кожухом ФЭУ и его делитель напряжения может быть установлен вместо обычной
кассеты для фотопластинок. Разрешающая способность спектрографа при этом
несколько ухудшается, однако для широких линий люминесценции биологических
объектов это улучшение не столь существенно.
Препарат 15 размещается
на предметном столике 16 от
микроскопа МС-51. С помощью конденсора 17,
зеркала 18 и осветителя 19 (типа ОИ-19) возможно освещение
препарата проходящим светом от лампы накаливания. Такое освещение может быть
полезным для предварительного выбора участка клетки без излишнего освещения его
лучами сине-фиолетовой или УФ-области спектра.
Излучение этого же источника света,
выделенное узкополосным интерференционным светофильтром, может быть
использовано для контроля рассеивающих свойств изучаемой области объекта, как
это упоминалось выше.
Описываемый прибор позволяет изучать также спектры
люминесценции раствора в кюветах. Для этого возбуждающее люминесценцию
излучение может направляться дополнительными зеркалами 34 и 9 на кювету
10 с исследуемым веществом.
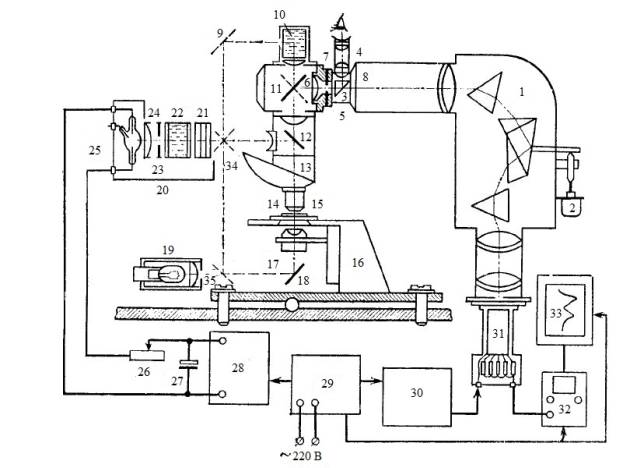
Рис. 2.5. Блок-схема микроспектрофлуориметра на базе стандартных
деталей и узлов: 1 – призменный монохроматор (ИСП-51); 2 – мотор развертки
спектра; 3 – поворотная призма; 4 –
визирная трубка; 5 – узел входной щели; 6 – 8 – линзы окуляра Гюйгенса ×4; 7 – входная щель монохроматора
(полевая диафрагма окуляра Гюйгенса); 9, 11, 18, 34, 35 – зеркала; 10 – кювета;
12 – светоделительная пластинка с интерференционным покрытием; 13 –
револьверный держатель микрообъективов; 14 – объектив; 15 – препарат; 16 –
предметный столик; 17 – конденсор; 19 – осветитель с лампой накаливания; 20 –
блок осветителя ОСЛ-1 в сборе; 21 – светофильтры; 22 – жидкостный теплофильтр;
23 – ирисовая диафрагма; 24 – коллекторная линза; 25 – дуговая лампа ДРШ-250;
26 – реостат; 27 – блок электролитических конденсаторов фильтра; 28 –
выпрямитель; 29 – электронный стабилизатор сетевого напряжения; 30 –
стабилизированный источник высокого напряжения; 31 – фотоумножитель; 32 – милливольтметр (рН-метр ЛПУ-01); 33 –
самописцы.
Поворотное зеркало 11
переключается при этом в верхнее положение и направляет свет
люминесценции кюветы во входную щель 7 спектрографа. На практике, однако,
особенно при наличии контактных микрообъектов, удобнее бывает производить эти исследования в
микрокюветах, размещенных на предметном столике вместо микропрепарата 15. Развертка спектра в описываемой
первой модели микроспектрофлуориметра осуществлялась мотором 2 типа РД-0,9, на валу которого были
закреплены контакты метчика длин волн.
Ценным качеством описанной выше базовой модели является
простота ее изготовления из узлов по сути дела снятых с вооружения современных
лабораторий оптических приборов. Обладая высокой чувствительностью, эта модель
микроспектрофлуориметра может быть использована для исследования спектров
люминесценции клеток в области 500—700
нм без коррекции регистрируемой кривой на
спектральную чувствительность установки.
Основным недостатком модели являлся завал спектральной
характеристики в области от 400 до 500 нм, определяемый спектральной
характеристикой стандартной «желтой» интерференционной светоделительной
пластинки 12 опак-иллюминатора
ОИ-17, использованного в описанном микроспектрофлуориметре. «Желтая» пластинка
отражает излучение в области 380–460 нм, используемое для возбуждения
люминесценции, и пропускает с малыми искажениями свет люминесценции объекта в
области >530 нм. Расширить спектральный диапазон микроспектрофлуориметра
можно, заменив эту пластинку на «синюю» светоделительную пластинку.
В сущности, описанный микроспектрофлуориметр нельзя назвать
прибором. Скорее – это в значительной мере универсальная установка, в состав
которой могут входить дополнительные устройства, поставляющие информацию о
функциональном состоянии исследуемого объекта, регистрируемую на том же
многоканальном самописце синхронно с оптическими характеристиками.
Приведенная установка в течение ряда лет успешно
используется для спектральных исследований собственной люминесценции нервных,
мышечных и растительных клеток, а также суспензий митохондрий. Она же
применяется при изучении биолюминесценции и взаимодействия красителей-меток с
органоидами клеток и целыми клетками.
Как видно из рис. 2.5 , особенностью установки является то,
что осветитель 20, микроскоп и
предметный столик 16 не связаны
жестко друг с другом. Это имеет как свои преимущества, так и свои недостатки.
Основным преимуществом такой системы является то, что вокруг
предметного столика имеется значительное свободное пространство. Это дает
возможность закреплять на предметном столике мелких животных (лягушка, крыса)
при исследовании их клеток в невыделенном из живого организма виде, т. е. in
situ. Известно, что при исследованиях функциональных механизмов живой
клетки, т. е., по сути дела, при изучении физиологии клетки, наиболее трудной
для экспериментатора задачей
является обеспечение ей нормальных условий существования. В случае же
исследования клеток in situ вся
ответственность за их жизнеобеспечение возлагается на само подопытное
животное, и полученные таким образом данные наиболее полно отражают суть
протекающих в живой клетке процессов. При исследовании in situ клетки более крупных животных (кролик, собака) предметный
столик 16 может быть временно
удалён из установки.
Недостатки такой системы очевидны. Это, прежде всего, ее
малая жесткость. В результате проведение морфологических исследований при
больших увеличениях затруднено. Отсутствие фотоаппарата также несколько снижает
универсальность [11].
Бесщелевой микроспектрофлуориметр
с фоторегистрацией Схема приведена на рис.
2.6. Источник света 1 освещает коллекторную линзу 2. Ограниченный щелевой диафрагмой 3 равномерно светящийся
участок линзы 2 проектируется микрообъективом 6 в плоскость микрообъекта 7 с помощью
интерференционной светоделителъной пластинки 5. Введенный в ход лучей светофильтр 4 выделяет требуемую для
возбуждения люминесценции линию излучения ртутной лампы 1. Таким образом,
люминесцирующий участок имеет щелевидную форму.
Микрообъектив 6 собирает свет люминесценции щелевого участка
микрообъекта 7, и с помощью плоской дифракционой решетки 9 в нулевом порядке
создается увеличенное изображение щелевидной области микрообъекта 7 в свете его
люминесценции. В другом участке плоскости 10 в первом порядке дифракционной решетки 9 получается спектральное
разложение света люминесценции этой же области микрообъекта.
В составе попадающего на
решетку 9 светового пучка имеется также частично прошедшая через запирающий
светофильтр 8 возбуждающая люминесценцию линия излучения дуговой лампы 1, отраженная от
покровного стекла микрообъекта 7. Изображение этой линии в спектре первого порядка
дифракционной решетки может быть использовано в качестве реперной точки при
последующей обработке фотопленки на микрофотометре с целью получения спектра
люминесценции объекта в графической форме.
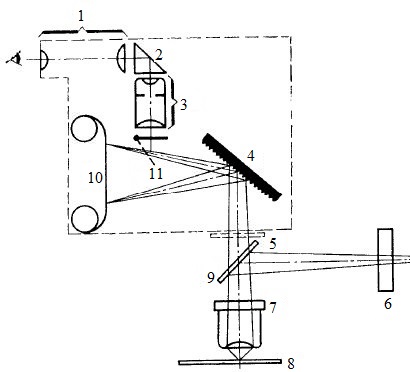
Рис.
2.6. Схема бесщелевого
микрофлуориметра с фоторегистрацией:1– визирная трубка; 2– поворотная 1 Tf-0.00
призма; 3– окуляр; 4– отражательная реплика дифракционной
решетки; 5– запирающий светофильтр; 6– светофильтр; 7– микрообъектив; 8–
препарат; 9– интерференционная светоделительная пластинка; 10 – фотопленка; 11–
зеркало
Для предварительного
просмотра микрообъекта 7 и выбора подлежащего спектральному исследованию участка его в ход
лучей нулевого порядка микрообъектива 6 и дифракционной решетки 9 вводится зеркало 11, направляющее световой
поток в плоскость полевой диафрагмы окуляра 12. Полученное в этой плоскости изображение
визуально просматривается с помощью визирной трубки 14 и поворотной призмы 13. Система описанного типа
может найти применение в полевых условиях [11].
Выводы: в главе были рассмотрены современные приборы, позволяющие
наблюдать и измерять люминесценцию биополимеров. Основные медицинские и научные
исследования, о которых говорилось выше, выполняются на флуориметрах
иностранного производства: Hitachi F 4000, Hitachi-850 (Япония), SLM-4800,
MPF -44B (США), СМ-2203 (Республика Беларусь), а также отечественного:
СФЛ-2, ЦФИ РМИ-81, БИАН-130 и Флюорат-02-Панорама. Отличия флуориметров друг от
друга заключаются в спектральной ширине щелей, области возбуждения и области
регистрации спектра, в чувствительности и комплектации. В
качестве источника света практически все флуориметры используют ксеноновые
лампы различной мощности. В последнее время неплохо зарекомендовал себя
спектрофлуориметр СМ-2203 производства фирмы «SOLAR». Кроме хорошего
спектрального диапазона для возбуждения и регистрации спектра, он обладает
высокой чувствительностью, дополнительными возможностями для регистрации
спектра поглощения, поляризации флуоресценции и термостатируемости образца,
может использоваться как фотометр. Поэтому современные приборы открывают
большие возможности для использования всех преимуществ зондовой и собственной
флуоресценции веществ в медицине.
3.
СПЕКТРОФЛУОРИМЕТРИЧЕСКИЕ
ИССЛЕДОВАНИЯ ШЛИФОВ КОСТНЫХ ТКАНЕЙ
3.1. Общие сведения о
костных тканях
Костная ткань - один из видов
соединительной ткани,
состоящей из трех видов клеток и обизвествленного межклеточного
матрикса.
Клетки составляют »1-2% от всего объема
костной ткани, остальной объем занят порами и каналами (для компактной костной ткани пористость составляет 13-18%,
для губчатой она выше) и твердой фазой - органическими и минеральными составляющими костных пластинок.
Органическая составляющая (40-50% твердой фазы)
представлена коллагеном. Минеральная составляющая (50-60% твердой
фазы) - преимущественно
кристаллы гидроксилапатита Са10 (РО4 ) 6 (ОН)2 и других солей кальция.
В пределах пластинки коллаген - минеральные
волокна ориентированы в определенном направлении и соединены связующим
веществом.
3.2. Метод
макроскопического люминесцентного анализа костных шлифов
Макроскопический
люминесцентный анализ позволяет определить степень микробиологического
разложения (фоссилизации) археологического и палеонтологического костного
материала, что может иметь решающее значение при отборе материала для
биохимических и генетических исследований. Метод основан на способности
коллагена к фотолюминесценции - люминесценции инициированной ультрафиолетовым
облучением.
Коллаген кости обладает способностью к
ультрафиолетовой люминесценции, что обусловлено наличием в структуре белка
аминокислот тирозина и фенилаланина. При фоссилизации (минерализации кости) происходит
разрушение третичной структуры коллагена, сопровождающееся потерей способности
к люминесценции, поэтому, оценивая ультрафиолетовую люминесценцию кости, мы определяем степень сохранности
коллагена.
Исследования приводились следующим образом:
1. В интересующих местах делаются распилы
изучаемых костей толщиной 5 – 10 мм.
2. Распилы шлифуются на шлифовальных кругах
убывающей зернистости.
3. Распилы и шлифовка проводятся на
шлифовальной машине ШМ-1 с использованием отрезных дисков и шлифовальных кругов,
применяемых в стоматологии.
4. Проводится цифровая фотосъёмка шлифа при
обычном и ультрафиолетовом освещении. Для чего:
4.2. Проводится фокусировка камеры при обычном
освещении,
4.3. Проводится блокировка автофокуса,
4.4. Проводится съёмка шлифа при обычном
освещении,
4.5. Проводится съёмка шлифа при освещении
диагностическим ультрафиолетовым осветителем ОЛД-41(рис. 3.1).
5. Далее с помощью программы Adobe
Photoshop определяется процент
сохранности коллагена кости. Для чего:
5.1. С помощью инструмента «Лассо»
оконтуривается поперечный срез компактного вещества кости, при этом в контур не
включаются проекция боковой поверхности кости, которая может оказаться на
фотографии, костный канал и губчатое вещество кости (рис. 3.2).
6. Создание черно-белого изображения.
6.1. В меню «Изображение» выбирается подменю
«Настройки» и пункт «Уровни» (рис. 3.3).
6.2. С помощью инструмента “пипетка” в качестве
белого цвета выбирается цвет флюоресцирующего коллагена – самый яркий голубой
цвет фотографии (рис. 3.4).
6.3. В качестве черного цвета выбирается цвет
фоссилизированной (разложившейся) кости в зависимости от конкретной фотографии
(рис. 3.5).
6.4. Нажать кнопу <ОК> (рис. 3.6).
Перейти в меню «Изображение», подменю «Режим»,
пункт «Чёрно-белый» (рис. 3.7).
7. Оценка черно-белого изображения.
7.1. В меню «Изображение» выбирается подменю
«Гистограмма» (рис. 3.8).
7.2. На гистограмме считывается показание
пункта «Значение» (рис. 3.9), далее
рассматриваемый как «f».
7.3.
Учитывая, что значение гистограммы для
полностью сохранной кости (белой поверхности) составляет 255 единиц,
степень фоссилизации шлифа определяется
по формуле: F = 1- f/255 Результат
может выражаться как в процентах, так и в десятичных дробях.
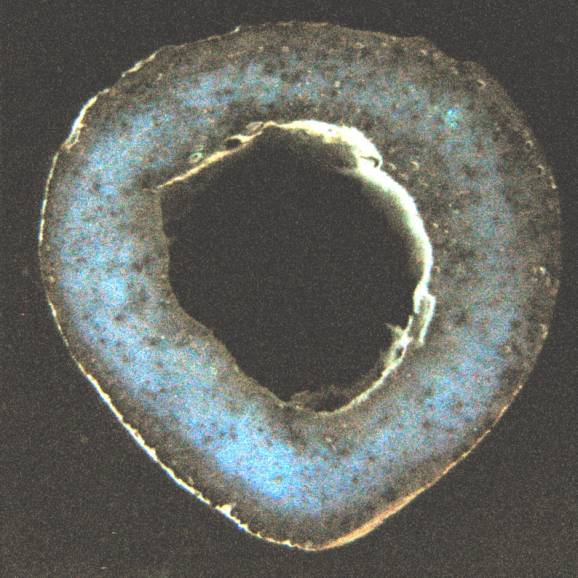
Рис. 3.1. Поперечный шлиф медиального участка бедренной кости.
Съёмка при ультрафиолетовом освещении
Рис. 3.2. Оконтуривание при
помощи инструмента «Лассо»
Рис. 3.3. Выбор пункта меню
«Уровни»
Рис. 3.4. Использование инструмента «Пипетка» (выбор
белого цвета)
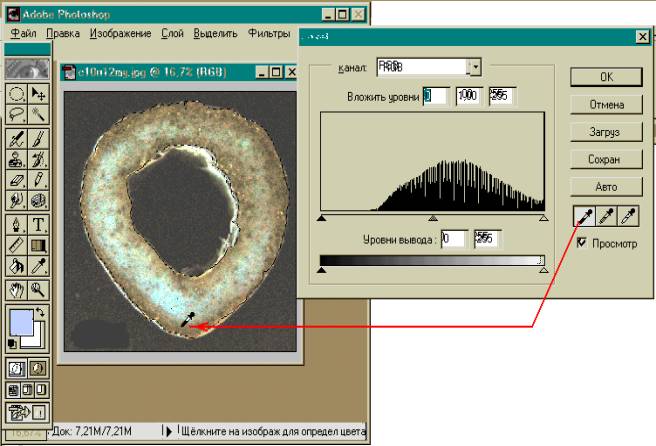
Рис. 3.5. Использование инструмента «Пипетка» (выбор
черного цвета)
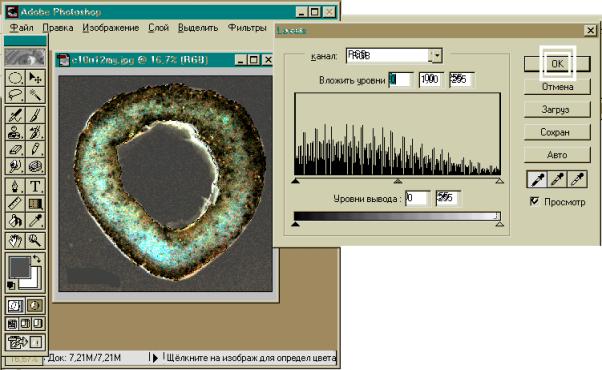
Рис. 3.6. Результат использования
инструмента «Пипетка»
Рис. 3.7. Выбор
пункта меню «Чёрно-белый»
Рис. 3.8. Выбор подменю «Гистограмма»
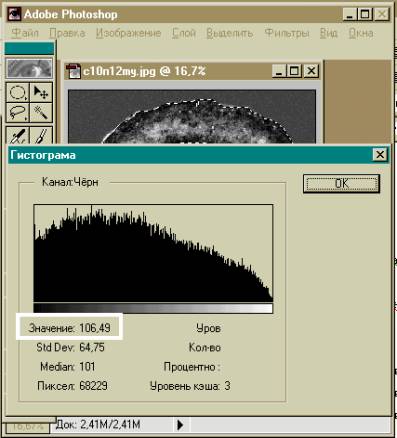
Рис. 3.9. Оценка степени фоссилизации
Разработанная методики
позволяют проводить как качественное определение сохранного коллагена, что
необходимо при выделении остеологического материала для дальнейших
биохимических исследований, так и его количественное определение.
Исследование костных шлифов
из музея СГМА показало полную сохранность коллагена шлифов, что указывает на
то, что методы применяемые для
анатомической препаровки кости: вываривание, отбеливание и т.д. не
приводят к деструкции коллагена [7].
3.3. Методика измерений
на спектрофлуориметре Флюорат-02-Панорама
Исследование спектров возбуждения и люминесценции.
Наиболее полно реализовать измерительные возможности прибора
Флюорат-02-Панорама и приборных комплексов на его основе можно только при
использовании внешнего компьютера с установленным программным обеспечением (ПО)
«Panorama Pro». ПО
предназначено для управления спектрофлуориметром при проведении
хроматографических, спектрофото- и спектрофлуориметрических, хеми- и биолюминесцентных
измерений, а также при определении спектральных характеристик внешних
источников излучения.
Математическая обработка результатов измерений осуществляется
средствами поставляемого программного обеспечения или иными программными
продуктами, для чего предусмотрен экспорт результатов измерения в форматы ASCII
и MS Excel.
Для проведения спектральных измерений необходимо
выбрать пункт «Спектральные» в
меню «Измерения» в окне программы.
Рабочее поле в этом случае примет вид, показанный на рис. 3.10.
На вкладке «Измерение»
можно выбрать:
·
Тип сканирования (по возбуждению, регистрации,
синхронное, с переменным углом);
·
Параметры сканирования в соответствии с выбранным
типом;
·
Параметр усреднения;
·
Режим математической коррекции;
Возможны следующие типы сканирования: по
возбуждению, по регистрации, синхронное и с переменным углом.
При сканировании по возбуждению необходимо для монохроматора возбуждения задать
спектральный диапазон (поля От и
До) и Шаг, а для монохроматора регистрации - постоянную длину волны.
При сканировании по регистрации необходимо для
монохроматора возбуждения задать постоянную длину волны, а для монохроматора
регистрации - спектральный диапазон (поля От и До) и Шаг.
При синхронном сканировании одновременно изменяется
и длина волны возбуждения, и длина волны регистрации. При этом поддерживается
постоянное смещение монохроматора регистрации относительно настройки
монохроматора
возбуждения. Величина этого смещения может
задаваться либо в нанометрах, либо в обратных сантиметрах. Параметрами
сканирования являются спектральный диапазон (поля От и До) и Шаг для монохроматора возбуждения, а
также величина и единицы смещения для
монохроматора регистрации.
При сканировании с «переменным углом» также
одновременно изменяется и длина волны возбуждения, и длина волны регистрации.
Отличие состоит в том, что шаг перестройки монохроматора регистрации может быть
не равным шагу перестройки монохроматора возбуждения. Параметрами являются
спектральный диапазон (поля От и
До) и Шаг для монохроматора возбуждения и спектральный диапазон (поля От и До) для монохроматора регистрации. Шаг монохроматора регистрации
вычисляется путем деления диапазона сканирования на количество шагов
монохроматора возбуждения.
Параметр усреднения задает количество элементарных
измерений (вспышек лампы), результат которых будет усредняться для вывода одной
точки графика. С увеличением параметра усреднения уменьшается уровень шума, но
растет полное время сканирования.
Построение трехмерных
графиков (двумерное сканирование)
Двумерное сканирование позволяет получить полную информацию о
люминесценции изучаемого объекта. Длины волн монохроматоров возбуждения и регистрации изменяются независимо друг от друга с заданным шагом, образуя сетку точек на
плоскости. Интенсивность люминесценции
измеряется в каждой точке сетки и представляется в виде поверхности в
трехмерном пространстве. Для
проведения измерений необходимо выбрать пункт «Двумерное Сканирование» в меню «Измерения» (рис. 3.11).
Главным отличием этого окна от окон
других измерений является наличие
двух областей отображения графической информации. В левой части находится обычный двумерный график, на
котором отображается результат
одного прохода сканирования «быстрого» монохроматора. В правой части отображается полный результат в
виде проекции трехмерной
поверхности.
На вкладке «Измерение» рабочей
панели можно выбрать:
• Тип сканирования,
• Параметры области сканирования,
• Параметр усреднения,
• Параметр сглаживания,
• Режим математической коррекции,
• Угол поворота трехмерного графика
относительно вертикальной оси.
Тип сканирования определяет, какой из монохроматоров является «быстрым»,
т.е. осуществляет сканирование в заданном диапазоне при фиксированном положении
другого («медленного») монохроматора.
Область сканирования
задается путем задания интервалов сканирования (поля От, До и Шаг) для каждого из монохроматоров.
Для медленного монохроматора значение поля «От» может быть больше значения поля «До», что приводит к сканированию от больших длин волн к меньшим,
полезному при исследовании веществ, нестойких к воздействию жесткого
ультрафиолетового (λрег > λвозб, флажок Стокс), антистоксову область (λрег < λвозб, флажок Анти-Стокс) и запретную зону – область, для которой |λрег – λвозб| < Δзапр. В запретной зоне пересекаются крылья спектрального пропускания
монохроматоров возбуждения и
излучения. Из области
сканирования можно исключить стоксову область регистрации, что для мутных или
рассеивающих растворов приводит к большим ложным сигналам и может вызвать
зашкаливание в канале люминесценции.
Сглаживание позволяет уменьшить
уровень шума сигнала без увеличения параметра
усреднения и, таким образом,
позволяет существенно уменьшить время измерения. Параметр сглаживания задает
ширину окна двойного кубического сглаживания, нулевое значение соответствует
отсутствию сглаживания. Изменять параметр сглаживания можно в любой момент до
начала, в процессе или после
завершения измерения. Угол
поворота определяет способ
построения проекции трехмерной
поверхности на плоскость
экрана. Для изменения угла
(вращения графика) можно
воспользоваться одним из
следующих способов: Для
запуска измерений следует
нажать кнопку Старт. Данные, получаемые во время одного прохода
сканирования «быстрого»
монохроматора показываются
обычным образом на двумерном графике
(в несглаженном виде).
По завершении прохода
полученный спектр сглаживается и добавляется
на трехмерный график.
По завершении измерения щелчком левой кнопки мыши по линии на трехмерной
поверхности можно просмотреть соответствующий спектр на двумерном графике.
Выделенная таким образом линия показывается красным цветом.
Параметры прибора (чувствительность ФЭУ, задержка и длительность строба),
с которыми производилось измерение, запоминаются в файле результатов. Для их
просмотра предусмотрена вкладка Параметры.
При необходимости повторить измерение с теми же самыми значениями параметров
можно воспользоваться кнопкой Установить.
При нажатии правой кнопки мыши в области
трехмерного графика появляется контекстное меню, содержащее пункты:
·
Копировать таблицу –
скопировать данные в буфер обмена Windows в текстовом формате. Эти данные можно вставить в текстовый документ
или электронную таблицу.
·
Копировать график –
скопировать данные в буфер обмена Windows в графическом формате.
·
Поиск максимума – поиск
абсолютного максимума на трехмерной поверхности. Спектр, которому принадлежит
максимум, показывается на двумерном графике, а на точке максимума
устанавливается маркер.
3.4. Результаты
измерений костных шлифов
Исследования проводились
с помощью спектрофлуориметра «Флюорат-02-Панорама» с выставлением
соответствующих настроек в программном обеспечении «Panorama Pro».
Костный шлиф устанавливался на торец волоконного световода, закрывался крышкой,
внутренняя поверхность которого покрыта черным бархатным материалом. Исключали
внешние помехи: солнечный свет и излучение ламп.

Рис. 3.12.
Волоконный
световод на подставке

Рис.3.13. Установка костного шлифа
на торец световода

Рис. 3.14. Крышка для исключения
внешних засветок
Для
анализа спектров костных шлифов необходимо выполнить 5 последовательных
измерений:
1.
Спектр возбуждения
шлифов при синхронном сканировании;
2.
Спектр люминесценции
шлифов;
3.
Спектр возбуждения
шлифов;
4.
Двумерный спектр
возбуждения шлифов;
5.
Двумерный спектр
люминесценции шлифов.
Для измерения
синхронного спектра возбуждения во вкладке «Измерения» выбираем «Спектральные»,
далее выбираем «Синхронное». Вводим необходимые параметры в поля программы,
такие как: шаг (1 нм), чувствительность средняя, смещение (20 нм), длительность
строба (1,0 мкс), число вспышек (25), диапазон измерений (180…800 нм).
Для измерения спектра люминесценции
во вкладке «Измерения» выбираем «Спектральные», далее выбираем «По
регистрации». Рабочий диапазон и длина волны возбуждения соответствует
максимуму синхронного спектра из п.1.
Для измерения спектра
возбуждения во вкладке «Измерения» выбираем «Спектральные», далее выбираем «По
возбуждению». Рабочий диапазон и длина волны регистрации соответствует
максимуму спектра люминесценции из п.2.
Для измерения двумерного
спектра возбуждения во вкладке «Измерения» выбираем «Двумерное», далее выбираем
«По возбуждению». Вводим необходимые параметры в поля программы, такие как: шаг
(1 нм), чувствительность средняя, длительность строба (0,8 – 1,0), число
вспышек (50), диапазон измерений выбираем из п.2 и п.3, выделить поля «Стокс»,
«Антистокс».
Для измерения двумерного
спектра люминесценции во вкладке «Измерения» выбираем «Двумерное», далее
выбираем «По регистрации». Вводим необходимые параметры в поля программы, такие
как: шаг (1 нм), чувствительность средняя, длительность строба (0,8 – 1,0),
число вспышек (50), диапазон измерений выбираем из п.2 и п.3, выделить поля «Стокс», «Антистокс». На
рис. 3.15 представлен синхронный спектр возбуждения костного шлифа 1С.
Шлиф 1С
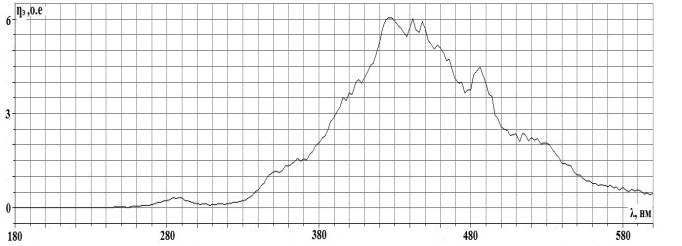
Рис. 3.15. Спектр возбуждения
шлифа при синхронном сканировании
Из рис. 3.15 видно, что
спектр возбуждения костного шлифа имеет несколько максимумов, один из которых
находится на длине волны 425 нм, а другой 486 нм. Как показали исследования,
максимум на длине волны 486 нм – ложный и связан с шумами прибора.
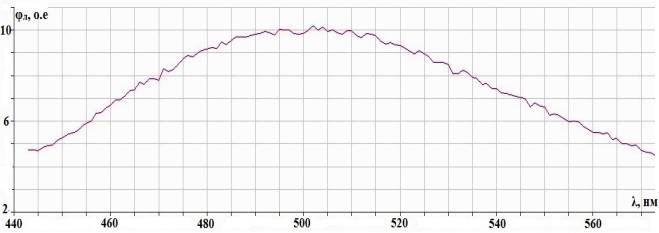
Рис. 3.16. Спектр люминесценции
шлифа
Из рис. 3.16 видно, что
спектр люминесценции шлифа имеет максимум на длине волны 502 нм. Форма кривой –
колоколообразная.
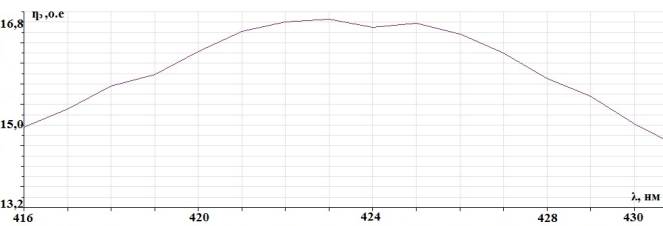
Рис. 3.17. Спектр возбуждения
шлифа
Максимум спектра возбуждения лежит в диапазоне
длин волн 422-425 нм.
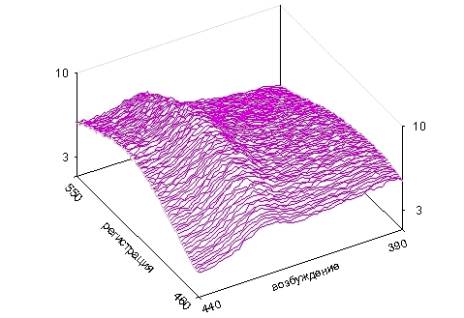
Рис. 3.18. Двумерный спектр
возбуждения шлифа
Рис. 3.18,
иллюстрирующий поведение спектра при двумерном сканировании возбуждения шлифа,
показал, что максимум возбуждения остаётся постоянным для широкого спектра
люминесценции и соответствует интервалу
длин волн от 422 нм до 425 нм.
Двумерный спектр
люминесценции шлифа приведен на рис. 3.19.
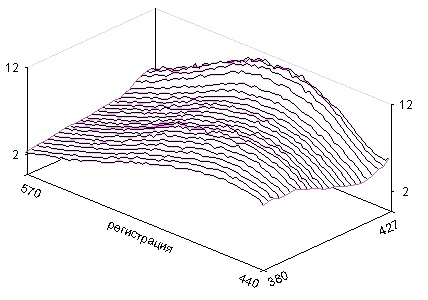
Рис. 3.19. Двумерный спектр
люминесценции шлифа
Двумерное сканирование
по регистрации показало, что максимум люминесценции смещается в длинноволновую
область при увеличении длины волны возбуждения.
Шлиф П25
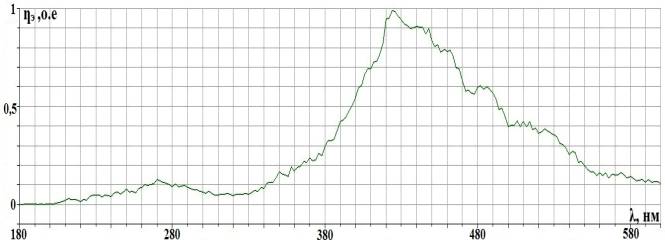
Рис. 3.20. Спектр возбуждения
шлифа при синхронном сканировании
По синхронному спектру
определили, что максимум возбуждения костного шлифа на длине волны 422 нм.
Рис. 3.21. Спектр возбуждения и
люминесценции шлифа
Из рис. 3.21 видно, что
спектр люминесценции шлифа имеет максимум в диапазоне длин волны 484-492 нм. По
интенсивности люминесценция слабая. Спектр возбуждения имеет выраженный
максимум на длине волны 422 нм.
Рис. 3.22. Двумерный спектр
возбуждения шлифа
Рис. 3.22, иллюстрирующий поведение спектра при двумерном сканировании возбуждения шлифа, показал, что максимум возбуждения не меняется при изменении длины волны люминесценции и соответствует интервалу длин волн от 418 нм до 426 нм.
Двумерный спектр люминесценции
костного шлифа приведен на рис. 3.23.
Рис. 3.23. Двумерный спектр
люминесценции шлифа
Шлиф К5
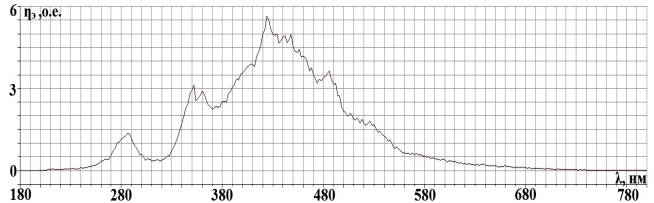
Рис. 3.24. Спектр возбуждения
шлифа при синхронном сканировании
Из рис. 3.24 видно, что спектр возбуждения костного шлифа имеет несколько максимумов на длинах волн 360 нм и 424 нм, а на 286 нм и 486 нм ложные.
Рис. 3.25. Спектры люминесценции
шлифа
На рис. 3.25 изображены
2 спектра люминесценции шлифа, различные по интенсивности, максимумы которых
находятся на интервалах длин волн 425-440 нм и 490-515 нм.
Рис. 3.26. Спектры возбуждения
шлифа
Шлиф имеет 2 максимума в спектре возбуждения на
длинах волн 360 нм (срез по интенсивности является последствием введении
отрезающего светофильтра в монохроматоре) и 424 нм.
Рис. 3.27. Двумерный спектр возбуждения
шлифа
Рис. 3.27,
иллюстрирующий поведение спектра при двумерном сканировании возбуждения шлифа,
показал, что спектр возбуждения с максимумом на длине волны 360 нм шире, чем
спектр с максимумом на 424 нм.
Двумерный спектр
люминесценции шлифа приведен на рис. 3.28.
Рис. 3.28. Двумерный спектр
люминесценции шлифа
Двумерный спектр люминесценции шлифа не позволяет в полном объёме
анализировать спектры люминесценции, так как при уширении диапазона возбуждения
или люминесценции происходит перекрытие
спектров сканирования монохроматоров.
Шлиф 13б
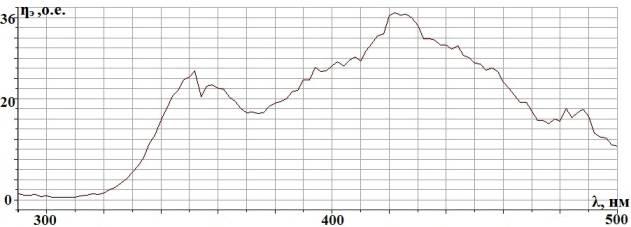
Рис. 3.29. Спектр возбуждения
шлифа при синхронном сканировании
Из рис. 3.29 видно, что
спектр возбуждения костного шлифа имеет 2 максимума: на длине волны 360 нм
и 420 нм.
Рис. 3.30. Спектр люминесценции
шлифа в рабочем диапазоне
На
рис. 3.30 изображены 2 спектра люминесценции шлифа, максимумы которых лежат на
интервалах длин волн 420-435 нм и 475-500 нм.
Рис. 3.31. Спектр возбуждения
шлифа для длины волны люминесценции 426 нм
Спектр
возбуждения имеет максимум на длине волны 361нм.
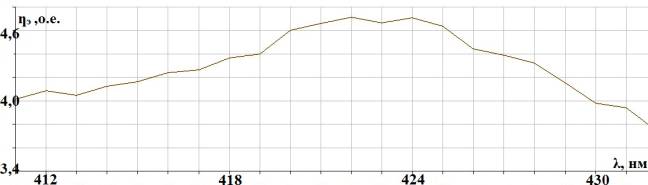
Рис. 3.32. Спектр возбуждения
шлифа для длины волны люминесценции 486 нм
Спектр возбуждения не имеет ярко выраженного
пика, и максимален на интервале длин волн 420-425 нм.
Двумерный спектр возбуждения
шлифа представлен на рис. 3.33.
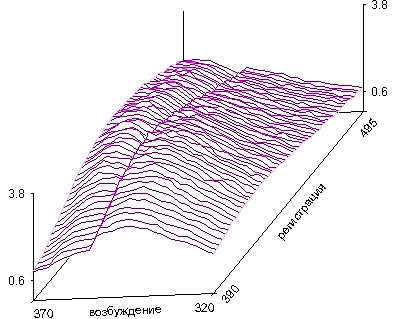
Рис. 3.33. Двумерный спектр
возбуждения шлифа
Двумерный спектр
люминесценции шлифа приведен на рис. 3.34.
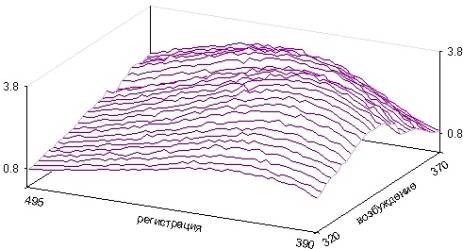
Рис. 3.34. Двумерный спектр
люминесценции шлифа
Шлиф Р6П42
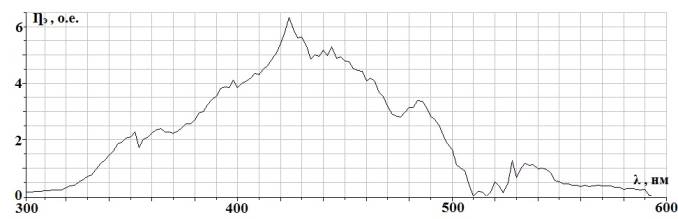
Рис. 3.35. Спектр возбуждения
шлифа при синхронном сканировании
Из рис. 3.35 видно, что
спектр возбуждения костного шлифа имеет 2 максимума: на длине волны 360 нм
и 425 нм.
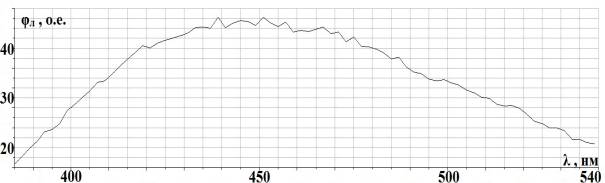
Рис. 3.36. Спектр люминесценции
шлифа при возбуждении длиной волны 360 нм
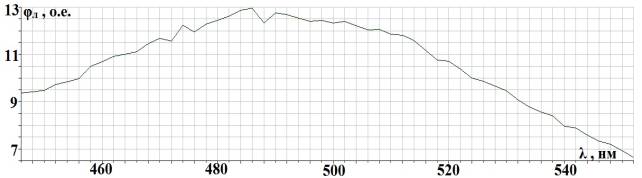
Рис.3.37. Спектр люминесценции
шлифа при возбуждении длиной волны 425 нм
На рис. 3.36 и рис. 3.37
изображены 2 спектра люминесценции шлифа, максимумы которых лежат на интервалах
длин волн 435-460 нм и 475-500 нм.
На рис. 3.38 и рис. 3.39
изображены спектры возбуждения шлифа.
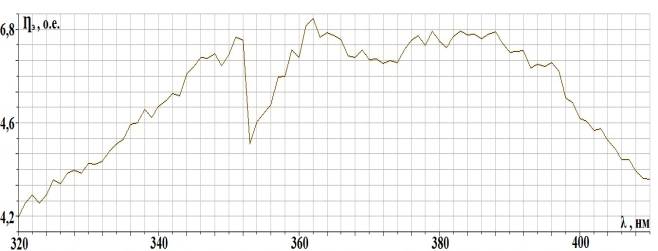
Рис. 3.38. Спектр возбуждения
шлифа
Из рис. 3.38 видно, что
спектр возбуждения шлифа имеет максимум в широком диапазоне длин волны 360-390
нм.
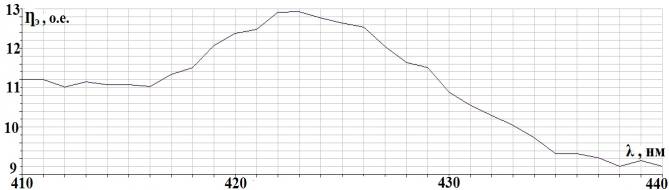
Рис. 3.39. Спектр возбуждения
шлифа
По рис. 3.39 определили,
что спектр возбуждения имеет выраженный максимум на длине волны 422 нм.
Двумерный спектр
возбуждения шлифа представлен на рис. 3.40.
Рис. 3.40. Двумерный спектр
возбуждения шлифа
Двумерный спектр
люминесценции шлифа приведен на рис. 3.41.
Рис. 3.41. Двумерный спектр
люминесценции шлифа
ШЛИФ
4П-22
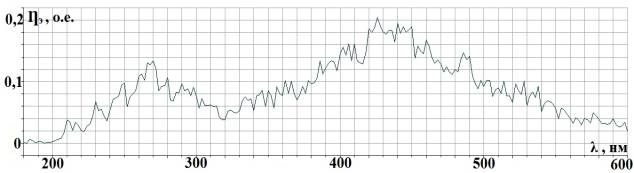
Рис. 3.42. Спектр возбуждения
шлифа при синхронном сканировании
ШЛИФ 14П-16
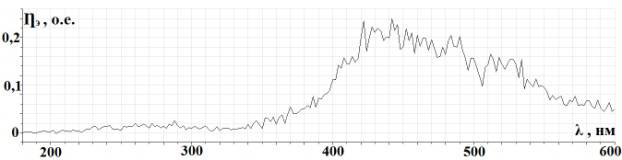
Рис. 3.43. Спектр возбуждения
шлифа при синхронном сканировании
Сигнал от шлифов 4П-22 и 14П-16 сопоставим с
шумовым сигналом. Эти шлифы не люминесцируют.
Выводы: разработанная методика анализа костных шлифов на спектрофлуориметре «Панорама» является более информативной по отношению к макроскопическому анализу. Она позволяет получать спектры возбуждения и люминесценции образцов и на основе полученных данных проводить более глубокий анализ. Как показали исследования, шлифы могут иметь один спектр люминесценции (1С, П25) с пиком в области 484-502 нм с длинной волны возбуждения 422-425 нм, 2 спектра люминесценции (К5, 13б, Р6П42) в диапазоне длин волн 420-460 нм и 475-515 нм, возбуждающиеся на 360-390 нм и 420-425 нм соответственно, и шлифы не люминесцирующие (4П-22, 14П-16).
Можно предположить, что
во всех люминесцирующих шлифах люминесцирует с пиком в области 475-515 нм и
возбуждается с длинной волны 420-460 нм одно и то же вещество.
Оптические методы
исследования биоструктур (тканей, клеток, белков) основаны на использовании
законов оптики, касающихся природы, распространения и взаимодействия с
веществом электромагнитного излучения оптического диапазона (видимый свет,
ультрафиолетовое и инфракрасное излучение).
Все основные
биохимические и клеточные компоненты тканей и крови обладают характерными
«индивидуальными» спектрами поглощения, отражения, рассеяния и люминесценции.
Эти спектры различны для разных мягких тканей и областей уплотнений в них, для
окисленного и восстановленного состояния молекул в клетках ткани. Общее же
процентное соотношение разных биохимических и анатомо-морфологических компонент
в тканях различно для состояния нормы и заболевания органов и систем организма.
Следовательно, общее функциональное и патофизиологическое состояние тканей
отражается на их общих оптических свойствах, которые могут быть
зарегистрированы методами лазерного и люминесцентного анализа.
Поляризационная микроскопия является одним из гистологических методов микробиологической
диагностики и находит применение в цитологических исследованиях. При
этом в поляризованном свете можно исследовать как окрашенные, так и
неокрашенные срезы тканей. Поляризационная микроскопия необходима для изучения
строения тканей, выявления патологических изменений и болезнетворных
микроорганизмов в клетках.
Голографический метод
позволяет регистрировать и воспроизводить более полную информацию об объекте. Голограмму,
образованную невидимыми электромагнитными волнами (ультрафиолетовыми, инфракрасными
и
рентгеновскими), можно
восстановить видимым светом, меняя опорную длину волны. Эта особенность
голографии позволяет использовать ее как метод внутривидения.
Естественная оптическая
и магнитная оптическая активности позволяют получать ценные сведения о
конформациях биополимеров и их изменениях вследствие вращения
плоскости поляризации света.
Среди современных оптических
методов исследования биологических тканей особое место занимают методы флуоресцентной
спектроскопии. Флуоресценция биоткани несёт информацию о концентрации и
пространственном распределении её хромофоров и флуорофоров, что позволяет
судить о структуре биоткани, об интенсивности происходящих в ней метаболических
процессов и др.
Спектры флуоресценции часто
дают детальную информацию о флуоресцирующих молекулах, их конформациях,
комплексах, местах связывания и взаимодействиях с клетками и тканями.
Достоинствами метода атомно-флуоресцентного анализа являются
сравнительно низкий уровень фона; высокая селективность измерений; малые
спектральные помехи, что позволяет детектировать слабые аналитические сигналы и
соответственно очень малые абсолютные количества элементов; высокая чувствительность
и быстродействие, превышающая чувствительность таких методов, как
радиоизотопный и иммуноферментный. Кроме того, методы исследования
флуоресценции относятся к неразрушающим, а также не требуют большого объема
пробы.
Основные медицинские и научные исследования, выполняются на
флуориметрах иностранного производства: Hitachi F 4000, Hitachi-850 (Япония),
SLM-4800, MPF -44B (США), СМ-2203 (Республика Беларусь), а также
отечественного: СФЛ-2, ЦФИ РМИ-81, БИАН-130 и Флюорат-02-Панорама. Отличия
флуориметров друг от друга заключаются в спектральной ширине щелей,
области возбуждения и
области регистрации спектра, в
чувствительности и комплектации. В качестве источника света практически
все флуориметры используют ксеноновые лампы различной мощности. В последнее
время неплохо зарекомендовал себя спектрофлуориметр СМ-2203 производства фирмы
«SOLAR». Кроме хорошего спектрального диапазона для возбуждения и регистрации
спектра, он обладает высокой чувствительностью, дополнительными возможностями
для регистрации спектра поглощения, поляризации флуоресценции и
термостатируемости образца, может использоваться как фотометр.
Измерения люминесценции костных шлифов в работе проводились
на спектрофлуориметре Флюорат-02-Панорама.
В совокупности с внешним компьютером и установленным программным обеспечением «Panorama Pro» российский прибор открывает широкие
возможности для анализа и диагностики биообъектов, жидких и газообразных проб,
неорганических образцов, а также позволяет проводить первичную обработку
результатов измерений, сравнительный анализ, сложные математические операции
над спектрами и временными зависимостями. Это позволяет значительно упростить и
ускорить процесс диагностики, а также разработать комплексные методики анализа
различных веществ и объектов на основе данного прибора.
Методика комплексного анализа костных шлифов на
спектрофлуориметре Флюорат-02-Панорама является более информативной по
отношению к макроскопическому анализу и включает в себя пять последовательных
измерений: спектра возбуждения образца при синхронном сканировании, спектров
люминесценции и возбуждения, двумерных спектров возбуждения и люминесценции.
Как показали исследования, шлифы могут иметь один спектр люминесценции (1С, П25) с пиком в области 484-502 нм с длинной волны возбуждения 422-425 нм, 2 спектра люминесценции (К5, 13б, Р6П42) в диапазоне длин волн 420-460 нм и 475-515 нм, возбуждающиеся на 360-390 нм и 420-425 нм соответственно, и шлифы не люминесцирующие (4П-22, 14П-16).
Можно предположить, что во всех люминесцирующих шлифах
люминесцирует с пиком в области 475-515 нм и возбуждается с длинной волны
420-460 нм одно и то же вещество.
В работе проводились исследования шлифов костных тканей из
остеологических материалов, полученных при археологических раскопках на территории
г. Смоленска и из анатомического музея Смоленской государственной медицинской
академии. Возраст костей составляет более 1000 лет. Поэтому полученные
результаты могут нести недостоверную
информацию о люминесценции по причине различных почвенно-географических
условий захоронения.
Чтобы сделать полный анализ о люминесценции шлифов костных
тканей необходимо выполнить дополнительные исследования:
·
проследить
люминесценцию костных шлифов различного срока давности (вплоть до
десятилетних);
·
исследовать
костные шлифы различных химических составов (после химических реакций);
·
исследовать
костный материал из различных частей тела.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.
Тучин,
В. В. Лазерная диагностика в биологии и медицине [Текст] / В.
В.Тучин, А. В. Приезжаев, М. – Наука,
1989.– 226 с.
2.
Волькенштейн, М. В. Биофизика [Текст]
/ М. В. Волькенштейн, М.– Наука,
1988.– 592с
3.
Ремизов, А. Н. Учебник по медицинской
и биологической физике [Текст] / А.
Н.Ремизов, А. Г. Максина, М.– Дрофа, 2003.– 560с.
4.
Попов
Г. М., Работа с микроскопом. Изучение
минералов в проходящем плоскополяризованном свете [Электронный ресурс]. – Режим доступа:
http://www.bygeo.ru/materialy/vtoroi_kurs/osnovy-kristalloptiki-chtenir/1888-rabota-s-miroskopom-izuchenie-mineralov-v-prohodyaschem-ploskopolyarizovannom-svete.html. Дата обращения: 10.03.2013.
5.
Медицинский портал «ДокторКлуб+ру»
//Люминесцентный анализ [Электронный
ресурс]. – Режим доступа:
http://doctorclub.ru/enc/569. Дата обращения: 15.03.2013.
6.
Иванова, С.В. Использование
флуоресцентных методов в медицине [Текст]/ С.В. Иванова, Л.Н. Кирпичёнок // Медицинские новости. – 2008. – № 12. – С.
56-61.
7.
Меренков, В. Г. Использование макроскопического флуоресцентного
анализа при исследовании остеологического материала // Математическая морфология:
Электронный математический и медико-биологический журнал. – Т. 5. – 2006. – Вып. 4 [Электронный ресурс] URL:
http://www..smolensk.ru/user/sgma/MMORPH/N-12-html/merenkov/merenkov.htm http://www..smolensk.ru/user/sgma/MMORPH/TITL.HTM.
Дата обращения: 15.03.2013.
8.
Национальная академия внутренних
прав// Применение
поисковых и аналитических приборов и приспособлений[Электронный
ресурс]. – Режим доступа:
http://www.naiau.kiev.ua/biblio/books/Sprav-sledov/Glava4/Gl4_5.htm. Дата
обращения: 1.04.2013.
9. Каталог производственной фирмы
ЗАО «Солар» [Электронный ресурс]. – Режим доступа: http://anchem.ru/catalogs/device/device.aspx?iddev=193.
Дата обращения: 27.04.2013.
10. Каталог производственной фирмы «ЕвроЛаб» [Электронный ресурс]. –
Режим доступа: http://www.eurolab.ru/page980378.
Дата обращения: 27.04.2013.
11. Карнаухов, В.Н. Люминесцентный анализ клеток. Учебное пособие [Текст] / В.Н. Карнаухов – Пущино.: Аналитическая микроскопия, 2002. – 131 с.