Математическая морфология.
Электронный математический и
медико-биологический журнал. - Т. 12. -
Вып. 3. - 2013. - URL:
http://www.smolensk.ru/user/sgma/MMORPH/TITL.HTM
http://www.smolensk.ru/user/sgma/MMORPH/N-39-html/TITL-39.htm
http://www.smolensk.ru/user/sgma/MMORPH/N-39-html/cont.htm
УДК:
616.343-007.272-06:616.131]-092.9
ОСОБЕННОСТИ
ПРОСТРАНСТВЕННОЙ РЕОРГАНИЗАЦИИ АРТЕРИЙ МАЛОГО КРУГА КРОВООБРАЩЕНИЯ ПРИ
ЭКСПЕРИМЕНТАЛЬНОМ МОДЕЛИРОВАНИИ ТОНКОКИШЕЧНОЙ НЕПРОХОДИМОСТИ
Ó
2013 г. Гойдало Т. Р.
В эксперименте на крысах с использованием гистологических
и рентгенангиографических методик проведено изучение структурной и
пространственной реорганизации легочных артерий и их ветвей при экспериментальном
моделировании острой низкой тонкокишечной непроходимости. Установлено, что
внутриорганные артерии мелкого калибра реагируют прогрессивным нарастанием
сужения просвета и снижением пропускной способности. Магистральные ветви при их
рентгенангиографическом исследовании характеризовались снижением уровня
симметрии ветвлений с уменьшением емкости, определяемыми по методике, предложенной
К.А. Шошенко и А.С. Голуб. При этом коэфициент асимметрии снижался на 20-30 % с
одновременным уменьшением на 6-12 % величины угла ветвления. Об уменьшении
емкости сосудистого русла свидетельствовало уменьшение на 22-24 % диаметров
основных стволов легочных артерий и динамика коэфициента ветвления.
Ключевые
слова: кишечная
непроходимость, легочные артерии, симметрия, угол.
Введение. Несмотря на прогресс в совершенствовании хирургической
техники, анестезиологической помощи и интенсивной терапии результаты
комплексного лечения острой кишечной непроходимости не могут считаться
удовлетворительными, поскольку послеоперационная летальность остается высокой,
достигая 25-35 % и не имеет тенденции к снижению. При том, что в структуре
заболеваемости среди нозологических форм неотложной хирургии острая кишечная
непроходимость занимает почти 30 % [8, 10]
Нарастающая гиповолемия, обусловленная «необратимыми
потерями» вследствие рвоты, является пусковым механизмом развития сосудистых расстройств
и изменений со стороны сосудистых русел внутренних органов. При этом происходит
перераспределение крови, агрегация тромбоцитов, экстраваскулярные и
транскапиллярные перемещения жидкости и как результат – микроинфаркты легких,
почек, печени. Все это приводит к полиорганной недостаточности и дает основания
считать ее главной причиной высокой летальности при лечении острой кишечной
непроходимости. [3, 4 ,12].
Факторы агрессии и вторичные эндогенные токсические
субстанции, образующиеся в кишечнике, поступают во внутреннюю среду организма
двумя путями: через портальную систему и лимфатические коллекторы и грудной
лимфатический проток. Поэтому первыми органами-мишенями ферментной и
токсической агрессии являются печень и легкие [13, 14]. Среди легочных
осложнений важное место занимает синдром острого повреждения легких – одна из
наиболее тяжелых форм острой дыхательной недостаточности. Важную роль в ее
развитии играет, безусловно, сосудистый фактор [5, 9].
В настоящее время в научной литературе имеется
довольно значительное количество сообщений о структурно-функциональных
изменениях в легких и сосудах малого круга кровообращения при острой кишечной
непроходимости. Однако большинство из проведенных исследований сосредоточены на
функциональных изменениях и биохимических процессах, а имеющиеся работы
морфологического плана посвящены изучению, преимущественно, аэро-гематического
барьера и сосудов гемомикроциркуляторного русла, в то время как
морфофункциональные реакции магистральных артерий продолжают оставаться вне поля
зрения исследователей . Поэтому еще много вопросов, связанных с состоянием
магистральных сосудов, продолжают оставаться противоречивыми и окончательно не
выясненными.
Цель
исследования: дать
структурно-пространственную характеристику перестройки сосудов малого круга
кровообращения в динамике моделирования острой тонкокишечной непроходимости у
крыс.
Объект и
методы исследования. Эксперименты
проведены на 30 беспородных белых лабораторных крысах-самцах, 24-м из которых
моделировали острую обтурационную кишечную непроходимость путем перевязки тонкой
кишки шелковой лигатурой на 5 см выше ее впадения в слепую. Для этого под
внутримышечным общим кетаминовым наркозом проводили срединную лапаротомию,
выводили в рану петлю тонкой кишки и через отверстие в брыжейке между аркадами
последнего порядка и стенкой кишки проводили лигатуру, которой обходили кишку и
перевязывали ее до полного перекрытия просвета. Лапаротомную рану зашивали.
После операции животные находились без пищи, но без ограничения воды. 6 животных
составляли контрольную группу. Из эксперимента крыс выводили путем
внутриплеврального введения больших доз концентрированного раствора тиопентала
натрия.
Материал для морфологических исследований забирали
через 12, 24, 48 и 72 часа от начала эксперимента. Оценку пространственной
организации сосудов легких осуществляли на посмертных контрастных рентгенангиограммах
после инъекции артерий малого круга кровообращения мелкодисперсной взвесью
свинцового сурика через канюлю, введенную в правый желудочек. Анализ особенностей
пространственной организации легочных сосудов проводили по методике [1],
согласно которой в сосудистых тройниках (разветвлениях) измеряли диаметр
основного ствола (Д0), толстой (Д1) и тонкой (Д2) ветвей, суммарный угол ветвления (φ0 ) и его составные части:
угол отклонения толстой (φ1) и тонкой (φ2) ветвей следующих порядков. На основании измеренных
характеристик тройника рассчитывали:
-
коэффициент асимметрии:
H2 = Д22 / (Д12 +
Д22), (1)
-
коэффициент ветвления: k = (Д12 + Д22)/ Д02, (2)
Гистологические срезы окрашивали гематоксилином и
эозином, резорцин-фуксином по Вейгерту и по Ван Гизон. Все эксперименты проводились
с соблюдением "Правил проведения работ с использованием экспериментальных
животных".
Статистическую обработку полученных данных
осуществляли методом вариационной статистики с использованием программы
«Microsoft Excel». Определяли среднее значение (М), стандартное отклонение
(δ) и ошибку среднего (m).
Результаты и
обсуждение. Для объективной оценки
изменений, возникающих при развитии патологических процессов, важное значение
имеет знание особенностей структурной организации органов и тканей, а также их
основные морфометрические параметры в норме. Определение средних величин в норме
среди особей одной и той же популяции, которые находились в одинаковых условиях
роста и развития дает возможность сравнивать результаты без влияния на них
различных внешних факторов, как то: время года, климатические условия,
особенности питания и т.д. Поэтому мы и провели сначала исследования
структурной и пространственной организации кровеносных сосудов легких интактных
крыс.
Нами было установлено, что особенность
ангиоархитектоники сосудов малого круга кровообращения крыс определяется
особенностью строения их легких. Это касается в первую очередь разделения
легких на доли. Правое легкое у крыс в отличие от людей состоит из 4 долей, которые
разделены между собой междолевыми щелями, это: краниальная, средняя, каудальная
и дополнительная доли. Их еще называют верхушечной, сердечной, диафрагмальной и
дополнительной [7, 11]. Левое легкое неделимо, четких междолевых щелей на нем
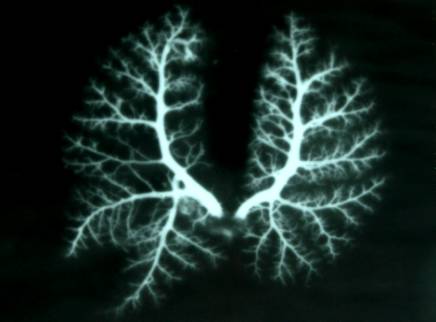
нет. Согласно этому сначала идет и разделение легочных артерий на долевые (рис.
1). Дальнейшая градация рентгенконтрастных ветвей включает в себя сегментарные,
дольковые и поддольковые артерии. Рнтгенангиографически сегментарное разделение
легких крысы можно четко проследить как за ветвлением артерий третьего порядка,
так и за межсегментарными промежутками. Дольковое и поддольковое разделение
определяется только за ветвлением артерий соответствующего порядка.
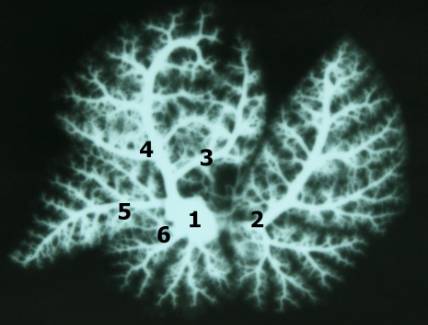
Рис. 1. Ветвление легочных артерий крысы в норме. Фото с рентгенангиограммы.
Правая легочная артерия – 1, левая легочная артерия – 2, артерия краниальной
доли – 3, артерия средней доли – 4, артерия каудальной доли – 5, артерия
дополнительной доли – 6.
При проведении массометрических и морфометрических
исследований было установлено, что массы правого и левого легкого соотносятся
как 6 : 4, т.е. правое легкое выражено преобладает над левым. Согласно этому
диаметр правой легочной артерии также преобладает над диаметром левой при их измерении
возле устьев. При этом диаметр правой артерии составлял (1,44±0,05) мм, а левой
- (1,15±0,06) мм. То есть, соотношение между ними было как 5,6 : 4,4.
Что касается стереометрических показателей ветвлений
легочной артерии, то анализ контрастных рентгенангиограмм (табл. 1, 2) позволил
установить достаточно выраженную асимметричность ветвей второго и третьего
порядка как по Н2, так и по k, φ0 и его составляющими. По классификации К.А. Шошенко и
соавт. (1982) эти ветви могут быть отнесены к тройникам II класса асимметрии (Н2 = 0,15 – 0,35) в то время
как ветви четвертого порядка уже являются тройниками III класса асимметрии (Н2 > 0,35), то есть с уменьшением
диаметров сосудов симметрия их ветвлений постепенно растет о чем
свидетельствует последовательное увеличение значений Н2 и k в направлении от
магистральных артерий к капиллярам. Аналогичная ситуация наблюдается по φ0 и его составным частям. По
мере приближения к капиллярам φ0 растет, а соотношение между φ1 и φ2 постепенно увеличивается по
направлению к 1.0. Достаточно высокая степень асимметрии ветвлений легочной
артерии, которая была установлена при проведении пространственных измерений,
свидетельствует о сравнительно невысоком уровне их геометрической сопротивляемости,
что и характерно для малого круга кровообращения, как части кровеносного русла
с низким давлением.
Через 12 часов после начала моделирования острой
тонкокишечной непроходимости при гистологическом исследовании ткани легких и их
сосудов наблюдались достаточно выраженные спастические реакции со стороны ветвей
легочных артерий мышечного типа мелкого калибра на фоне которых в бронхиальных
артериях выявлялись изменения дилятационного характера. Однако, что касается
рентгенангиографической картины, то здесь особых визуальных изменений не
происходило. Можно было заметить лишь некоторое разрежение сосудистого рисунка,
которое подтверждалось увеличением межсегментарних промежутков. То есть, магистральные
сосуды в отличие от мелких внутриорганных артерий ощутимых морфофункциональных
реакций на данный срок не проявляли. Однако, при анализе стереометрических
показателей можно было наблюдать тенденцию к незначительному повышению уровня
симметричности как по Н2, так и по k на всех исследуемых ветвлениях, что могло
быть результатом некоторого временного повышения гемодинамической нагрузки.
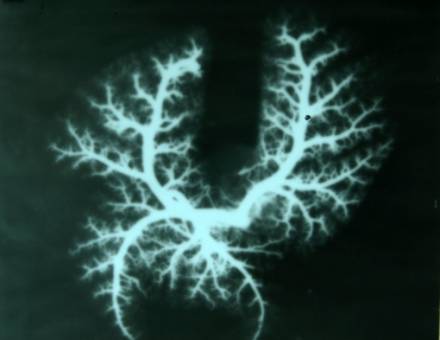
Через 24 часа и во все последующие сроки проведения
эксперимента вместе с усилением и прогрессивным нарастанием вазоконстрикторных
реакций в системе интраорганных ветвлений легочной артерии, которое выявлялось
при гистологическом исследовании, прогрессивно снижался уровень
рентгенангиографичних показателей как проявление пространственной реорганизации
кровеносного русла легких. Уменьшался диаметр магистральных легочных артерий, более
розреженным становился сосудистый рисунок (рис. 2). Причем слева такое
уменьшение диаметра становилось достоверным по сравнению с контролем уже через
48 часов, а через 72 часа разница была достоверной как для левой, так и правой
легочной артерии и составляла в среднем 22 – 24%.