Математическая
морфология.
Электронный
математический и медико-биологический журнал. - Т. 13. -
Вып. 3. - 2014. -
URL:
http://www.smolensk.ru/user/sgma/MMORPH/TITL.HTM
http://www.smolensk.ru/user/sgma/MMORPH/N-43-html/TITL-43.htm
http://www.smolensk.ru/user/sgma/MMORPH/N-43-html/cont.htm
Первоначально
материалы данной статьи были направлены в редакцию журнала
"Научно-технический вестник информационных технологий, механики и
оптики"
“Scientific and Technical Journal of Information Technologies Mechanics
and Optics”
Переписка с редакцией журнала (материалы, рецензия)
Ввиду
чрезвычайной важности материалов (в том числе и для научного престижа нашего
государства), посланных в редакцию журнала "Научно-технический вестник
информационных технологий, механики и оптики", авторы статьи приняли решение
больше не вступать в переписку с редакцией вышеуказанного уважаемого журнала. Ниже
публикуется несколько измененный вариант посланной статьи.
УДК 611.161+685.515
РАЗРАБОТКА
МИКРОМАШИННЫХ КИБЕРНЕТИЧЕСКИХ ПЛАТФОРМ ДЛЯ КУЛЬТИВИРОВАНИЯ САМОРАЗВИВАЮЩИХСЯ И ФУНКЦИОНИРУЮЩИХ
ЭНДОТЕЛИАЛЬНЫХ КАПИЛЛЯРНЫХ СЕТЕЙ, СОПРЯЖЁННЫХ С ОРГАНИЗОВАННЫМИ В ПРОСТРАНСТВЕ IN VITRO МИКРОПОТОКАМИ
ПИТАТЕЛЬНОЙ СРЕДЫ
Ó 2014 г. Найдёнов Е. В., Якименко И. В., Глотов В. А.
Целю
НИОКР является создание микромашинных кибернетических платформ для
культивирования саморазвивающихся и функционирующих эндотелиальных капиллярных
сетей, сопряжённых с организованными в пространстве in vitro микропотоками питательной
среды. Разработка является научно-инженерным продолжением проекта РФФИ №96–04–50991 «Клеточная и
тканевая инженерия эндотелия (формирование в культуре эндотелия in vitro функционирующих саморазвивающихся капиллярных
сетей)». Рассмотрена структура опытного
изделия, описан процесс его работы. Предложена технология, позволяющая
формировать объёмные функционирующие капиллярные сети на специальных динамических
гелях (искусственной протоплазме). Изложенные в работе решения имеют
экспериментальные подтверждения.
Ключевые слова:
микрофлюидные чипы, микропотоки, эндотелиальные капиллярные сети.
…Мне кажется, нельзя спорить против общего положения,
что незнакомство с русской научной литературой имеет и свои преимущества: оно
дает возможность делать ценные открытия лет через 20 после того, как они
были
описаны и разработаны в России.
А. И. Яроцкий [1]
Введение
В
исследованиях ангиогенеза in vitro
установлено, что эндотелиальные клетки при определенных условиях могут самопроизвольно
организовываться в трёхмерные капиллярные сети, которые при сопряжении с
организованными в пространстве микропотоками питательной среды канализируются и
приобретают способность к массопереносу. Гемодинамический фактор in vivo – играет решающую роль в
развитии микрососудистых капиллярных сетей. Включение гидродинамического
фактора в культуру эндотелиальных клеток сложнейшая научно-техническая задача
[2-12].
С
2012 года в Корее, США и Японии ведутся успешные разработки технологии культивирования
эндотелиальных капиллярных сетей в микрофлюидных чипах [17-33]. В частности,
группе корейских учёных под руководством Noo Li Jeon удалось воспроизвести in vitro феномен развития
капиллярных сетей с последующей канализацией и включением массопереноса.
Гидродинамический фактор в полученных капиллярных сетях создается за счёт силы
тяжести жидкостей в чипе. Позднее исследовательская группа под руководством
John P Morgan и Abraham D Stroock'а реализовала оригинальный микрофлюидный
чип, в котором также формируются
капиллярные сетевидные образования in vitro. Гидродинамический фактор включён путём введения
питательной среды микрочипа и гидрогеля извне, через управляемые микронасосы.
Большинство
из представленных в мире на сегодняшний день микрофлюидных платформ,
позволяющих культивировать эндотелиальные капиллярные сети, основаны на схожей
конструкции: в плоскости микрофлюидного чипа расположена канализированная с
микроотверстиями матрица из стекла в которой расселяют эндотелиальные клетки, а
затем пропускают питательный раствор. В результате эндотелиальные капиллярные
сети формируются внутри матрицы, в плоскости микрофлюидного чипа. Такая
конструкция имеет ряд преимуществ: простота
в изготовлении, нет необходимости использовать сложные по составу
гидрогели. Есть ряд важных недостатков: невозможно извлечь тканевую структуру
из матрицы, ограниченная площадь области, в которой формируются капиллярные
сети, однократность применения микрофлюидного чипа.
Очевидным
решением является разработка конструкции аппаратной платформы (АП) биореактора
(БР), в котором можно формировать объёмные тканевые капиллярные образования с
возможностью извлечения биомассы и управлением процессом роста капиллярных
сетей [13-16].
Материалы
и методы
Разрабатываемая АП состоит из четырёх основных блоков: резервуара
с питательной жидкостью, микронасоса, камеры биореактора, системы управления и
обработки данных, разделённой цифровой системой управления электропитанием
(рис.1). В камере биореактора расположен набор измерительных датчиков, система
технического зрения, система открывания микроклапанов и дозирования
микропотоков миниатюрной матрицы, система фильтрации и очистки, система
распределения факторов роста. АП автономна,
герметична, самостерилизующаяся, содержит независимую систему батарейного
питания и термостатирования.
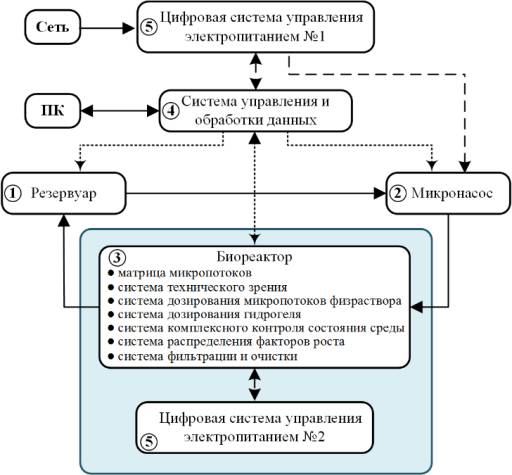
Рис. 1. Структура аппаратной платформы
Конструкция матрицы микропотоков питательной среды имеет
ряд схожих технических решений с технологией микрофлюидных матриц: капиллярные
сети образуются в пространстве динамического геля (искусственной протоплазмы)
под влиянием управляемого потока питательной жидкости. Отличия между
технологиями: формирование капиллярных сетей происходит не в замкнутой
плоскости стеклянной матрицы, а в пространстве биокамеры. Если в зарубежных
технологиях матрица выполняется путём лазерной резки микродорожек по стеклу с
насечками, то в предлагаемом решении она формируется из миниатюрных трубок, на
сторонах которых расположены микроотверстия. От них в среде динамического геля
(искусственной протоплазмы) развиваются капиллярные сети. Такое решение
наиболее близко к процессу роста капиллярных сетей в естественных условиях и
позволяет произвольно формироваться эндотелиальным капиллярным образованиям в
пространстве динамического геля (искусственной протоплазмы). Миниатюрные трубки
покрыты слоем эндотелия. На участки, где происходит рост клеточных образований
добавляются факторы роста. Путём управления потоком питательной жидкости в миниатюрных
трубках, а также соблюдая параметры среды камеры биореактора появляется возможность
управлять процессом роста капиллярных сетей (рис.2).
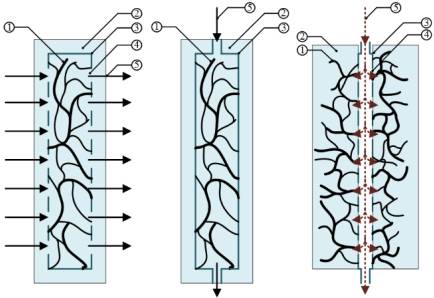
а) б) в)
Рис. 2. Разновидности технологий получения эндотелиальных
капиллярных сетей:
1 – капиллярные сетевые образования; 2 – гидрогель;
3 – корпус трубки матрицы; 4 – микроотверстия; 5 – поток питательной жидкости
а) – технология группы проф. Noo Li Jeon (Корея), б) - технология группы проф.
John P Morgan и Abraham D Stroock'а (США), в) – разработка группы проф. В. А.
Глотова (Россия)
В АП камера биореактора изолирована от остальных
отсеков, имеет независимую систему охлаждения и батарейного питания. Корпус
технической системы высокопрочный, содержит защиту биореактора при падениях. В
качестве системы управления применяются миниатюрные одноплатные компьютеры Raspberry Pi c набором модулей расширения. Связь с компьютером
оператора может осуществляться, в том числе, и по защищённому радиоканалу.
Полученный вес опытной АП составляет 5400 грамм. Размеры 250х380х55мм (рис.3).
Особенности разрабатываемой технической системы направлены на возможность
проведения опытов вне специализированных микробиологических лабораторных
помещений.
Рис. 3. Эскиз аппаратной платформы биореактора
Идеология создания устройства, позволяющего культивировать эндотелиальные
капиллярные сети с заданным объёмом тканевой массы, была создана при реализации
грантов РФФИ №94-04-13544 «Структурный анализ микрососудистых бифуркаций»
и №96-04-50991 «Клеточная и тканевая инженерия эндотелия
(Формирование в культуре эндотелия in vitro функционирующих саморазвивающихся
капиллярных сетей)» (Глотов В. А.). Результатом реализации гранта №96-04-50991 стало создание в 1997 году
макетной установки по описанному принципу (рис. 1).
Моделирование
аппаратной платформы
Проведено математическое моделирование всей технической системы и
биологических процессов, происходящих в камере БР. Моделирование включало в
себя создание оригинальных алгоритмов управления сложной технической системой,
где присутствие человека-оператора по технологическим условиям ограничено, а
также разработку адекватных математических моделей формирования тканевых
образований в пространстве динамического геля, наиболее близко описывающих реальные
биологические процессы. Задачей математической модели является контроль и
прогнозирование работы большого количества клапанов, соблюдение концентрации
углекислого газа и кислорода в камере БР, pH,
эффективности применения различных факторов роста, дренаж жидкой фазы из камеры
БР и др. Структура технической системы, для которой формировалась
математическая модель представлена на рис. 4.
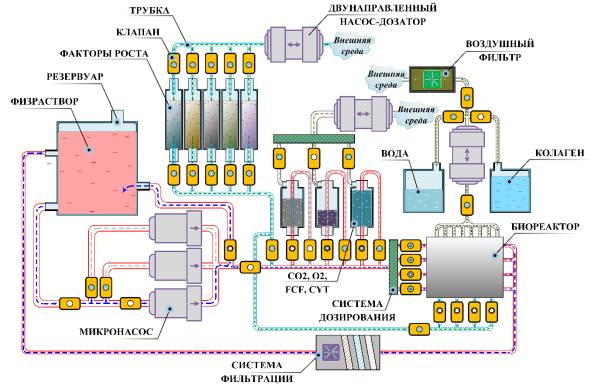
Рис.
4. Функциональная схема аппаратной
платформы
Математическая
модель была разработана в среде системы компьютерной математики Matlab&Simulink R2014a c применением пакетов Matlab SimBiology и Simulink
Stateflow. Полученная модель (рис.5) содержит 5,4 млн. базовых блоков Simulink и выполняет более 7 000 различных
математических функций, отражая поведение устройства в стационарных и нестационарных
условиях.
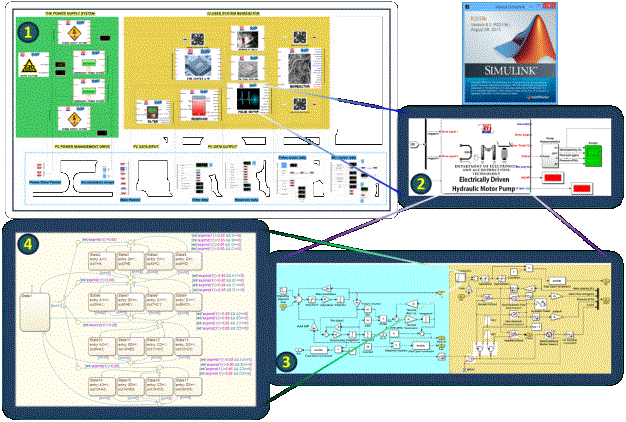
Рис.
5. Математическая модель аппаратной
платформы:
1 – полная математическая модель технической
системы;
2 – модель субблока Simulink;
3 – модель подсистемы субблока; 4 – машина состояний элемента модели
Заключение
Разработка микромашинных
кибернетических платформ для культивирования саморазвивающихся и функционирующих
эндотелиальных капиллярных сетей, сопряжённых с организованными в пространстве in vitro микропотоками питательной среды представляет собой
новое научно-инженерное биотехнологическое направление. Создание и освоение технологии саморазвивающихся капиллярных сетей
с управляемой микроциркуляцией жидкой фазы питательной среды, позволит приступить
к работам по созданию примитивных, а потом более сложных, многоклеточных
образований с заданными свойствами, например:
1) опухолеподобные
образования in vitro,
пронизанные функционирующими капиллярами;
2) структурно-функциональные
макро-микроскопические единицы органов, такие как остеон, мышечное волокно, ацинус,
печеночная долька, нефрон;
3) органоподобные
образования, такие как искусственная поджелудочная железа и другие эндокринные
железы;
4) искусственные
биологические материалы, такие как мышечные ткани;
5) искусственная
плацента.
Задача
создания биореакторов, в которых сопряжены в одной системе культура эндотелиальных
клеток и организованные микропотоки жидкой фазы питательной среды, актуальна.
Она может быть технически решена с применением современных достижений в области
компьютерного проектирования и конструирования.
Разрабатываемая
технология искусственных биологических капиллярных сетей будет востребована в
фармакологии, биопротезировании, пищевой промышленности и многих других
областях и открывает широкие перспективы в медицине в целом.
В
настоящее время исследовательской международной группой на базе студенческого
КБ филиала «НИУ «МЭИ» в г. Смоленске ведётся сборка первого отечественного экспериментального
макета аппаратной платформы биореактора на основе указанных выше принципов и
подходов.
Проект
отмечен рядом дипломов и сертификатов. Является победителем инвестиционной
сессии «Лучший технический проект» молодёжного форума Селигер 2014 и финалистом
Всероссийского конкурса перспективных научных разработок «Stand Up Science 2014» от федерального
агентства «Росмолодёжь».
Выводы
1. Предложена новая технология
культивирования в динамических гелях (искусственной протоплазме) эндотелиальных
капиллярных сетей.
2. Проведено комплексное
моделирование конструируемой аппаратной платформы биореактора, позволившее
доказать перспективность реализации заложенных идей.
3. Разработаны и
запатентованы ряд составляющих модулей будущего устройства, имеющие
многоцелевую направленность.
Литература
1.
Литвинов
А. В. А. И. Яроцкий (1866–1944) и его
роль в становлении и развитии отечественной терапевтической школы (К 135-летию
со дря рождения). - Математическая морфология. Электронный математический и
медико-биологический журнал. - Т. 13. - Вып. 4. - 2014. - URL: http://www.smolensk.ru/user/sgma/MMORPH/N-7-html/LITVINOV/litvinov.html http://www.smolensk.ru/user/sgma/MMORPH/TITL.HTM
http://www.smolensk.ru/user/sgma/MMORPH/N-7-html/TITL-7.htm http://www.smolensk.ru/user/sgma/MMORPH/N-7-html/CONT.htm
2.
Глотов
В. А. Клеточная и тканевая инженерия эндотелия. Формирование в культуре
эндотелия in vitro функционирующих саморазвивающихся капиллярных сетей. Экспериментальные
подходы. //Математическая морфология. Электронный математический и
медико-биологический журнал. – Смоленск: Изд. СГМА, 1997. – Т. 2. – Вып. 1. –
С. 23-58. – URL: http://www.smolensk.ru/user/sgma/MMORPH/N–2–html/3.HTM; http://elibrary.ru/titles.asp .
3. Глотов В. А. Клеточная и тканевая
инженерия эндотелия (формирование в культуре эндотелия in vitro
функционирующих саморазвивающихся капиллярных сетей). (Отчет). //Отчет
(итоговый) /Смоленская государственная медицинская академия. – Проект РФФИ
№96–04–50991. Смоленск. 1998. [Глотов В. А. Клеточная и тканевая инженерия
эндотелия (формирование в культуре эндотелия in vitro
функционирующих саморазвивающихся капиллярных сетей) (№96–04–50991). СмГМА.
Смоленск. – Информационный бюллетень РФФИ. – 1996. – №4. – С. 201]. - URL: http://intra.rfbr.ru/bullet.htm.
4.
Глотов
В. А. Перспективы получения саморазвивающихся тканеподобных образований с
заданными свойствами. //Братья наши меньшие (философия и психология отношений человека и
животных). Материалы межвузовской конференции 5 февраля 2001 года. –
С.-Петербург, 2001. – С. 35-40. – URL: http://www.private.peterlink.ru/philo/tez/b5.html .
5.
Глотов
В. А., Жилкин В. В., Коваленко Н. Н., Мартынов В. Ф., Махнач М. М., Машевский
Ю. В., Свешников А. В., Федоров Г. Н., Хадарцев А. А., Юшков С. В. Проблема
получения саморазвивающихся и функционирующих эндотелиальных капиллярных сетей in vitro, пути ее решения, перспективы получения,
конструирования и культивирования тканеподобных образований с заданными
биологическими свойствами. // Материалы междисциплинарной (медицина, биология, физика,
радиоэлектроника, химия, математика, информатика, педагогика) конференции с
международным участием "Новые биокибернетические и телемедицинские
технологии XXI века для диагностики и лечения заболеваний человека"
("НБИТТ-21"). 23-25 июня 2003 г., г. Петрозаводск. - Петрозаводск,
2003. – С. 37.
6.
Глотов
В. А. Перспективы получения
саморазвивающихся и функционирующих капиллярных сетей in vitro на
основе клеточных культур эндотелия. //Стволовые клетки и перспективы их
использования в здравоохранении. Материалы конференции (Приложение к журналу
"Бюллетень экспериментальной биологии и медицины"). М.: Издательство
РАМН, 2003. – С. 64-68.
7.
Глотов
В. А. Перспективы получения живых искусственных саморазвивающихся
многоклеточных тканеподобных образований с заданными биологическими свойствами in vitro на основе клеточной и тканевой инженерии саморазвивающихся
и функционирующих эндотелиальных капиллярных сетей. //Наука и будущее: идеи
которые изменят мир. Материалы международной конференции. 14-16 апреля 2004 г.
- М.: ГГМ им. В. И. Вернадского РАН, 2004. – С. 60-62, E.
8.
Глотов
В. А. Искусственная поджелудочная железа на основе технологии саморазвивающихся
эндотелиальных капиллярных сетей in vitro. //Вторая Международная конференция «Наука и будущее:
идеи, которые изменят мир». Тезисы докладов. (Москва, ГГМ им. В.И. Вернадского
РАН, 15-19 мая 2005 г.) - Москва, 2005.
- СD-ROM.
9.
Глотов
В. А., Шишкин А. А. Тканеподобные
образования с заданными биологическими свойствами на основе клеточной и
тканевой инженерии in vitro эндотелиальных капиллярных сетей. Проект. //IV
Всероссийская конференция «Клиническая гемостазиология и гемореология в
сердечно-сосудистой хирургии» (с международным участием). Москва. 4-6 февраля
2009 г. Симпозиум «Регионарная гемодинамика и микроциркуляция». – М.: НЦ
Сердечно-сосудистой хирургии им. А. Н. Бакулева, 2009. – С. 55-56.
10. Глотов В. А. Тканеподобные
образования с заданными биологическими свойствами на основе клеточной и
тканевой инженерии in vitro эндотелиальных капиллярных
сетей. Актуальные вопросы тканевой и клеточной трансплантологии: Сборник
тезисов четвертого всероссийского симпозиума с международным участием: /Под
редакцией: акад. РАН и РАМН С. П. Миронова – СПб.: Изд-во «Человек и его
здоровье», 2010. – С. 159.
11. Глотов В. А. Тканеподобные
образования с заданными биологическими свойствами на основе клеточной и тканевой
инженерии in vitro эндотелиальных капиллярных сетей // Труды X международной
научно-техническая конференция «Физика и радиоэлектроника в медицине и экологии
(ФРЭМЭ’2012)». Книга 3. – Владимир, 2012. – С. 37-41.
12. Глотов В. А., Найдёнов Е.
В., Якименко И. В. От моделирования ангиогенеза IN VITRO к созданию
искусственных биологических образований с заданными свойствами на основе
технологии саморазвивающихся капиллярных сетей. // Математическая морфология.
Электронный математический и медико-биологический журнал. – Т. 12. – Вып. 2. –
Смоленск, СГМА. – 2013. – URL: http://www.smolensk.ru/user/sgma/MMORPH/N-38-html/glotov/glotov.htm
13. Найдёнов Е. В., Андрейкин С.
А., Прокофьева П. А., Якименко Ю. И. Клеточная и тканевая инженерия эндотелия
IN VIVO и IN VITRO (инженерные подходы) // Математическая морфология.
Электронный математический и медико-биологический журнал. – Т. 12. – Вып. 2. –
Смоленск, СГМА. – 2013. – URL: http://www.smolensk.ru/user/sgma/MMORPH/N-38-html/naydenov/naydenov.htm
14. Найдёнов Е. В. Предпосылки
создания микромашинных кибернетических платформ для культивирования саморазвивающихся
и функционирующих эндотелиальных капиллярных сетей // Вестник государственно
медицинской академии 2014, специальный выпуск Материалы II Всероссийской
научно-практической конференции студентов и молодых ученых с международным
участием «Актуальные проблемы науки XXI века» – Смоленск: Изд-во СГМА, 2014. –
С. 46-48.
15. Найдёнов Е. В. Разработка
технической платформы многофункционального биологического реактора // Тезисы
докладов XX Международной научно-технической конференции студентов и аспирантов
«Радиоэлектроника, электротехника и энергетика». Т. 1. М.: Издательский дом
МЭИ, 2014. – с. 215.
16. Найдёнов Е. В. Компьютерное
проектирование и моделирование в САПР и СКМ узлов микромашинных кибернетических
платформ для культивирования саморазвивающихся и функционирующих эндотелиальных
капиллярных сетей // Материалы докладов XV международной научной конференции
студентов и аспирантов «Системы компьютерной математики и их приложения». Вып.
15 – Смоленск: Изд-во СмолГУ, 2014. – С. 34-36.
17. Li
D. (Ed.). Encyclopedia of microfluidics and nanofluidics (Vol. 1). // Springer,
2008.
18. Yeon
J. H., Ryu H. R., Chung M., Hu Q. P., & Jeon N. L. In vitro formation and
characterization of a perfusable three-dimensional tubular capillary network in
microfluidic devices. // Lab on a chip, 2012, 12 (16), p. 2815-2822.
19. Kim
S., Lee H., Chung M., & Jeon N. L. Engineering of functional, perfusable 3D
microvascular networks on a chip // Lab on a Chip, 2013, 13(8), p. 1489-1500.
20. Coquinco
A., Kojic L., Wen W., Wang Y. T., Jeon N. L., Milnerwood A. J., & Cynader
M. A microfluidic based in vitro model of synaptic competition //Molecular and
Cellular Neuroscience, 2014, 60, p. 43-52.
21. Lee
H., Kim S., Chung M., Ki J. H., & Jeon N. L. A bioengineered array of 3D
microvessels for vascular permeability assay //Microvascular research, 2014,
91, p. 90-98.
22. Lee
H., Chung M., & Jeon N. L. Microvasculature: An essential component for
organ-on-chip systems // MRS Bulletin, 2014, 39 (01), p. 51-59.
23. Zheng
Y., Chen J., Craven M., Choi N. W., Totorica S., Diaz-Santana A., ... &
Stroock A. D. In vitro microvessels for the study of angiogenesis and
thrombosis. Proceedings of the National Academy of Sciences, 2012, 109(24),
9342-9347.
24. Morgan
J. P., Delnero P. F., Zheng Y., Verbridge S. S., Chen J., Craven M., &
Stroock A. D. Formation of microvascular networks in vitro. Nature protocols,
2013, 8(9), p. 1820-1836.
25. Jeong
G. S., Han S., Shin Y., Kwon G. H., Kamm R. D., Lee S. H., & Chung S.
Sprouting angiogenesis under a chemical gradient regulated by interactions with
an endothelial monolayer in a microfluidic platform // Analytical chemistry,
2011, 83(22), p. 8454-8459.
26. Chung
B. G., Lee K. H., Khademhosseini A., & Lee S. H.. Microfluidic fabrication
of microengineered hydrogels and their application in tissue engineering // Lab
on a Chip, 2012, 12(1), p. 45-59.
27. Hoefer
I. E., den Adel B., & Daemen M. J. Biomechanical factors as triggers of
vascular growth // Cardiovascular research, 2013, 99(2), p. 276-283.
28. Stapor
P. C., Azimi M. S., Ahsan T., & Murfee W. L. An angiogenesis model for
investigating multicellular interactions across intact microvascular networks
// American Journal of Physiology-Heart and Circulatory Physiology, 2013,
304(2), p.235-245.
29. Zhang
L. G., Khademhosseini A., & Webster T. (Eds.).Tissue and Organ
Regeneration: Advances in Micro-and Nanotechnology // CRC Press, 2014.
30. Zervantonakis
I. K., Kothapalli C. R., Chung S., Sudo R., & Kamm R. D. Microfluidic devices
for studying heterotypic cell-cell interactions and tissue specimen cultures
under controlled microenvironments // Biomicrofluidics, 2011, 5(1), p. 406.
31. Jeong
G. S., Kwon G. H., Kang A. R., Jung B. Y., Park Y., Chung S., & Lee S. H..
Microfluidic assay of endothelial cell migration in 3D interpenetrating polymer
semi-network HA-Collagen hydrogel // Biomedical microdevices, 2011, 13(4), p.
717-723.
32. Huh D., Hamilton G. A., & Ingber D. E. From 3D
cell culture to organs-on-chips // Trends in cell biology, 2012, 21(12), p.
745-754.
33. Verbridge S. S., Chakrabarti A., DelNero P., Kwee B.,
Varner J. D., Stroock A. D., & Fischbach C. Physicochemical regulation of
endothelial sprouting in a 3D microfluidic angiogenesis model // Journal of
Biomedical Materials Research Part A, 2013,101(10), p. 2948-2956.
DEVELOPMENT OF MICROMACHINES CYBERNETIC PLATFORM FOR CULTIVATION
SELF-DEVELOP AND OPERATE ENDOTHELIAL CAPILLARY NETWORKS INVOLVING ORGANIZED IN
SPACE OF IN VITRO MICROFLOWS OF NUTRIENT MEDIUM
Naidyonov E. V.,
Jakimenko I. V., Glotov V. A.
Article is devoted to the creation of technology and
special equipment for the cultivation of spontaneously developing functioning
endothelial capillary networks in vitro - the basic framework for the creation
of artificial organs and tissues with desired biological properties. The
structure of the testing apparatus, described the process of his work. Proposed
technology, which produces three-dimensional tissue formation with desired
properties. Currently the world's capillary network formed mainly in the plane
of the microfluidic chips and not able to develop in space. Subject research
has scientific basis and is scientifically engineered follows two RFBR. Set out
in the decision have experimentally confirmed.
Key words: microfluidic chips, micro-flows, endothelial capillary network.
Кафедра электроники и микропроцессорной техники
«Национальный исследовательский университет «МЭИ» в г. Смоленске
Smolensk branch of
National Science University Moscow Power Engineering Institute
Кафедра анатомии человека
ГБОУ ВПО «Смоленская государственная медицинская
академия» Минздрава России
Поступила в редакцию 3.09.2014.