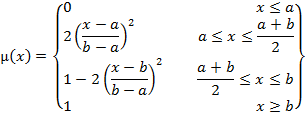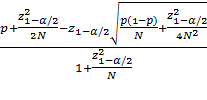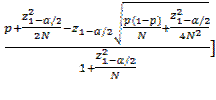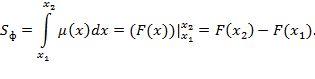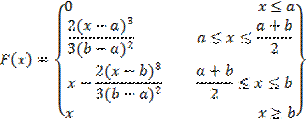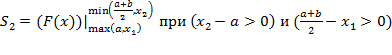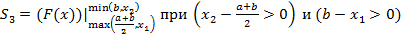Математическая
морфология.
Электронный
математический и медико-биологический журнал. - Т. 14. -
Вып. 2. - 2015. - URL:
http://www.smolensk.ru/user/sgma/MMORPH/TITL.HTM
http://www.smolensk.ru/user/sgma/MMORPH/N-46-html/TITL-46.htm
http://www.smolensk.ru/user/sgma/MMORPH/N-46-html/cont.htm
УДК 004.82 + 004.89
ГИБРИДНАЯ
МОДЕЛЬ МНОГОКРИТЕРИАЛЬНОГО ВЫБОРА АЛЬТЕРНАТИВ В ЗАДАЧЕ
ПОДДЕРЖКИ ПРИНЯТИЯ РЕШЕНИЙ ПО ПЕРВИЧНОМУ ВЫБОРУ АНТИМИКРОБНОЙ ТЕРАПИИ
Ó 2015 г.
Младов В. В., Зернов М. М., Кузьменков А. Ю., Белькова Ю. А.
Предложена гибридная
модель многокритериального выбора альтернатив при решении задачи поддержки
принятия решений по первичному назначению антимикробной
терапии, которая отличается совместным применением следующих частных моделей:
логическая модель выбора варианта расчёта и обоснования частных показателей качества,
модель учёта взаимного влияния показателей, учитывающая стохастическую и нестохастическую неопределённость, модели свёртки разноуровневых факторов влияния на значение показателя на
основе каскада функций суммирования и насыщения и модели выбора на основе нечёткого
отношения предпочтения. Рассмотрены общая структура модели, а также методы и
особенности расчёта частных показателей качества альтернатив.
Ключевые слова:
многокритериальный выбор,
нечёткое отношение предпочтения, модель оценивания, антимикробная
терапия, первичное назначение, стохастическая неопределённость, нестохастическая неопределённость.
1.
Актуальность
Антимикробные препараты (АМП) относятся к числу широко
применяющихся и высоко затратных групп лекарственных средств, на долю которых
приходится около 30% всех назначений и расходы на
которые составляют порядка 30-50% бюджета лечебно-профилактических учреждений
(ЛПУ), затрачиваемого на фармакотерапию [3, 6]. Нерациональное использование
АМП приводит к росту заболеваемости и смертности, сопровождается повышением
частоты развития нежелательных лекарственных реакций (НЛР), способствует
селекции устойчивых к препаратам штаммов[1]
микроорганизмов и повышает затраты на лечение.
В условиях стремительного роста
объёма медицинской информации, её децентрализации и разрозненности, высоких темпов
обновления клинических рекомендаций по лечению различных заболеваний,
интенсивного развития фармацевтического рынка и ежегодно изменяющейся
чувствительности микроорганизмов к АМП выбор оптимального для пациента варианта
антимикробной терапии (АМТ) в отведённый для данной
задачи короткий промежуток времени может вызывать у врача объективные
затруднения.
Одним из средств
повышения качества оказания медицинской помощи, в том числе в сфере АМТ,
является внедрение в клиническую практику информационных технологий. Доказано,
что при использовании компьютерных программ достоверность клинической
диагностики может быть улучшена на 20%, а студенты-медики, оценивая больных при
помощи структурированных листов, в которые заносятся данные анамнеза и обследования
пациента перед их введением в компьютерную программу, с последующей обработкой
данных компьютерной программой, ставят диагноз гораздо точнее [2].
Для оказания помощи врачу в процессе интерпретации
данных и характеристик пациента и принятия решений о тактике его ведения в
зарубежной клинической практике в течение последних 40 лет широко и успешно
используются системы поддержки принятия клинических решений (СППКР). В ходе
многочисленных исследований показана их способность значимо повышать
качество оказания медицинской помощи [6, 18] и приверженность стандартам
терапии [5], а также снижать частоту ошибочных назначений [5, 10]. При
этом положительное влияние СППКР на врачебную практику является более выраженным
и сохраняется на более длительный период по сравнению с другими видами мероприятий,
направленных на оптимизацию терапии [13, 16, 19].
Ярким представителем данного класса систем является «Health Evaluation through Logical Processing» (HELP), которая впервые была запущена в 1967 г. в больнице LDS (Солт-Лейк-Сити, штат Юта,
США). По результатам исследования 2002 г., HELP осуществила 94% успешных назначений против 77%
успешных назначений непосредственно врачами. Кроме того, средняя стоимость антибиотика
в составе назначения снизилась со $128 до $98, а также произошло повышение
выживаемости пациентов (например, для пациентов с острым
респираторным дистресс-синдромом выживаемость
составила 67% против 33% в контрольной группе) [11]. В настоящее время данная
СППКР интегрирована в работу многих ЛПУ США и ведётся разработка новой версии –
HELP2. Однако данный программный продукт является
коммерческим, алгоритмы его работы засекречены и соответствуют американским
стандартам лечения, которые в значительной степени отличаются от российских по
ряду причин.
Ещё одной перспективной разработкой в данном
направлении является IBM Watson - суперкомпьютер фирмы IBM, оснащённый
вопросно-ответной системой искусственного интеллекта, основная задача которого
– понимать вопросы, сформулированные на естественном языке, и находить на них
ответы в базе данных [8]. Среди различных сценариев использования IBM Watson предложены диагностика и лечение
пациентов, реализуемые на основе искусственной нейронной сети, постоянно
обучающейся путём сканирования миллионов медицинских документов. В настоящее
время происходит тестовый запуск шести экземпляров IBM Watson
в больницах США в качестве
диагностической системы. Несмотря на всю перспективность данной разработки,
стоит отметить отсутствие возможности получения обоснований полученных решений,
необходимость обязательного наличия постоянного подключения к сети Интернет, а
также невозможность вмешательства в алгоритмы подбора терапии и их
синхронизации с российскими стандартами лечения пациентов.
Таким образом, отсутствие аналогов в российской медицинской
практике и возможности адаптации зарубежных решений к отечественным стандартам
делают актуальной разработку собственной СППКР по выбору АМТ для оказания
помощи врачу в процессе первичного назначения АМТ (далее первичный выбор АМТ).
В результате внедрения данной разработки в клиническую
практику ожидается:
1) повышение качества оказания медицинской помощи за счёт
повышения безопасности антимикробной терапии;
2) снижение риска селекции резистентных к АМП штаммов
микроорганизмов;
3) уменьшение нагрузки на врачей за счёт автоматизации
работы с клиническими данными пациента;
4) повышение доступности информационных ресурсов и, как
следствие, информированности врачей об инфекционных заболеваниях и антимикробных препаратах.
2. Задача
поддержки принятия решений по первичному выбору АМТ
Первичный выбор АМП в рамках разрабатываемой
СППКР основан на анализе следующих признаков:
1) клинический диагноз (основной и сопутствующие
диагнозы, а также осложнения, диагностированные у пациента);
2) степень тяжести состояния пациента;
3) стандарты терапии данного инфекционного заболевания;
4) результаты бактериологического исследования
(определение возбудителя инфекции и спектра его чувствительности к АМП);
5) отсутствие чётко определённых требований к уровню антимикробной активности АМП для нозологий, протекающих с
различной степенью тяжести;
6) потенциальные ограничения в выборе АМП (особенности
состояния пациента);
7) предшествующая и сопутствующая терапия;
8) локальная политика применения АМП в ЛПУ;
9) наличие АМП в аптеке ЛПУ и их закупочная стоимость.
В силу вышесказанного,
решаемая задача поддержки принятия решений (ППР) обладает следующими
характеристиками:
1) осуществление многокритериального выбора и
ранжирования альтернатив в условиях совместного влияния разнонаправленных
факторов (показаний и противопоказаний альтернатив);
2) отсутствие явно выраженной функции оценивания качества
альтернатив;
3) стохастическая и нестохастическая
неопределённость условий, в которых осуществляется выбор альтернатив;
4) возможная неполнота исходной информации.
3. Общая
структура гибридной модели многокритериального выбора альтернатив
Для решения поставленной задачи предложена гибридная
модель многокритериального выбора, которая включает в себя логическую модель
выбора вида терапии и расчёта основных показателей качества альтернатив, модель
многокритериального выбора на основе нечёткого отношения предпочтения, а также
функции оценки взаимодействий АМП между собой и выборки списка АМП по заданным
критериям.
Общая структура модели представлена на рисунке 1.
Входными данными для гибридной модели являются:
- данные пациента (клинический диагноз, оценка тяжести
состояния, информация о гиперчувствительности, результаты лабораторных анализов
и список препаратов предшествующей и сопутствующей терапии);
- данные по определению чувствительности к различным
антибиотикам;
- клинические рекомендации и различные справочные
данные.
-
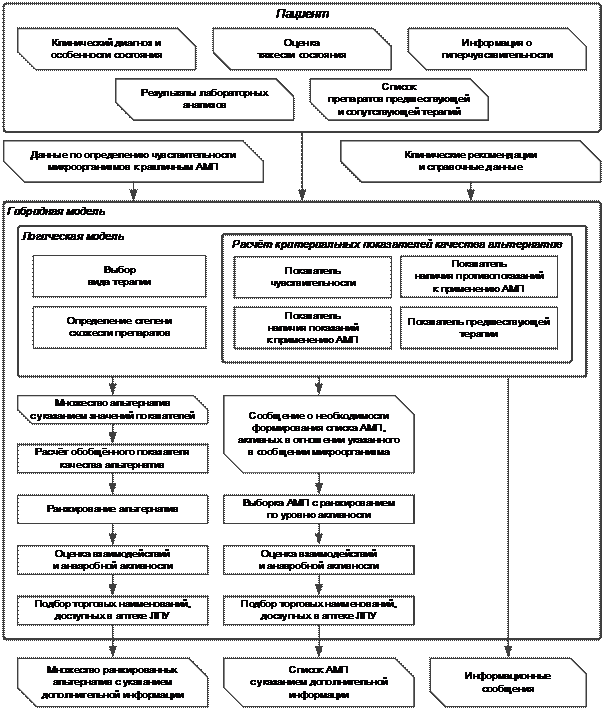
Рисунок 1 – Общая структура гибридной модели
многокритериального выбора альтернатив
Информация о клиническом диагнозе
включает в себя основной диагноз пациента, для которого производится
определение множества альтернатив с последующим выбором оптимальной из них, а
также сопутствующие диагнозы и осложнения, значимые при выборе оптимального
варианта АМТ по основному диагнозу.
В контексте гибридной модели под основным диагнозом
понимается тот диагноз, для которого проводится выбор и ранжирование возможных
вариантов назначений (альтернатив). Этот диагноз указывается врачом при запуске
системы и может не соответствовать основному диагнозу, указанному в анамнезе.
К особенностям состояния пациента относятся
потенциальные ограничения в выборе АМП (беременность, период лактации и т.п.).
Оценка тяжести состояния – это показатель, выраженный
числом от 0 до 1 и полученный на основе одной из существующих шкал для
различных нозологий (MPM, SAPS, APACHE, POSSUM и
т.п.).
Информация о гиперчувствительности включает в себя
названия антибиотиков или их классов, для которых ранее были случаи
возникновения аллергических реакций у данного пациента.
К результатам лабораторных анализов относятся
результаты бактериологического исследования (проводимые с целью выяснения
возбудителей заболевания или инфекции, указанного как основной диагноз), а
также результаты тестирования выделенных штаммов микроорганизмов на
чувствительность к различным антибиотикам или их классам (если они
проводились).
Список препаратов предшествующей терапии – это
перечень названий антибиотиков, которые ранее (как правило, в течение последних
трёх месяцев) принимал пациент, с оценкой эффективности данной терапии. Список
препаратов сопутствующей терапии – перечень антимикробных
препаратов, которые в настоящее время принимает пациент и взаимодействие
с которыми необходимо учесть при выборе АМТ.
Данные по определению чувствительности к различным
антибиотикам – это сводные статистические данные, полученные по результатам
тестирования чувствительности амбулаторной и нозокомиальной
флоры к различным классам АМП. Приоритетными здесь являются локальные данные о
чувствительности по региону, в котором расположено ЛПУ. В случае их отсутствия
используются данные, полученные в ходе многоцентровых исследований, проводимых
НИИ антимикробной химиотерапии ГБОУ ВПО СГМУ Минздрава
России (НИИАХ).
Клинические рекомендации по ведению пациентов включают
перечень возможных опций эмпирической (в отсутствие достоверной информации о
возбудителей у данного пациента) терапии различный инфекционных заболеваний. К
рекомендациям, установленным экспертным путём, относится перечень возможных
опций этиотропной (при известном возбудителе) терапии
для различных комбинаций диагноз-возбудитель. Справочные данные – это
классификации нозологий, их возбудителей и АМП, а также информация об
активности АМП к анаэробным возбудителям, соответствие торговых наименований
лекарственных препаратов[2]
их международным непатентованным наименованиям[3]
(МНН) и данные о взаимодействиях различных АМП между собой.
Выбор альтернатив на основе клинических
рекомендаций осуществляется по МНН, однако в системе заложена возможность
назначения АМП с указанием конкретных торговых наименований. При интеграции с
аптечным модулем ЛПУ врачу одновременно с МНН могут предоставляться сведения о
доступных торговых наименованиях АМП в составе назначения с указанием их
закупочной стоимости.
При выборе АМТ для снижения риска
возникновения НЛР крайне важно учесть взаимодействие предлагаемых опций терапии
с антибактериальными лекарственными препаратами, которые в настоящее время
пациент уже принимает по тем или иным причинам или которые могут быть ему
назначены одновременно с текущей АМТ. Для этого в
системе заложена справочная информация о клинических рекомендациях
об известных взаимодействиях АМП друг с другом. В результате работы данного модуля
для каждого назначения осуществляется вывод справочной информации о существующих
ограничениях по одновременному приёму АМП.
Все этапы получения рекомендаций о
возможных назначениях (выбор эмпирической терапии или этиотропной
терапии, несоответствие выделенного возбудителя диагнозу и др.) протоколируются
и выводятся врачу в качестве справочной информации.
4. Функции
логической модели
Основным компонентом предложенной гибридной модели
является логическая модель, на которую возложены следующие функции:
1) выбор вида терапии;
2) формирование множества допустимых альтернатив;
3) расчёт частных показателей качества каждой
альтернативы из множества допустимых;
4) вывод сообщений о необходимости формирования
дополнительного списка АМП, активных в отношении указанного в сообщении
микроорганизма;
5) вывод информационных сообщений.
Выбор вида терапии (эмпирическая
или этиотропная) осуществляется в зависимости от
наличия или отсутствия результатов бактериологического исследования.
Альтернатива в рамках первичного выбора АМТ – это
назначение (опция терапии), в состав которого могут входить один или более АМП.
При проведении эмпирической терапии, когда нет достоверной информации о
выделенном у пациента микроорганизме, отбор потенциально возможных опций терапии
проводится на основе клинических рекомендаций. Каждая из таких опций терапии,
как правило, включает в себя нескольких АМП с целью воздействовать на
максимальное количество потенциальных возбудителей инфекционного процесса.
Опции этиотропной терапии в большинстве случаев содержат лишь один АМП,
что обусловлено возможностью более точного воздействия ввиду наличия
достоверной информации о возбудителе инфекционного процесса.
Формирование множества альтернатив, из которого
впоследствии происходит выбор оптимальной альтернативы, осуществляется на
основе клинических рекомендаций, которые являются входными данными для
логической модели.
К показателям качества альтернатив относятся:
1) показатель чувствительности;
2) показатель наличия противопоказаний к применению АМП;
3) показатель наличия показаний к применению АМП;
4) показатель предшествующей терапии.
Функции, реализующие логику выбора вида терапии,
формирования множества пригодных альтернатив и расчёта показателей их качества
выходят за рамки данной статьи.
Рассмотрим математический аппарат, применяемый при
расчёте показателей качества альтернатив.
5. Особенности
расчёта показателей качества альтернатив
1) показатель
чувствительности
Данный показатель обладает наиболее высоким приоритетом
среди всех частных показателей качества. Алгоритм его расчёта зависит от
выбранного вида терапии.
При проведении эмпирической терапии возбудитель
инфекции у пациента неизвестен, и проведение вычислений на основе данных по
какому-либо микроорганизму невозможно. В связи с этим величина показателя
задана экспертным путём на основе клинических рекомендаций по эмпирической
терапии различных нозологий и равна 1 для назначений, являющихся терапией
выбора, и 0.85 для назначений, относящихся к альтернативным опциям терапии.
В случае, когда возбудитель известен, становится
возможным проведение этиотропной терапии. В этом
случае значение показателя чувствительности альтернативы определяется на
основании информации о чувствительности выделенного возбудителя к различным
классам АМП и равно максимуму из показателей чувствительности АМП, образующих
альтернативу.
При наличии результатов тестирования чувствительности
штаммов, выделенных непосредственно у пациента, к рассматриваемому
АМП показатель его чувствительности выражается бинарной величиной: 0 или 1.
Однако в подавляющем большинстве
случаев эти данные отсутствуют, и для оценки вероятности того, что антибиотик
активен к возбудителю, выделенному у пациента, используются сводные
статистические данные по результатам определения чувствительности (локальные
или полученные в ходе многоцентровых исследований, проводимых НИИАХ), которые
представляют собой общее количество протестированных к конкретному антибиотику
штаммов данного вида или семейства микроорганизмов и относительную частоту
чувствительных изолятов в выборке.
Поскольку относительная частота штаммов, которые
оказались чувствительными, является случайной величиной, имеет место
стохастическая неопределённость.
Оценка тяжести состояния пациента, рассчитанная по
одной из клинических шкал для различных нозологий, представляется числом от 0
до 1, отражающим вероятность смерти пациента. С увеличением этой вероятности
возрастают требования к уровню активности АМП в отношении возбудителя
инфекционного процесса. Однако рекомендации, позволяющие чётко установить
границы областей достаточной и недостаточной активности АМП при различной
степени степени тяжести
инфекции, отсутствуют. Таким образом, имеет место также нестохастическая
неопределённость.
Для учёта прямой зависимости этих величин используется
s-образная
функция принадлежности (ФП) нечёткого множества:
|
|
|
(1) |
Положение области возрастания значений ФП отражает
требуемый уровень активности АМП к возбудителю и определяется вектором
параметров (a, b),
возвращаемым отображением g от величины
оценки степени тяжести, которое, например, может быть задано экспертным путём:
- g(0.00:0.35):
(0.65, 0.80);
- g(0.36:0.70):
(0.72, 0.87);
- g(0.71:1.00): (0.82, 0.94).
Стоит отметить, что данный подход учитывает лишь то
значение относительной частоты штаммов, чувствительных к АМП, которое было
рассчитано по выборке из результатов определения чувствительности (локальных
или полученных в ходе многоцентровых исследований, проводимых НИИАХ). Однако
объём выборки для различных видов и семейств микроорганизмов различен и может
быть небольшим. Учёт объёма выборки N возможен через расчёт доверительного интервала (ДИ),
поскольку его ширина обратно пропорциональна величине N.
В исследованиях по медицине стандартом является
применение 95%-ного ДИ, наиболее оптимальную оценку которого [4, 7, 12, 14]
осуществляет метод Уилсона (Wilson),
предложенный в 1927 г. [20].
В общем виде ДИ по формуле Уилсона вычисляется
следующим образом:
|
|
[ |
(2) |
где ![]() принимает
значение 1,96 при расчете 95%-ного ДИ,
принимает
значение 1,96 при расчете 95%-ного ДИ,
N – количество наблюдений,
р
– частота встречаемости признака в выборке.
Показатель чувствительности АМП определяется
как оценка возможности того, что будут выполнены требования к уровню его
активности, задаваемые нечёткой ФП на отрезке, ограниченном минимальным и
максимальным значениями рассчитанного 95%-ного ДИ относительной частоты
чувствительности микроорганизмов к АМП:
|
|
|
(3) |
где Sф – площадь фигуры под графиком s-образной
ФП нечёткого множества;
Sп – площадь прямоугольника под графиком ФП µ(x) = 1;
x1 и x2 – границы 95%-ного ДИ.
Графически отношение площадей представлено на рисунке
2.
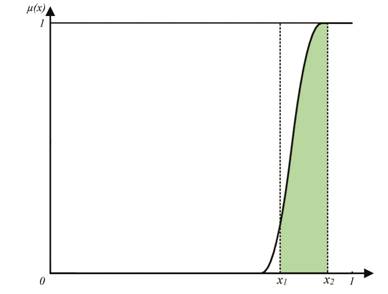
Рисунок 2 – Расчёт показателя
чувствительности АМП через отношение площадей
Поскольку ФП µ(x) непрерывна на отрезке [0; 1], в пределах которого всегда расположены
границы 95%-ного ДИ x1 и x2, то для
нахождения площади закрашенной на рисунке криволинейной трапеции Sф
проинтегрируем функцию принадлежности µ(x) на отрезке
[x1; x2],
используя формулу Ньютона-Лейбница:
|
|
|
(4) |
Для этого найдём для µ(x) первообразную F(x):
|
|
|
(5) |
Поскольку положение и длина
отрезка ДИ заранее неизвестны, в общем случае его границы могут принадлежать разным отрезкам кусочной
ФП, и тогда закрашенная на рисунке 2 фигура представляет собой объединение
криволинейных трапеций, образованных границами ДИ и границами отрезков ФП. Таких трапеций может быть от
одной до четырёх. В этом случае площадь всей закрашенной фигуры равна сумме
площадей этих криволинейных трапеций (по свойству аддитивности
площади):
|
|
|
(6) |
Если ни одна из точек x1 и x2 не принадлежит отрезку ФП, соответствующая ему
площадь равна 0.
На основании вышеизложенного, пользуясь формулой (4), вычислим площади S1, S2, S3 и S4 по
следующим правилам:
|
|
|
(7) |
|
|
|
(8) |
|
|
|
(9) |
|
|
|
(10) |
Для нахождения площади
прямоугольника под графиком ФП µ(x) = 1 снова
воспользуемся формулой (4):
|
|
|
(11) |
Таким образом, для реализации
функции расчёта значения показателя чувствительности
предложена модель оценивания взаимного влияния показателей, учитывающая стохастическую
и нестохастическую неопределённость.
2) показатель
наличия противопоказаний к применению АМП
Уровень критичности противопоказаний для приёма
конкретного АМП различен, в результате чего они были разделены на два класса:
значимые и незначимые.
Коэффициенты значимости противопоказаний распределены
следующим образом:
- коэффициент незначимых противопоказаний принадлежит
отрезку [0.1; 0.3];
- коэффициент значимых противопоказаний принадлежит отрезку
[0.5; 0.7].
В связи со сложностью оценки потенциальных
взаимосвязей между противопоказаниями и неопределённостью степени их
выраженности, в рамках данной модели противопоказания рассматриваются как
независимые. Таким образом, наличие одного противопоказания не влияет на
вероятность появления или усугубление течения другого противопоказания.
Влияние противопоказаний с низким уровнем критичности
зачастую можно исключить (например, отказаться от кормления грудью на период
проведения АМТ). В то же время, влияние противопоказаний с высоким уровнем
критичности (например, тяжёлая почечная недостаточность) на профиль
безопасности лечения очень велико, и наличие у пациента хотя бы одного
противопоказания этого класса значительно увеличивает риск возникновения НЛР, в
том числе с летальным исходом.
На основе вышеизложенных особенностей предметной
области сформулированы следующие ограничения, накладываемые на показатель
качества альтернативы:
1) незначительное влияние противопоказаний с низким
уровнем критичности;
2) влияние даже одного серьёзного противопоказания
значительно выше суммарного влияния всех незначимых противопоказаний;
3) необходимость учёта совместного влияния
противопоказаний различных классов на итоговый показатель качества
альтернативы.
Для расчёта показателя качества альтернатив с учётом
перечисленных ограничений используется взвешенное суммирование с нелинейным
преобразованием, реализуемое с помощью сигмоидальной
функции, взвешенной на величину α:
|
|
|
(12) |
Получение итогового значения показателя качества
происходит путём свёртки коэффициентов критичности противопоказаний в три
этапа:
1) суммирование коэффициентов критичности незначимых
противопоказаний с передачей полученной суммы в сигмоидальную
функцию;
2) суммирование коэффициентов критичности значимых
противопоказаний с передачей полученной суммы в сигмоидальную
функцию;
3) суммирование взвешенных сумм значимых и незначимых
противопоказаний с передачей полученной суммы в сигмоидальную
функцию.
Параметры коэффициентов сигмоидальной
функции для всех трёх этапов были установлены экспертным путём и равны:
- свёртка значений коэффициентов критичности незначимых
противопоказаний: α = 0.4; β = 2;
- свёртка значений коэффициентов критичности значимых
противопоказаний: α = 0.8; β = 4;
- свёртка значений, полученных на предыдущих этапах: α = 1; β = 2.
Графически структура расчёта
показателя наличия противопоказаний к применению АМП через свёртку коэффициентов
серьёзности противопоказаний представлена на рисунке 3.
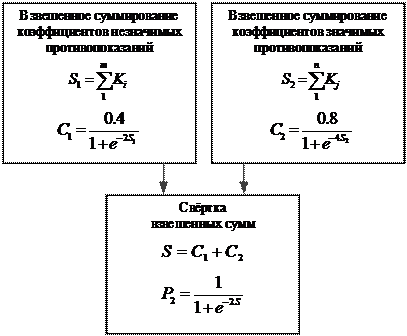
Рисунок 3 – Структура расчёта показателя наличия
противопоказаний к применению АМП
Таким образом, для реализации
функции расчёта показателя наличия противопоказаний к
применению АМП предложена модель свёртки разноуровневых
факторов влияния на значение показателя на основе каскада функций суммирования
и насыщения.
3)
показатель наличия показаний к применению АМП
Показатель наличия показаний к применению АМП для каждой
альтернативы рассчитывается как сумма весовых коэффициентов тех показаний к
применению АМП, которые одновременно встречаются как в инструкции по применению
любого из АМП в составе назначения, так и среди характеристик пациента.
Поскольку формирование множества допустимых
альтернатив при обоих видах терапии происходит на основе информации об основном
диагнозе пациента, который, по сути, является ключевым и поэтому наиболее
приоритетным показанием, то при расчёте данного частного показателя качества
альтернатив он не учитывается.
Влияние всех остальных показаний, которые могут быть у
пациента, считается одинаковым, поэтому коэффициент важности каждого из них
принят равным единице.
Таким образом, при наличии у пациента n показаний,
каждое из которых совпадает с показаниями к назначению хотя бы одного АМП в
составе назначения, значение показателя равно n:
|
|
|
(13) |
4) показатель
предшествующей терапии
Значение данного частного показателя качества
альтернатив P4 рассчитывается как максимум из весовых коэффициентов
отдельных АМП в составе назначения, каждый из которых, в свою очередь,
определяется как максимум из степеней его схожести с каждым АМП из списка
предшествующей терапии пациента.
6. Многокритериальный выбор альтернатив
В результате работы логической модели сформирован
список допустимых альтернатив с указанием рассчитанных для них значений критериальных показателей качества P1, P2, P3 и P4.
Становится возможным расчёт обобщённого показателя качества альтернатив,
реализуемый на основе нечёткого отношения предпочтения, который подробно
изложен в [20]. Рассчитанные таким образом значения и являются основанием для
ранжирования альтернатив по степени предпочтения.
7. Оценка
соответствия возбудителя локализации и диагнозу
Список допустимых альтернатив является основным, но не
единственным результатом работы логической модели. При наличии у пациента
нескольких инфекционных заболеваний одновременно на вход логической модели
подаются только результаты бактериологического анализа, относящиеся к
выбранному пользователем основному диагнозу (т.е. зона, в которой был
осуществлен забор клинического материала у пациента, совпадает с локализацией,
которая соответствует его основному диагнозу).
При соответствии возбудителя локализации и диагнозу
проводится подбор этиотропной терапии на основании
известной по результатам данного бактериологического исследования или экстраполированной
(на основе сводных статистических данных локальных или многоцентровых
клинико-микробиологических исследований) активности АМП в отношении выделенного
микроорганизма.
В случае выделения возбудителя из зоны, маркированной
в системе как не соответствующая основному диагнозу,
данные бактериологического анализа не учитываются. В этом случае система
выводит сообщение о невозможности использования результатов бактериологического
исследования для выбора опций терапии и предлагает пользователю перечень
альтернатив эмпирической АМТ, полученных по писанному ранее алгоритму.
При выделении из
соответствующей основному диагнозу зоны микроорганизма, отсутствующего в списке
ассоциированных с диагнозом, данные бактериологического анализа не
учитываются при подборе опций терапии по данному диагнозу в связи с
невозможностью однозначно оценить причины указанного события и степень
соответствия информации реальной клинической ситуации. В данном случае, аналогично предыдущему случаю,
осуществляется проведение эмпирической АМТ. Однако
возбудитель выделен, и оставлять его без внимания нерационально. Поэтому при возникновении описанной ситуации
врачу предоставляется список АМП, активных к данному организму, формирование
которого осуществляется на основании сводных статистических данных по результатам
определения чувствительности (локальных или полученных в ходе многоцентровых
исследований, проводимых НИИАХ). Ранжирование АМП в данном списке осуществляется
по значению относительной частоты чувствительных штаммов в выборке.
Необходимо отметить, что результаты
бактериологического анализа могут содержать информацию о более чем одном микроорганизме,
если инфекция у пациента вызвана, так называемой, смешанной флорой (два и более возбудителей). Экспертным путём установлена
необходимость обработки каждого из возбудителей отдельно с
последующим выводом по каждому из выделенных микроорганизмов возможных опций
терапии с указанием дополнительной информации для каждой из них, что
позволит врачу самостоятельно решить, какая комбинация препаратов в итоге будет
назначена пациенту.
8. Учёт возможного наличия анаэробных возбудителей и
подбор опций антианаэробной терапии
При ряде инфекционных заболеваний в
перечне возможных возбудителей присутствуют анаэробные[4]
микроорганизмы изолированно или в сочетании с аэробными[5] микроорганизмами.
В клинических рекомендациях, на основании которых формируется перечень средств
эмпирической терапии указанных инфекций, данная возможность изначально учтена и
все режимы обладают необходимой антианаэробной
активностью.
В то же время, подбор средств этиотропной АМТ в рамках предложенной логики осуществляется
исключительно в отношении выделенных при бактериологическом исследовании
микроорганизмов. Однако в рутинной клинической практике исследования, направленные
на выявление анаэробов, как правило, не проводятся, что не позволяет подобрать этиотропную АМТ для возбудителей данной группы.
В связи с вышеуказанным, на
этапе выбора вида терапии в логической модели проводится проверка присутствия в
списке основных возбудителей инфекции анаэробов, при положительном результате
которой в дополнение к перечню опций этиотропной
терапии, активной в отношении аэробных возбудителей, дополнительно формируется
и ранжируется множество альтернатив эмпирической антианаэробной
терапии. В дальнейшем проводится проверка наличия у выбранных средств этиотропной терапии антианаэробной
активности и, при её отсутствии, предлагается дополнительное назначение одной
из альтернатив с антианаэробной активностью из
сформированного списка.
9. Анализ
лекарственных взаимодействий
При выборе АМТ для снижения риска
возникновения НЛР крайне важно учесть взаимодействие предлагаемых опций терапии
с антибактериальными лекарственными препаратами, которые в настоящее время
пациент уже принимает по тем или иным причинам или которые могут быть ему
назначены одновременно с текущей АМТ. Для этого в
системе заложена справочная информация о клинических рекомендациях
об известных взаимодействиях АМП друг с другом. В результате работы данного
модуля для каждого назначения осуществляется вывод справочной информации о существующих
ограничениях по ондовременному приёму АМП.
Выбор альтернатив на основе клинических
рекомендаций осуществляется по МНН, однако в системе заложена возможность
назначения АМП с указанием конкретных торговых наименований. При
интеграции с аптечным модулем ЛПУ врачу одновременно с МНН могут
предоставляться сведения о доступных торговых наименованиях АМП в составе
назначения с указанием их закупочной стоимости.
Все этапы получения рекомендаций о
возможных назначениях (выбор эмпирической терапии или этиотропной
терапии, несоответствие выделенного возбудителя диагнозу и др.) протоколируются
и выводятся врачу в качестве справочной информации.
Заключение
Таким образом, предложена гибридная модель
многокритериального выбора, отличающаяся совместным применением
следующих частных моделей:
- логической модели выбора варианта расчёта и обоснования частных
показателей качества,
- модели учёта взаимного влияния показателей, учитывающей стохастическую и нестохастическую неопределённость,
- модель свёртки разноуровневых
факторов влияния на значение показателя на основе каскада функций суммирования
и насыщения,
- модели выбора на основе нечёткого отношения предпочтения,
позволяющая решить задачу многокритериального выбора и
ранжирования альтернатив в условиях совместного влияния разнонаправленных
факторов и обосновать полученное решение.
Данная модель предназначена для оказания помощи врачу
в интерпретации данных пациента при первичном выборе АМТ с целью повышения
качества принятия клинических решений.
ЛИТЕРАТУРА
1) Андрейчиков А.В., Андрейчикова
О.Н. Анализ, синтез, планирование решений в экономике – М.: Финансы и
статистика, 2000. — 368 с.: ил.
2) Общая и неотложная хирургия: руководство / ред. С. Патерсон-Браун; пер. с англ. под ред. В.К. Гостищева. – М.:
ГЭОТАР-Медиа, 2010. – 384 с.: цв.
ил. – (Серия «Руководства для специалистов хирургической практики»).
3)
Рачина С.А., Фролова
А.С. Андреева А.С. Анализ потребления антимикробных
препаратов для системного применения в многопрофильном стационаре. КМАХ 2005;
7(Suppl 1): 49.
4)
Agresti A. Approximate is
better than exact for interval estimation of binomial proportions / A. Agresti, B. Coull // American
statistician.
– 1998. – N 52. – С. 119–126.
5) Bates D.W., Teich J.M., Lee
J. and others. The impact of computerized physician order entry on medication
error prevention. J Am Med Inform Assoc 1999;6:313-21.
6)
Vlahović-Palcevski V., Dumpis U., Mitt P., et
al. Benchmarking antimicrobial drug use at university hospitals in five
European countries. Clin Microbiol
Infect 2007; 13(3):277-83
7)
Brown L. D. Interval estimation for a binomial
proportion / L. D. Brown, T. T. Cai,
A. Dasgupta // Statistical science. – 2001. – N 2. – P. 101–133.
8) IBM Watson
[Электронный ресурс] // Википедия. – Режим доступа: https://ru.wikipedia.org/wiki/IBM_Watson,
свободный (дата обращения: 28.05.2015 г.)
9) IBM Watson закончил
мединститут и пошёл на работу [Электронный ресурс] // Хабрахабр.
– Режим доступа: http://habrahabr.ru/company/ibm/blog/169067/,
свободный (дата обращения: 28.05.2015 г.)
10) Kaushal R., Shojania K.G., Bates D.W. Effects of
computerized physician order entry and clinical decision support systems on
medication safety: a systematic review. Arch Intern Med 2003;163:1409-16.
11) Kharrazi H. CDSS in
Clinical Practice (Intermountain Healthcare) [Электронный
ресурс] // SlideServe.
Режим доступа: http://www.slideserve.com/lane/info-i642-clinical-decision-support-systems, свободный (дата обращения:
28.05.2015 г.)
12) Newcombe R. G. Two-Sided
Confidence Intervals for the Single Proportion: Comparison of Seven Methods /
R. G. Newcombe // Statistics in Medicine. – 1998. – N. 17. – P. 857–872.
13) Oxman A.D.,
Thomson M.A., Davis D.A. and others. No magic bullets: a systematic review of
102 trials of interventions to improve professional practice. CMA J 1995;153:1423-31.
14) Sauro J. Estimating
completion rates from small samples using binomial confidence intervals:
comparisons and recommendations / J. Sauro, J. R.
Lewis // Proceedings of the human factors and ergonomics society annual meeting. – Orlando, FL, 2005.
15) Shiffman R.N., Liaw Y., Brandt C.A. and others.
Computer-based guideline implementation systems: a systematic review of
functionality and effectiveness. J Am Med Inform Assoc 1999;6:104-14.
16) Thomson O’Brien M.A., Oxman
A.D., Davis D.A. and others. Audit and feedback versus alternative strategies:
effects on professional practice and health care outcomes. Cochrane Database Syst Rev 2000;2:CD000260.
17) Vlahović-Palcevski V., Dumpis U., Mitt P. and others. Benchmarking antimicrobial
drug use at university hospitals in five European countries. Clin Microbiol Infect 2007;13(3):277-83.
18) Walton R.T., Harvey E., Dovey
S. and others. Computerised advice on drug dosage to
improve prescribing practice. Cochrane Database Syst
Rev 2001;1:CD002894.
19) Weingarten S.R., Henning J.M., Badamgarav
E. and others. Interventions used in disease management programmes
for patients with chronic
illness—which ones work? Meta-analysis of published reports. BMJ
2002;325:925-32.
20) Wilson E. B.
Probable inference, the law of succession, and statistical inference / E. B.
Wilson // Journal of American Statistical Association. – 1927. – N 22. – P. 209–212.
1 Штамм -
чистая культура микроорганизмов, выделенная в определённое время и в определённом
месте.
2 Торговое наименование лекарственного средства – наименование лекарственного средства, присвоенное его
разработчиком. Является уникальным и позволяет идентифицировать препарат,
произведенный определенной компанией.
3Международное
непатентованное наименование – уникальное наименование
действующего вещества лекарственного средства, рекомендованное Всемирной
организацией здравоохранения.
4Анаэробные микроорганизмы –
микроорганизмы, осуществляющие процессы жизнедеятельности при отсутствии свободного кислорода.
5Аэробные микроорганизмы –
микроорганизмы, которые нуждаются в свободном молекулярном кислороде для осуществления процессов жизнедеятельности.
THE HYBRID MULTICRITERIA CHOICE AND RANKING
MODEL IN DECISION SUPPORT PROBLEM OF THE PRIMARY PRESCRIBING OF THE
ANTIMICROBIAL THERAPY
Mladov V. V., Zernov M. M., Kuzmenkov A. U., Belkova U. A.
The
proposed hybrid model of multicriteria choice and
ranking the finite set of alternatives in decision support problem of the
primary prescribing of the antimicrobial therapy differs from others by combining
the following submodels: the logical model of the choice and the justification
the partial quality coefficients method, the model of the mutual accounting the
stochastic and non-stochastic uncertainty influences, the convolution model of
the two-level influences based on the cascade of the summation and saturation
functions and the model of the
choice based on the fuzzy preference relation. The article describes the
general structure of the model, methods and peculiarities of the partial
quality coefficients calculating.
Key words: multicriteria choice and ranking,
fuzzy preference relation, estimation model, antimicrobial therapy, the primary
prescribing, stochastic uncertainty, non-stochastic uncertainty.
Младов Владимир Валентинович
Зернов Михаил Михайлович, к.т.н.
Кузьменков Алексей Юрьевич
Белькова Юлия Андреевна, к.м.н.
vovoch@gmail.com
Филиал федерального государственного бюджетного образовательного
учреждения высшего профессионального образования
«Национальный исследовательский университет «МЭИ»
в г. Смоленске
Поступила в редакцию 15.06.2015.