Математическая
морфология.
Электронный
математический и медико-биологический журнал. - Т. 16. -
Вып. 4. -
2017. - URL:
http://www.sci.rostelecom67.ru/user/sgma/MMORPH/TITL.HTM
http://www.sci.rostelecom67.ru/user/sgma/MMORPH/N-56-html/TITL-56.htm
http://www.sci.rostelecom67.ru/user/sgma/MMORPH/N-56-html/cont.htm
УДК
616.12-004-02:616.152.21-06:612.017.1]-092.9
СОСТОЯНИЕ
ГУМОРАЛЬНОГО ИММУНИТЕТА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ДИФФУЗНОМ КАРДИОСКЛЕРОЗЕ У КРЫС С
ВРОЖДЕННОЙ РАЗНОЙ ИНДИВИДУАЛЬНОЙ РЕЗИСТЕНТНОСТЬЮ К ГИПОКСИИ
© 2017. Сатурская А. С., Потиха
Н. Я, Сатурская У. В.
В статье исследовано и проанализировано выявленные
изменения содержания Ig M, Ig G, Ig A при сформированном диффузном ишемически-некротическом
кардиосклерозе (этап наблюдения 30 суток), которые существенно зависят от
резистентности животных к гипоксии. Выявлено, что моделирование диффузного
кардиосклероза сопровождается увеличением содержания Ig G
в сыворотке крови у животных с низкой и средней устойчивостью к гипоксии, а у
высокоустойчивых к гипоксии животных достоверно не отличается от показателя
группы контроля. Содержание Ig M и Ig A при моделировании диффузного
кардиосклероза у животных всех экспериментальных групп уменьшено, что
свидельствует об угнетении гуморального звена иммунитета на данном этапе, что
наиболее выражено у животных с низкой устойчивостью к гипоксии.
Ключевые
слова: резистентность к гипоксии, диффузный кардиосклероз, иммуноглобулины
А, М, G.
Введение
Микрососудистые
расстройства, развивающиеся на фоне длительного течения ишемической болезни
сердца приводят к нарушению локального кровотока в органах и тканях, ухудшению
газообмена и развитию хронической тканевой гипоксии. Вместе с тем, снижение
оксигенации является далеко не единственным механизмом тканевых повреждений при
ИБС и, в частности, кардиоклерозе [1]. Гипоксия является очень
важным звеном в патогенезе кардио-васкулярной патологии. В наших предыдущих
исследованиях анализировались механизмы влияния индивидуальной резистентности к
гипоксии при кардиосклерозе на активацию свободно-радикальных процессов,
интенсивность системных воспалительных реакций, некоторые метаболические
расстройства [2]. Известно, что эти изменения способствуют
накоплению в тканях неутилизированных продуктов, развитию эндотоксикоза, что
является важным механизмом активации апоптоза клеток поврежденных органов (в
том числе, миокарда), их деструкции и ускоренной гибели [3].
В условиях сопровождающего кардиосклероз нейро-иммуно-эндокринного дисбаланса,
эти звенья патогенеза замыкаются в порочный круг, разорвать который очень
сложно. Поэтому глубокое изучение особенностей каждого из этих звеньев, и в
особенности, реакции иммунной системы, у животных с разной индивидуальной
резистентностью к гипоксии является актуальной задачей экспериментальной
медицины.
Моделирование диффузного
ишемически-некротического кардиосклероза у крыс с разной врожденной устойчивостью
к гипоксии поможет раскрыть особенности изменений гуморального звена иммунной
системы организма при изучаемой патологии на этапе сформированного фиброза
миокарда и сердечной недостаточности.
Целью нашего исследования является изучение влияния индивидуальной резистентности к гипоксии
на состояние гуморального иммунитета при смоделированном экспериментальном
диффузном кардиосклерозе.
Материалы и методы исследования.
Эксперименты были проведены на 48 белых
половозрелых лабораторных крысах-самцах массой 190-
В качестве объективного критерия эффективности
экспериментальной модели использовали морфологическое исследование миокарда для
выявления соединительнотканных элементов с помощью окраски гистологических
препаратов по Масону [6] на этапе наблюдения 30 суток ДИНКС.
Для статистической обработки результатов использовали
параметрические и непараметрические методы оценки полученных данных. Для всех показателей
рассчитывали значение средней арифметической выборки (M), стандартное
отклонение. Достоверность разницы значений между независимыми количественными
величинами определяли при нормальном распределении по критерию Стьюдента, в
других случаях – с помощью критерия Манна-Уитни. Различие между величинами
считали достоверными при величине р<0,05. Статистическая обработка выполнена
в отделе системных статистических исследований ГВУЗ "Тернопольский
государственный медицинский университет имени И.Я. Горбачевского МОЗ
Украины" в программном пакете Statsoft STATISTICA 6.0. («Statsoft», США).
Результаты исследования и их обсуждение.
Через 30
суток с момента моделирования ДИНКС гистологическое исследование миокарда
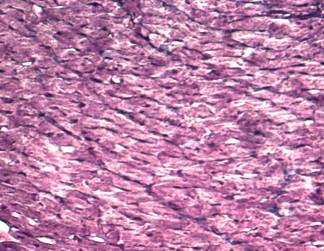
показало, что на микропрепаратах сердец животных контрольных групп (Рис. 1),
независимо от устойчивости к гипоксии, соединительная ткань представлена очень
незначительно в виде тонких коллагеновых волокон.
|
|
|
|
Рис. 1.
Миокард крысы контрольной группы. Окраска по Масону. х 400. |
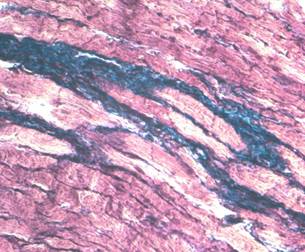
Рис. 2. Разрастание соединительной ткани в
миокарде крысы при ДИНКС (30 суток), выраженная гипертрофия кардиомиоцитов.
Окраска по Масону. х 400. |
На
микропрепаратах сердец животных со смоделированным ДИНКС (Рис. 2) было выявлено
очаговый кардиосклероз, периваскулярный склероз, гиперэластоз внутренней
мембраны сосудов микроциркуляторного русла, гипертрофию кардиомиоцитов, диффузное
разрастание соединительной ткани. Все вышеперечисленные признаки наиболее выражены
у НГЖ и указывают на наиболее интенсивное развитие диффузного кардиосклероза у
животных с низкой устойчивостью к гипоксии, что подтверждается результатами,
полученными в ходе других экспериментов [2].
Результаты
определения содержания иммуноглобулинов M, G, A в сыворотке крови крыс с разной
устойчивостью к гипоксии при смоделированном диффузном кардиосклерозе, на этапе
наблюдения 30 суток выявили выраженные нарушения гуморального звена иммунной
системы.
Развитие
ДИНКС у низкоустойчивых к гипоксии животных сопровождалось уменьшением
содержание Ig M на 41,3 % (р<0,001), чем в контрольной группе
(Табл. 1), у среднеустойчивых к гипоксии животных – на 21,8 % (р<0,001) меньше, чем в соответствующей
контрольной группе, а высокоустойчивые к гипоксии животные на моделирование ДИНКС
среагировали менее интенсивными изменениями содержания Ig
M, и этот показатель был меньше, чем у соответствующей контрольной группы
животных на 19,4 % (р<0,01).
Таблица 1
Содержание иммуноглобулинов M, G, A в сыворотке крови крыс с разной устойчивостью к гипоксии при диффузном
кардиосклерозе, (M±m)
|
Устойчивость животных к гипоксии |
Контроль |
ДИНКС, этап наблюдения 30 суток |
|
Ig M, г/л |
||
|
Низкоустойчивые (n=8) |
0,76±0,02 |
0,45±0,04 р<0,001 |
|
Среднеустойчивые (n=8) |
0,75±0,02 |
0,59±0,02 р<0,001 |
|
Высокоустойчивые (n=8) |
0,73± 0,02 |
0,59± 0,03 р<0,01 |
|
Ig G, г/л |
||
|
Низкоустойчивые (n=8) |
1,23±0,02 |
1,67±0,03 р<0,001 |
|
Среднеустойчивые (n=8) |
1,21±0,02 |
1,31±0,02 р<0,01 |
|
Высокоустойчивые (n=8) |
1,19± 0,02 |
1,25±0,02 |
|
Ig A, г/л |
||
|
Низкоустойчивые (n=8) |
0,34±0,02 |
0,23±0,02 р<0,01 |
|
Среднеустойчивые (n=8) |
0,35±0,02 |
0,27±0,02 р<0,01 |
|
Высокоустойчивые (n=8) |
0,35±0,01 |
0,28±0,02 р<0,05 |
Примечание. р – достоверность различий в
сравнении с соответствующей контрольной группой животных.
Моделирование
диффузного кардиосклероза у низкоустойчивых к гипоксии животных привело к
увеличению содержания Ig G в сыворотке крови на 35,7 % (р<0,001), в сравнении
с контрольной группой (Табл. 1), а у среднеустойчивых к гипоксии животных
– соответственно на 8,1 % (р<0,01). У
высокоустойчивых к гипоксии животных на этапе наблюдения 30 суток ДИНКС не выявлено достоверных отличий от контрольной группы за
исследуемым показателем.
Содержание
Ig А у животных всех экспериментальных групп значительно уменьшилось к этапу
наблюдения 30 суток ДИНКС: на 31,0 % (р<0,01) у низкоустойчивых к гипоксии
животных, на 24,2 % (р<0,01) у среднеустойчивых к гипоксии животных, на 19,7
% (р<0,05) у высокоустойчивых к гипоксии животных, чем в соответствующих
контрольных группах.
Анализ
изменений содержание различных классов иммуноглобулинов в сыворотке крови
показал, что к этапу сформированного кардиосклероза наблюдается угнетение иммунитета,
что подтверждается выраженным уменьшением содержания Ig М и Ig А в сыворотке
крови животных. В то же время
незначительное повышение содержания Ig G, особенно интенсивно
выраженное у низкоустойчивых к гипоксии животных, свидетельствует о сохраняющемся
напряжении иммунного ответа на собственные поврежденные ткани. Это значительно
влияет на течение изучаемого процесса.
Сравнение
содержания различных классов иммуноглобулинов в сыворотке крови между группами
животных с разной резистентностью к гипоксии показало более интенсивное
угнетение иммунитета у низкоустойчивых к гипоксии животных. При моделировании
ДИНКС содержание Ig М в сыворотке крови низкоустойчивых к
гипоксии животных было на 23,7 % (р<0,05) меньше, чем у
среднеустойчивых и высокоустойчивых к гипоксии животных.
Содержание
Ig G
в сыворотке крови низкоустойчивых
к гипоксии животных было на 23,5 % (р<0,001) больше, чем у
среднеустойчивых к гипоксии животных. У высокоустойчивых к гипоксии животных
этот показатель был на 4,6 % (р<0,05) меньше, чем содержание Ig G в сыворотке
крови животных со средней устойчивостью к гипоксии. По данному показателю различие
между низко и высокоустойчивыми к
гипоксии животными составляло 33,6 % (р<0,001).
Несмотря на
уменьшение содержания Ig А в сыворотке крови животных всех экспериментальных
групп, достоверных различий между животными с разной резистентностью к гипоксии
на изучаемом этапе формирования кардиосклероза не обнаружено.
Реакция
иммунной системы на антиген может быть первичной и вторичной. Первичный ответ возникает в случае
первого контакта иммунной системы с антигеном. Он реализуется через несколько
дней, пока В-лимфоциты трансформируются в плазматические клетки и начнут синтезировать
Ig M. На этапе сформированного ДИНКС выявлено уменьшение содержания Ig M, и
увеличение содержания Ig G, что указывает на преобладание вторичной ответной
реакции на данном этапе. Вторичный ответ возникает после повторного контакта
иммунной системы с антигеном, развивается быстро (2-3 дня) с помощью Ig G. При
моделировании диффузного кардиосклероза антигенами могут быть поврежденные
клетки миокарда, которые претерпевают некротических изменений при катехоламиново-кальциевой
модели повреждения миокарда и эти антигены, вероятно, образуются в течении
всего периода фиброза миокарда, а не только на начальном этапе. Это подтверждается
сохраняющимся напряжением иммунитета, о чем свидетельствует повышенное содержание
Ig G, несмотря на общее его угнетение. Наиболее интенсивно это проявляется у
низкоустойчивых к гипоксии животных и подтверждается наиболее интенсивными кардиосклеротическими
изменениями.
Иммунная
система, вместе с нервной и эндокринной системами, относится к основным
регуляторным системам организма и в условиях развития ДИНКС она играет важную
роль. Существует
тесная взаимосвязь между иммунной системой и цитокиновыми механизмами регуляции
при развитии патологии. Результаты наших предыдущих исследований выявили разнонаправленную
реакцию провоспалительных и противовоспалительных цитокинов в сыворотке крови у
животных с низкой устойчивостью к гипоксии. Такой дисбаланс цитокинового
профиля может вызывать нарушения активации и дифференциации иммунокомпетентных
клеток, а отсюда и развитие иммунопатологических реакций, нарушений гомеостаза
и прямого повреждающего эффекта цитокинов с последующим развитием фиброза
миокарда [1, 7].
Выявленные
особенности реакции цитокинов [2] и иммунной системы имеют значительное модулирующее влияние на активность
пролиферативных процессов в миокарде при развитии ДИНКС. Полученные данные подтверждаются
и другими научными исследованиями воспалительных изменений [3, 8, 9, 10] и
иммунных нарушений [11, 12, 13] при патологии
сердца. Исследования показали, что при хроническом воспалении (Low-grade
inflammation) в миокарде [14]
уменьшается сократимость миокарда, возникает гипертрофия и фиброз, что приводит
к ремоделированию сердца. Исследования влияния модуляторов
гипоксия-индуцированного фактора-1 (HIF-1) [15] значительно расширили представление
о значении гипоксии в патогенезе многих заболеваний. Выявленные нами различия в
иммунном статусе животных с разной резистентностью к гипоксии имеют важное
значение в анализе патофизиологических изменений гомеостаза в условиях
недостатка кислорода, а также ишемии. Активность кардиосклеротического процесса
поддерживается хронической гипоксией и ишемией миокарда. В формировании
адекватного ответа организма на гипоксию важную роль играет гипоксия-индуцированный
фактор (HIF), в первую очередь, его 1α изоформа (HIF-1α) [15]. В
условиях хронической гипоксии рост уровня HIF-1α приводит к необратимому
повреждению структур миокарда и развитию фиброза. Основными точками воздействия
при этом являются: непосредственная регуляция фиброгенеза, контроль эпитеально-мезангиальной
трансформации; модуляция процессов воспаления, что подтверждается в данном
исследовании. Однако сегодня определено, что спектр реакций при активации
HIF-1α значительно шире и включает изменения в ангиогенезе, эритропоэзе,
клеточном метаболизме в целом, а также в механизмах регуляции апоптоза [15].
Контроль последнего сложен и зависит от баланса активности про- и антиапоптозных
факторов, в котором важную роль играют белки семейства Bcl, цитокиновые механизмы и реакция клеточного и гуморального звеньев иммунной
системы.
Клинические исследования довели [16], что у большого количества пациентов с терминальной стадией
сердечной недостаточности, независимо от этиологии, выявлено накопление антител
к сердечной ткани, что свидетельствует о гуморальной активации и является
показателем прогрессирования заболевания.
В процессе моделирования диффузного
кардиосклероза выявлены иммунные и воспалительные изменения с характерными
особенностями, зависящими от индивидуальной резистентности животных к гипоксии.
Эти особенности непосредственно влияют на активность фиброза сердечной мышци
[1, 17] и тяжесть сердечной недостаточности.
Выводы
1.
Изменения содержания Ig M, Ig G, Ig A на этапе сформированного диффузного
ишемически-некротического кардиосклероза
существенно зависят от
резистентности животных к
гипоксии.
2.
Моделирование диффузного кардиосклероза сопровождается увеличением содержания
Ig G
в сыворотке крови у животных с низкой и средней устойчивостью к гипоксии, а у
высокоустойчивих к гипоксии живостных достоверно не отличается от показателя
группы контроля.
3.
Содержание Ig M и Ig A при моделировании диффузного кардиосклероза у животных
всех экспериментальных групп уменьшено. Угнетение гуморального звена иммунитета
на данном этапе наиболее выражено у животных с низкой устойчивостью к гипоксии.
Перспективы дальнейших исследований. Учитывая результаты, полученные в
данной экспериментальной работе, а также наши предыдущие исследования, в
дальнейшем целесообразно изучить перспективные пути коррекции выявленных нарушений с помощью препаратов,
стимулирующих эндогенные механизмы кардиопротекции у животных с разной устойчивостью
к гипоксии.
Литература
1.
Endomyocardial fibrosis:
pathological and molecular findings of surgically resected ventricular
endomyocardium / S. D. Iglezias, L. A. Benvenuti, F. Calabrese [et al.] //
Virchows Arch. – 2008. – V. 453, N. 3. – P. 233 – 241.
2. Сатурская А. С.
Изменения цитокинового профиля крови при экспериментальном диффузном
кардиосклерозе у крыс с различной устойчивостью к гипоксии / А. С. Сатурская, Ю. И. Бондаренко,
В. Е. Пелых // J. of Education, Health and Sport. – 2015. – Т. 5, №
2. – С. 66–78.
3. TNF provokes cardiomyocyte apoptosis and cardiac remodeling through activation
of multiple cell death pathways / S. B. Haudek, G. E. Taffet,
M. D. Schneider [et al.] // J. Clin. Invest. – 2007. – V. 117, N. 9. – P. 2692
– 2701.
4. Чернушенко Е. Ф. Иммунологические методы исследований в клинике / Е. Ф.
Чернушенко, Л. С. Когосова. – К. : Здоров’я, 1978. – 159 с.
5. Клиническая иммунология и аллергология / Под ред.
А. В. Караулова. – М. : МИА, 2002. – 651 с.
6. Меркулов Г.А. Курс патогистологической
техники / Меркулов Г.А. – Л.: Медицина, 1969. – 422 с.
7.
Does inflammation
trigger fibrosis in hypertrophic cardiomyopathy: a burning question? /Dirk
Westermann // Heart. – 2012. – V. 98, N. 13. – P. 965 – 966.
8.
The influence of
aetiology on inflammatory and neurohumoral activation in patients with severe
heart failure: a prospective study comparing Chagas' heart disease and
idiopathic dilated cardiomyopathy / A. O. Mocelin, V. S. Issa, F.
Bacal [et al.] // Eur. J. Heart Fail. – 2005. – V. 7, N. 1. – P. 869 – 873.
9.
Gullestad L. Review of trials in chronic heart failure showing
broad-spectrum anti-inflammatory approaches / L.
Gullestad, P. Aukrust //
Am. J. Cardiol. – 2005. – V. 95, N. 1. – P. 17 – 23.
10.
Inflammatory and
anti-inflammatory cytokines in chronic heart failure: potential therapeutic
implications / P. Aukrust, L. Gullestad, T. Ueland [et al.] // Ann. Med. –
2005. – V. 37, N. 1. – P. 74 – 85.
11.
A study to assess the effects of a broad-spectrum immune
modulatory therapy on mortality and morbidity in patients with chronic heart
failure: the ACCLAIM trial rationale and design / G. Torre-Amione, R. C. Bourge, W.
12.
Immune modulation in heart failure:
past challenges and future hopes / J. H. Flores-Arredondo, G.
García-Rivas, G. Torre-Amione // Curr. Heart Fail. Rep. –2011. – V. 8,
N. 1. – P. 28-37.
13.
The role of B-cells in heart failure
/ A. M. Cordero-Reyes, K. A.
Youker, G. Torre-Amione // Methodist Debakey Cardiovasc. J. – 2013. – V.
9, N. 1. – P. 15-19.
14. Low-grade inflammation and the phenotypic expression of myocardial fibrosis
in hypertrophic cardiomyopathy // J. Kuusisto,
V. Kärjä,
P. Sipola
[et al.] // Heart.
– 2012. –
V. 98, N. 13. – P. 1007 – 1013.
15. HIF-1α and HIF-2α induce angiogenesis and improve muscle energy recovery / H. Niemi,
K. Honkonen,
P. Korpisalo
[et al.] // Eur. J. Clin. Invest. – 2014. – V. 44,
N. 10. – P. 989 – 999.
16. High proportion of patients with end-stage heart failure
regardless of aetiology demonstrates anti-cardiac antibody deposition in
failing myocardium: humoral activation, a potential contributor of disease
progression / K.
A. Youker, C. Assad-Kottner,
A. M. Cordero-Reyes
[et al.] // Eur.
Heart J. – 2014. – V. 35, N. 16.
– P. 1061-1068.
17. Effects of telmisartan on inflammation and fibrosis after acute
myocardial infarction in rats / Z. Song, J.
Bai, L.
Zhang [et
al.] // Zhonghua Yi
Xue Za Zhi. – 2014. – V. 94, N. 33.
– P. 2628 – 2633.
THE STATE OF
Saturska H. S., Potikha N.Ya., Saturska U.V.
The article studies and analyzes the changes
identified in the Ig M, Ig G, Ig A content formed with diffuse
ischemic-necrotic cardiosclerosis at the observation stage of 30 days, which
depend significantly on the resistance of animals to hypoxia. It is shown that
the modeling of diffuse cardiosclerosis is accompanied by increase of Ig G
content in blood serum of animals with low and medium resistance to hypoxia.
The Ig G content in animals with high resistance to hypoxia was not significantly
different from its level in the control group. Content of Ig M and Ig A at
modeling of diffuse cardiosclerosis in all experimental groups of animals is
reduced, which testifies to the inhibition of humoral immunity at this stage,
which is most pronounced in animals with low resistance to hypoxia.
Key words: resistance to hypoxia,
diffuse cardiosclerosis, immunoglobulins A, M, G.
Работа
выполнена в ГВУЗ "Тернопольский государственный медицинский университет
имени И. Я. Горбачевского Министерства здравоохранения Украины" на кафедре
патологической физиологии.
Сведения об авторах:
Сатурская
Анна Степановна –
д.м.н., зав. кафедры социальной медицины, организации и экономики здравоохранения
с медицинской статистикой ГВУЗ "Тернопольский государственный медицинский
университет имени И. Я. Горбачевского Министерства здравоохранения
Украины", кафедра социальной медицины,
организации и экономики здравоохранения с медицинской статистикой, ул. Словацкого, 2, Тернополь, Украина,
тел. 098 0651672
Потиха
Наталья Ярославовна –
к.м.н., доцент кафедры функциональной
и лабораторной диагностики ГВУЗ "Тернопольский государственный
медицинский университет имени И. Я. Горбачевского Министерства здравоохранения
Украины", кафедра функциональной и лабораторной диагностики, ул. Клиническая, 6, Тернополь, Украина,
тел. 098 4631225
potikha@tdmu.edu.ua
Сатурская
Ульяна Владимировна –
студентка 4 курса ГВУЗ "Тернопольский государственный медицинский
университет имени И. Я. Горбачевского Министерства здравоохранения
Украины", кафедра
патологической физиологии, ул. Чехова, 3, Тернополь, Украина,
тел. 098 3900743
ГВУЗ «Тернопольский
государственный медицинский университет имени И.Я. Горбачевского МЗ Украины»,
г. Тернополь
SHEI “I.
Поступила в редакцию 19.10.2017.