Математическая
морфология.
Электронный
математический и медико-биологический журнал. - Т. 17. -
Вып. 4. -
2018. - URL:
http://www.sci.rostelecom67.ru/user/sgma/MMORPH/TITL.HTM
http://www.sci.rostelecom67.ru/user/sgma/MMORPH/N-60-html/TITL-60.htm
http://www.sci.rostelecom67.ru/user/sgma/MMORPH/N-60-html/cont.htm
УДК:
616.12-004-02:616.152.21-06:612.017.1]-092.9
НОВЫЕ
ПОДХОДЫ К РЕШЕНИЮ МЕДИКО-СОЦИАЛЬНОЙ ПРОБЛЕМЫ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ С
УЧЕТОМ ИНДИВИДУАЛЬНОЙ ХОЛИНОРЕАКТИВНОСТИ ОРГАНИЗМА
©
В статье представлены результаты научного исследования
влияния
нарушений нервно-медиаторных процессов регуляции сердца на формирование постишемического
кардиосклероза в зависимости от индивидуальной реактивности организма, а
именно, от индивидуальной чувствительности организма к гипоксии в эксперименте.
Исследование доказало, что индивидуальная реактивность организма, в
частности чувствительность к гипоксии, в некоторой степени определяется холинергической
регуляцией, и этому факту следует уделять особое внимание как с позиций патогенетической
оценки формирования кардиосклероза, так и с позиций формирования новых подходов
к профилактике и лечению сердечно-сосудистых заболеваний.
Ключевые
слова: сердечно-сосудистые заболевания, устойчивость к гипоксии,
диффузный кардиосклероз, индивидуальная реактивность.
Введение
Сердечно-сосудистые заболевания (ССЗ)
являются основной причиной смерти во всем мире. По оценкам ВОЗ, ежегодно от ССЗ
умерает приблизительно 18 мил. человек, что составляет 31% всех случаев смерти
в мире [4, 14]. Более 75% случаев смерти от ССЗ происходят в странах с низким и
средним уровнем дохода [14]. Поэтому для ученых возникают все новые задачи,
способствующие решению многих проблемных вопросов патогенеза сердечно-сосудистых
заболеваний, которые в настоящее время остаются недостаточно изученными и
дискуссионными. Заболевания сердца, которые усложняются некротическим
повреждением кардиомиоцитов с последующим склерозированием миокарда, клинически
проявляются ишемической болезнью сердца, кардиосклерозом с признаками хронической
сердечной недостаточности и аритмиями [3, 4, 6].
Выраженное влияние на исход ишемии
миокарда и развитие кардиосклеротичного процесса имеет индивидуальная
реактивность и резистентность организма. Значительный интерес для ученых в
данном контексте представляет индивидуальная резистентность организма к
гипоксии, ведь именно ишемические и гипоксические воздействия являются ведущим
звеном в патогенезе диффузного кардиосклероза [3, 5, 7, 8].
По мнению многих ученых, повлиять на эти
процессы в определенной степени можно путем достижения оптимального баланса
между активностью симпатической и парасимпатической звеньев вегетативной
нервной системы [1, 2, 13]. Известно, что холинергическая регуляция при
определенных условиях может осуществлять кардиопротекторное стресс-лимитирующее
влияние, поэтому исследование особенностей адренергически-холинергического
баланса в процессе развития кардиосклероза является очень актуальным [2, 13].
Однако роль нервно-медиаторных процессов в патогенезе диффузного ишемически-некротического
кардиосклероза (ДИНКС) не поддавалась системному анализу.
Цель исследования
Определить влияние нарушений
нервно-медиаторных процессов регуляции сердца на формирование постишемического
кардиосклероза в зависимости от индивидуальной реактивности организма, а
именно, от индивидуальной чувствительности организма к гипоксии в эксперименте.
Объект и методы исследования
Эксперименты проведены на 96 половозрелых
белых нелинейных крысах-самцах массой 190-
Для исследования вариабельности
сердечного ритма на этапах наблюдения 7, 14 и 30 суток при ДИНКС был
использован метод вариационной кардиоинтервалометрии [1,2]. После регистрации
электрокардиограммы (ЭКГ) во II стандартном отведении вычисляли следующие
показатели: частоту сердечных сокращений, ∆ Х - вариационный размах вариант (исчисляется как разница между
наибольшим и наименьшим значениями продолжительности R-R), выражали в секундах
(с), Мо - мода, продолжительность интервала R-R, который в исследуемом отрезке
электрокардиограммы встречается наиболее часто, выражали в секундах (с) АМо -
амплитуда моды, количество кардиоинтервалов, соответствующих значению моды,
выражали в процентах (%). Статистическая обработка результатов выполнена в
отделе системных статистических исследований ГВУЗ «Тернопольский государственный
медицинский университет имени И.Я. Горбачевского МОЗ Украины» в программном
пакете Statsoft STATISTICA с использованием параметрических и непараметрических
методов оценки полученных данных.
Результаты исследования и их обсуждение
Моделирование
ДИНКС обусловило достоверно значимые изменения вегетативного равновесия на всех
этапах наблюдения. Наиболее интенсивно ЧСС увеличилась при моделировании ДИНКС
в группе животных с низкой устойчивостью к гипоксии (рис. 1), и уже на этапе
наблюдения 7 дней ДИНКС была на 25% больше, чем у контрольных животных. К
следующим этапам наблюдения - 14 и 30 суток ДИНКС ЧСС продолжала расти, и была
больше соответственно на 37% и 47%.
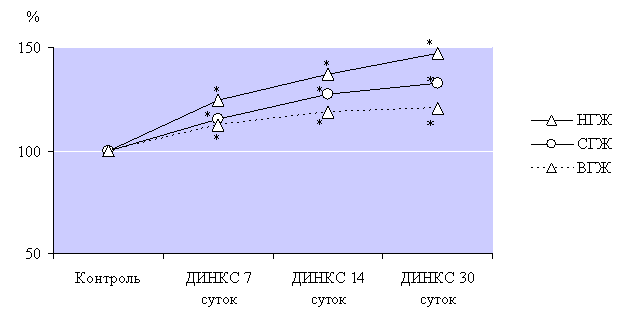
Рис. 1. Динамика
интенсивности увеличе итии ДИНКС.
Примечание: * - р<0,05, достоверное различие ния
показателя частоты сердечных сокращений при разв относительно контрольных групп
животных с различной устойчивостью к гипоксии.
Животные со
средней устойчивостью к гипоксии характеризовались несколько менее интенсивными
изменениями ЧСС, тогда как животные с высокой устойчивостью к гипоксии
испытывали минимальные изменения по данному показателю, что свидетельствовало о
менее выраженном адренергическом влиянии при развитии кардиосклероза.
Динамика
интенсивности уменьшения показателя Мо при развитии ДИНКС характеризовала
уменьшение парасимпатических влияний в регуляции сердечного ритма. Глубокие
нарушения выявлены у животных с низкой устойчивостью к гипоксии (рис. 2): уменьшение
показателя Мо этапах наблюдения 7, 14 и 30 суток ДИНКС прогрессировало, и исследуемый
показатель составлял лишь 75%, 63% и 53% от показателя контрольных животных с
низкой устойчивостью к гипоксии.
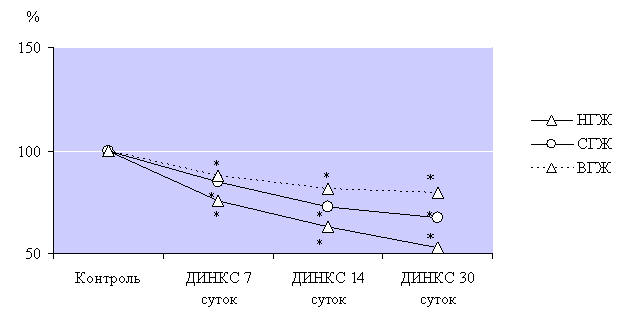
Рис. 2. Динамика
интенсивности уменьшения показателя Мо при развитии ДИНКС.
Примечание: * - р<0,05, достоверное различие
относительно контрольных групп животных с различной устойчивостью к гипоксии.
У животных
со средней устойчивостью к гипоксии показатель Мо также уменьшился, однако
менее интенсивно и составил 85%, 73% и 67% от показателя Мо контрольных
животных со средней устойчивостью к гипоксии на этапах наблюдения 7, 14 и 30
суток ДИНКС. Животные с высокой устойчивостью к гипоксии характеризовались
минимальными изменениями Мо, ведь этот показатель составил 88%, 81% и 80% от
показателя Мо контрольных животных с высокой устойчивостью к гипоксии на этапах
наблюдения 7, 14 и 30 суток ДИНКС.
Показатель
АМо при развитии ДИНКС характеризовал участие адренергической звена в регуляции
работы сердца, поэтому рост данного показателя вариационной кардиоинтервалометрии
указывал на усиление адренергических влияний на протяжении эксперимента.
Наиболее выраженными эти изменения были в низкоустойчивых к гипоксии животных
(рис. 3), а наименее - у животных с высокой устойчивостью к гипоксии.
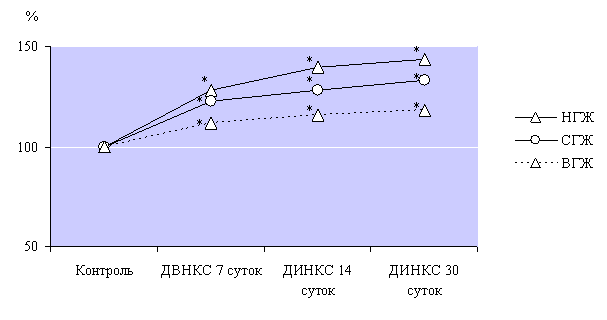
Рис. 3. Динамика
интенсивности роста показателя АМо при развитии ДИНКС.
Примечание: * - р<0,05, достоверное различие
относительно контрольных групп животных с различной устойчивостью к гипоксии.
При
развитии ДИНКС показатель вариационного размаха кардиоинтервалов был наименьшим
в низькостийких к гипоксии животных (рис. 4), и составил 79%, 74%, 67% от
показателя ∆ Х контрольных животных на этапах наблюдения 7, 14 и
30 суток ДИНКС. Вариационный размах кардиоинтервалов является очень чувствительным
показателем изменений холинергической регуляции сердечного ритма, поэтому его
уменьшение является неблагоприятным признаком при данной патологии, ведь
указывает на ограничение холинергических кардиопротекторных воздействий. В
группе СГЖ данный показатель испытывал подобные изменения, однако менее
выраженные, а у животных с высокой устойчивостью к гипоксии боле выраженное
сохранение холинергических влияний отразилось приближением вариационного размаха
кардиоинтервалов к показателю контрольных животных.
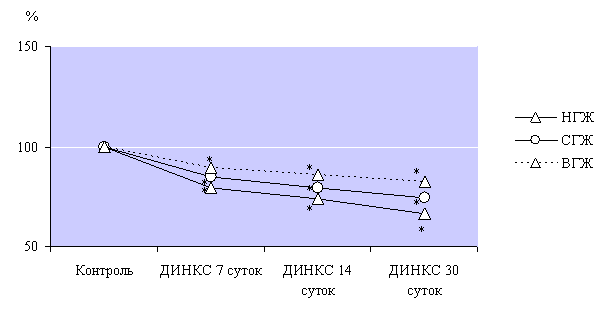
Рис. 4. Динамика
интенсивности уменьшения показателя вариационного размаха кардиоинтервалов при
развитии ДИНКС.
Примечание: * - р<0,05, достоверное различие
относительно контрольных групп животных с различной устойчивостью к гипоксии.
Анализ
результатов по изучению адренергически-холинергического баланса показал, что
холинореактивность имеет выраженное влияние на процессы кардиосклерозирования,
ведь у животных с высокой устойчивостью к гипоксии развитие патологии
сопровождался менее выраженными нарушениями. Это сочеталось со снижением уровня
провоспалительных цитокинов и повышением уровня противовоспалительных цитокинов,
а также меньшим уровнем связанного оксипролина. Интересен факт существования
рецепторов к АХ не только на клетках-пейсмекерах и кардиомиоцитах, но и на
фибробластах, что имеет большое значение в возможности АХ влиять на активность
этих клеток, которым принадлежит ведущая роль в процессах кардиосклерозирования
[9, 10, 11, 12]. Исследованиями van M.A. Maanen, S.P. Stoof (в
Следовательно,
при моделировании ДИНКС, у животных с высокой устойчивостью к гипоксии более
активно вовлекаются холинергические механизмы стимуляции АХ специфических
рецепторов на поверхности не только пейсмекерных клеток и кардиомиоцитов, но и
фибробластов, имеет принципиальное значение в активности процессов кардиосклерозирования.
Суммируя
данные экспериментального исследования механизмов развития ДИНКС и используя
комплексную оценку исследований, освещенных в доступных нам отечественных и
зарубежных источниках научной литературы, можно отобразить два возможных пути
патогенеза фиброза миокарда схематично, которые, замыкаясь в «порочный круг»
(рис. 5), приводят к развитию персистирующего фиброза миокарда.
Как видно
из представленной схемы, такие звенья патогенеза, как некроз кардиомиоцитов, воспалительная
реакция, активация фибробластов, ишемия и гипоксия миокарда, имеют решающее значение
в формировании «порочного круга» при диффузном ишемически-некротическом
кардиосклерозе. Профилактика и этиопатогенетическое лечение должно быть направлено
на уменьшение действия этиотропных факторов, приводящих к некрозу
кардиомиоцитов и повышение устойчивости организма к гипоксическим воздействиям
на клеточном уровне, то есть на прерывание «порочного круга», что в
значительной степени зависит от холинореактивности организма.
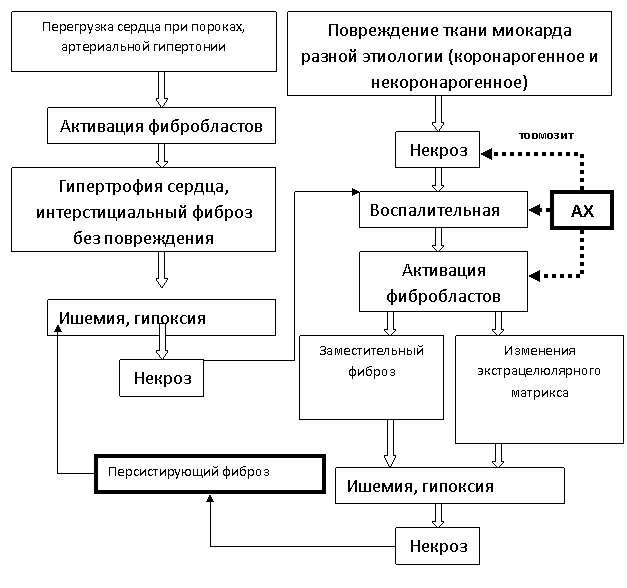
Рис. 5. Схема патогенеза
диффузного ишемически-некротического кардиосклероза вследствие перегрузки
сердца и при повреждении ткани миокарда различной этиологии и формирование
«порочного круга» и
персистирующего фиброза
миокарда с указанием «точек приложения» ацетилхолина.
Выводы
1.
Формированию диффузного кардиосклероза у особей с разной резистентностью к
гипоксии способствуют нарушения нервно-медиаторных процессов, в частности
адренергически-холинергического баланса, проявляющиеся в повышении
адренергического контроля и уменьшении влияния парасимпатической звена вегетативной
нервной системы.
2. Данные
закономерности наиболее выражены у низкоустойчивых к гипоксии животных, тогда
как высокоустойчивые к гипоксии животные при развитии диффузного кардиосклероза
характеризуются минимальными изменениями холинергического контроля.
3.
Индивидуальная реактивность организма, в частности чувствительность к гипоксии,
в некоторой степени определяется холинергической регуляцией, и этому факту следует
уделять особое внимание как с позиций патогенетической оценки формирования кардиосклероза,
так и с позиций формирования новых подходов к профилактике и лечению.
Литература
1.
Баевский
Р. М. Математический анализ изменений сердечного ритма при стрессе / Р. М. Баевский,
О. И. Кириллов, С. З. Клецкин. – М. : Наука, 1984. – 221 с.
2.
Исследования вегетативной регуляции
кровообращения в условиях длительного космического полета / Р.М.
Баевский, Е.С. Лучицкая, И.И. Фунтова [и др.] // Физиология человека. – 2013. –
№ 5. – С. 42-52.
3.
Сатурская
А. С. Изменения цитокинового профиля крови при экспериментальном диффузном
кардиосклерозе у крыс с различной устойчивостью к гипоксии / А. С. Сатурская, Ю. И. Бондаренко,
В. Е. Пелых // J. of Education, Health and Sport. – 2015. – Т. 5, №
2. – С. 66–78.
4. A study to assess the effects of a broad-spectrum immune
modulatory therapy on mortality and morbidity in patients with chronic heart
failure: the ACCLAIM trial rationale and design / G. Torre-Amione, R. C. Bourge,
W.
5. Cardiac fibroblasts, fibrosis and extracellular matrix remodeling in
heart disease / D. Fan, A. Takawale, J. Lee [et al.] // Fibrogenesis Tissue
Repair. – 2012. – Vol. 5, № 1. – P. 15.
6.
Effects of telmisartan
on inflammation and fibrosis after acute myocardial infarction in rats / Z. Song, J.
Bai, L.
Zhang [et
al.] // Zhonghua Yi
Xue Za Zhi. – 2014. – V. 94, N. 33.
– P. 2628 – 2633.
7. Endomyocardial fibrosis: pathological and molecular findings of surgically
resected ventricular endomyocardium / S. D. Iglezias, L. A. Benvenuti,
F. Calabrese [et al.] // Virchows Arch. – 2008. – V. 453, N. 3. – P. 233 –
241.
8. Krenning G
The origin of fibroblasts and mechanism of cardiac fibrosis / G. Krenning,
E. M. Zeisberg,
R. Kalluri
// J. Cell
Physiol. – 2010. – Vol. 225, № 3. – P. 631–
637.
9.
Switch regulation
of interleukin-1 beta in downstream of inflammatory cytokines induced
by two micro-sized silica particles on differentiated THP-1 macrophages / T. Zhou, X.
Cui, Y.
Zhou [et
al.] // Environ. Toxicol. Pharmacol. –
2015. – V. 39, N. 1. – P. 457 – 466.
10.
The alpha7 nicotinic
acetylcholine receptor on fibroblast – like synoviocytes and in synovial tissue
from rheumatoid arthritis patients: a possible role for a key neurotransmitter
in synovial inflammation / M. A. van Maanen, S. P.
Stoof, E. P. van der Zanden [et al.] // Arthritis.
Rheum. – 2009. – Vol. 60, №. 5. – P. 1272–1281.
11.
The role of inflammation
in the pathogenesis of heart failure / K. A. Lisman,
S. J. Stetson,
M. M. Koerner
[et al.] // Curr. Cardiol. Rep.
– 2002. – V. 4, N. 3. – P. 200-205.
12.
TNF provokes
cardiomyocyte apoptosis and cardiac remodeling through activation of multiple
cell death pathways / S. B. Haudek, G. E. Taffet, M. D. Schneider [et
al.] // J. Clin. Invest.
– 2007. – V. 117, N. 9. – P. 2692 – 2701.
13.
Vagus nerve stimulation:
a new bioelectronics approach to treat rheumatoid arthritis? / F. A. Koopman, P. R. Schuurman, M. J. Vervoordeldonk [et al.] // Best Pract. Res. Clin. Rheumatol. –
2014. – Vol. 28, № 4. – P. 625–635.
14. World Health Organization. Global Health Observatory Data Repository. Cardiovascular
diseases, deaths per 100 000
Data by country [Електронний
ресурс]. – Режим
доступу : http://apps.who.int/gho/data/node.main.A865CARDIOVASCULAR?lang=en
NEW APPROACHES TO SOLVING MEDICAL AND SOCIAL PROBLEMS
OF CARDIOVASCULAR DISEASES TAKING INTO ACCOUNT THE INDIVIDUAL CHOLINORAACTIVITY
OF THE ORGANISM
Saturska H. S., Potikha N. Ya.,
The article
presents the results of a scientific study of the effect of disorders of the
neuro-mediator processes of heart regulation on the formation of post-ischemic
cardiosclerosis depending on the organism’s individual reactivity, namely, on
the individual sensitivity of the organism to hypoxia in the experiment. The
study proved that the individual reactivity of the organism, in particular,
sensitivity to hypoxia, is to some extent determined by cholinergic regulation,
and this fact should be given special attention both from the standpoint of
pathogenetic evaluation of the formation of cardiosclerosis, and from the
standpoint of the formation of new approaches to the prevention and treatment
of cardiovascular diseases.
Key words:
cardiovascular diseases, resistance to hypoxia, diffuse cardiosclerosis,
individual reactivity.
Сведения об авторах:
Сатурская
Анна Степановна –
д.м.н., зав. кафедры социальной медицины, организации и экономики
здравоохранения с медицинской статистикой ГВУЗ "Тернопольский
государственный медицинский университет имени И. Я. Горбачевского Министерства
здравоохранения Украины", кафедра социальной
медицины, организации и экономики здравоохранения с медицинской статистикой, ул. Словацкого, 2, Тернополь, Украина, тел. 098 0651672 saturska.gs@gmail.com
Потиха
Наталья Ярославовна –
к.м.н., доцент кафедры функциональной
и лабораторной диагностики ГВУЗ "Тернопольский государственный
медицинский университет имени И. Я. Горбачевского Министерства здравоохранения
Украины", кафедра функциональной и лабораторной диагностики, ул. Клиническая, 6, Тернополь, Украина, тел. 098 4631225 potikha@tdmu.edu.ua
Сатурская
Ульяна Владимировна –
студентка 5 курса ГВУЗ "Тернопольский государственный медицинский
университет имени И. Я. Горбачевского Министерства здравоохранения
Украины", социальной медицины, организации и экономики здравоохранения с
медицинской статистикой, ул. Словацкого, 2, Тернополь, Украина, тел. 098 3900743 saturska_ulvo@tdmu.edu.ua
Кафедра
социальной
медицины, организации и экономики
здравоохранения
с медицинской статистикой
ГВУЗ
"Тернопольский государственный медицинский университет имени И. Я. Горбачевского
Министерства здравоохранения Украины"
I.
Поступила в редакцию 07.12.2018