Математическая морфология.
Электронный математический и
медико-биологический журнал. - Т. 13. -
Вып. 1. - 2014. - URL:
http://www.smolensk.ru/user/sgma/MMORPH/TITL.HTM
http://www.smolensk.ru/user/sgma/MMORPH/N-41-html/TITL-41.htm
http://www.smolensk.ru/user/sgma/MMORPH/N-41-html/cont.htm
УДК 502.085
ОСОБЕННОСТИ
БИОЛОГИЧЕСКИХ СИСТЕМ ИНФОРМАЦИОННОЙ БЕЗОПАСНОСТИ
Ó 2013г. Блюм В. С.
(blum-1.doc) (blum.pdf) (blum-1.docx)
Рассмотрены особенности
иммунной системы человека как системы информационной безопасности. Сделана попытка
ответить на вопросы, как биологической системе обеспечивается целостность
информации, конфиденциальности информации и доступность информации для контроля
и обработки. — Библ. 19 назв.
Ключевые слова: информационная
безопасность, иммунная система, иммунокомпьютинг.
Введение
Поиск эффективных алгоритмов
и способов организации данных для решения задач информационной безопасности
проводится, в частности, в рамках научно-технического направления - иммунокомпьютинг [16,17,18].
Математические формализмы и алгоритмы иммунокомпьютинга опираются на
современные знания о работе иммунной системы позвоночных и учитывают ее
особенности. Анализу особенностей процесса устранения вторжений в организме
позвоночного посвящена настоящая статья.
Есть основания считать, что иммунная система живого организма является наилучшим
из известных образцов систем
информационной безопасности, учитывая необычайную структурную и функциональную
сложности объекта защиты.
В процессе эволюции живых
существ возникли многоклеточные организмы. По мере усложнения их строения происходила
специализация функций разных клеток и состоящих из них органов: пищеварения,
дыхания и других. На определенном этапе эволюции в многоклеточном организме появились
клетки, призванные защищать организм от опасных для него вторжений. Постепенно
сформировалась особая система органов и клеток, обеспечивающих защиту
(иммунитет) организма от вторжений, которая получила название иммунной системы.
Клетки, входящие в состав иммунной системы, были названы иммунокомпетентными.
Отметим, что объект
называемый иммунной системой присутствует только у позвоночных животный.
Наибольший интерес, безусловно, представляет иммунная система человека.
Иммунная система (от лат. Immunitas - освобождение ) – это система организма, которая распознает, перерабатывает и устраняет чужеродные тела и вещества. В результате
непрерывного выполнения функций распознавания, переработки и устранения
чужеродных тел и веществ организм обладает
замечательным свойством – иммунитетом.
Рассмотрим особенности иммунной системы человека как
системы информационной безопасности всего организма и каждой его клетки. То
есть попытаемся ответить на вопросы, как в биологической системе решаются задачи:
·
обеспечения
целостности информации, т.е. предотвращения несанкционированной записи
информации,
·
обеспечения
конфиденциальности информации, т.е. предотвращения несанкционированного
считывания информации,
·
обеспечения
доступности информации, т.е. предотвращение уменьшения пропускной способности
информационных каналов.
Геометрия
внешнего интерфейса
Поверхность, которая
принимает на себя все попытки внешнего вторжения в организм человека – это
мембранная поверхность клеток организма.
В работе
К. Шмидта-Ниельсена [1], в которую вошли главные результаты его многолетних
исследований, проанализированы различные закономерности в ряде организмов от
мыши до слона и убедительно показано, что более крупные организмы просто
содержат больше клеток, а сами клетки соответствующих органов и тканей примерно
одинаковы у разных организмов. Например, диаметр лимфоцита, около 10 мкм, а
диаметр обычной клетки печени примерно 20 мкм. Толщина плазматической
мембраны составляет около 10 нм.
Известно, что в 1 грамме
организма млекопитающего около 1 млрд. клеток. Диаметр одной клетки около 0,01
мм. Тогда, к моменту рождения человека,
когда почти все системы организма сформированы, из одной оплодотворенной клетки
сформируется мембранная поверхность около ![]() . Площадь поверхности всех клеток взрослого человеческого организма составляет
около
. Площадь поверхности всех клеток взрослого человеческого организма составляет
около ![]() ( порядка
( порядка![]() клеток). Это поле размером 3 га, на котором
представлены все внешние вторжения клеток.
клеток). Это поле размером 3 га, на котором
представлены все внешние вторжения клеток.
На этом поле боя можно
выделить передний край: желудочно-кишечный тракт, систему дыхания, кожный
покров, органы слуха и зрения (биотопы макроорганизма). Площадь соприкосновения
стерильной внутренней среды макроорганизма с
внешним микромиром огромна, например, только для тонкой кишки при длине последней 2,8-3,2 м площадь слизистой составляет 180-200м2 .
Этот передний край обороны является интерфейсом организма, через
который идет весь поток вторжений и отторжений в процессе взаимодействия с
внешним миром.
Под вторжением будем понимать проникновение внутрь организма любых
веществ, нарушающих его нормальное функционирование. Отторжение – вывод из организма инородных, вторгшихся веществ и их
производных.
Отметим ряд особенностей этого интерфейса.
Частота вторжений и отторжений тем
выше, чем меньше площадь вторжения. В этой связи можно высказать гипотезу о
существовании ограничений пропускной способности для различных типов внешних
биологических информационных каналов.
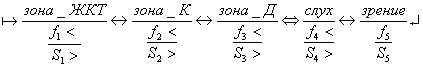
С позиций современной
иммунологии каналы звуковой и визуальной информации не рассматриваются как
участники формирования иммунного ответа. Для этих каналов пока не известны
соответствующие системы комплемента, обеспечивающие вывод вредной информации.
Таким образом, площадь поверхности внешних
вторжений:
![]() ,
,
где ![]() - зона ЖКТ – поверхность желудочно-кишечного
тракта,
- зона ЖКТ – поверхность желудочно-кишечного
тракта,
![]() - зона К
- поверхность кожного покрова,
- зона К
- поверхность кожного покрова,
![]() - зона Д
- поверхность системы дыхания.
- зона Д
- поверхность системы дыхания.
Площадь ![]() составляет около 1% от общей
площади мембранной поверхности всех клеток организма.
составляет около 1% от общей
площади мембранной поверхности всех клеток организма.
Рассматриваемую поверхность,
имеющая площадь ![]() , назовем рабочей АнтигенПредставляющей Поверхностью
(рАПП).
, назовем рабочей АнтигенПредставляющей Поверхностью
(рАПП).
Выделив рАПП, мы вправе утверждать, что не существует других каналов вторжений
и отторжений инородных веществ в
организм млекопитающего, в каком бы физическом состоянии это вещество не
находилось: твердом, жидком или газообразном.
Чтобы исключить потерю
существенной информации, проходящей через интерфейс рАПП, оцифровка этой
информации должна происходить с частотой не менее чем 2*f3 (теорема
Котельникова).
Важным свойством рАПП, с
точки зрения информационной безопасности организма, является непрерывность и
конечность этой поверхности.
Поверхность рАПП –
геометрическое место точек, для каждой из которых найдется точка этой
поверхности, расстояние до которой меньше некоторого наперед заданного числа.
Целостность рАПП является
необходимым условием целостности организма. Также как целостность мембранной поверхности
отдельной клетки есть условие целостности клетки.
Различие заключается в том,
что, если геометрическая модель поверхности клетки может быть аппроксимирована
поверхностью шара, то для рАПП, очевидно, этого сделать нельзя.
Для аппроксимации рАПП может
быть использована поверхность тора. Эта поверхность имеет следующие ограничения.
Пусть ![]() , где
, где ![]() - длина,
- длина, ![]() - ширина
поверхности,
- ширина
поверхности,
тогда ![]() ,
,
![]() , где
, где ![]() - внешний
радиус тора,
- внешний
радиус тора,
![]() , где
, где ![]() - внутренний радиус тора,
- внутренний радиус тора,
![]() , где
, где ![]() - радиус
образующей окружности,
- радиус
образующей окружности,
![]()
Отметим, что рАПП формирует
физический и экологический барьер, который препятствует проникновению патологических
агентов внутрь организма [2].
Вторжение может быть
локализовано в любой точке рАПП. Однако вероятность вторжений различна для
различных зон рАПП.
Почти все клетки организма
(99%), объекты охраны и обороны иммунной системы, размещены внутри тороидальной
рАПП.
Каждая клетка обладает кодом принадлежности данному организму (КПО),
который хранится в двух экземплярах как часть кода ДНК. ДНК - это
супер-молекула, хранящая закодированную наследственную информацию. Она состоит
из двух длинных цепочек химически
соединенных попарно. В обычных мерах измерения, длина нити ДНК
составляет около 1.82 метра, при толщине 0.0000254 микрон. Это самый длинный
код организма.
На поверхности мембраны
каждой клетки представлены образы КПО в
форме молекул главного комплекса гистосовместимости (МНС– от Major
Histocompatibility Complex) [3].
Внутри тороида рАПП выполняется циркуляция крови
(кровообращение) и лимфы (хоминг) с опорной частотой пульсаций ![]() 1 гц. Циркуляция жидкостей организма гарантирует доставку необходимых средств для решения задач
распознавания, переработки и устранения вторжений в любой зоне рАПП.
1 гц. Циркуляция жидкостей организма гарантирует доставку необходимых средств для решения задач
распознавания, переработки и устранения вторжений в любой зоне рАПП.
Предлагаемая геометрическая
модель информационного интерфейса организма позвоночных, на наш взгляд, имеет самостоятельную
ценность. Тороид рАПП может быть использован для исследований, например, механических
вторжений несовместимых с жизнью организма.
С позиций информационной
безопасности, клетку организма будем рассматривать как
структурно-функциональный элемент, который хранит в двух экземплярах самый длинный
код в организме и способен вырабатывать и принимать более короткие коды.
Вторжения
Все возможные вторжения,
нарушающие информационную безопасность организма, называют антигенами.
Антигены - (от “против” и греч.
génos - рождение, происхождение), высокомолекулярные коллоидные вещества,
которые при попадании в организм животных и человека вызывают образование
специфических реагирующих с ними антител. Непременным условием антигенности
является отличие антигенов от веществ, имеющихся в норме в организме человека.
Определим вторжение как
<вторжение> ::=
<антиген>│<пептид>&<эпитоп>
Знак “::=” означает, что вместо понятия слева от
знака может быть подставлено понятие стоящее справа от знака. Знак “│” читается
как “или”. Знак “&” читается как “и”.
Пептид
(peptide) - вещество, молекула которого образована из двух или более аминокислот,
связанных между собой с помощью аминогруппы (-NH) и карбоксильной группы (-СО).
Можно проинтерпретировать как длинный код, упорядоченный набор чисел.
Эпитоп (Epitope) - или
антигенная детерминанта (Antigenic determinant, site) — химическая структура на
поверхности сложно построенного антигена; в силу особенности своей конфигурации
способна взаимодействовать с комплементарной ей структурой в составе антитела
(паратопом), определяя тем самым специфичность данной реакции. Можно
проинтерпретировать как код, упорядоченный набор чисел.
Процедура распознавания, переработки и устранения вторжений “ответ ИмС”
Алгоритм распознавания,
переработки и устранения вторжений выполняется
иммунной системой (ИмС). Эту процедуру
называют ответом иммунной
системы.
Параметры
процедуры
Для выполнения
процедуры необходимо определить ее переменные,
которые назовем адептами ИмС (хранителями тайн) и определим так:
< адепты ИмС > ::=<антитела>│<лимфоциты>│<цитокины>│<фагоциты>│<система
комплемента>
< антитела > ::= <
иммуноглобулин >&< паратоп >
Антитела
( antibodies)—белки, образующиеся в
организме при попадании в него некоторых чужеродных веществ —антигенов— и
обладающие способностью избирательно соединяться с теми же антигенами или (в
меньшей степени) со сходными с ними по строению веществами, вызывая тем самым иммунный
ответ организма. Длинный код, упорядоченный набор чисел.
Паратоп (paratope) – антигенсвязывающий
центр антитела; в силу особенности своей конфигурации способен взаимодействовать
с комплементарной ему структурой в составе антигена (эпитопом), определяя тем
самым специфичность данной реакции. Можно проинтерпретировать как код, упорядоченный
набор чисел.
<
иммуноглобулин >::= < IgA > │< IgD >│ < IgE >
│ < IgG > │ < IgM >
Иммуноглобулинами называются белки, которые
синтезируются под влиянием антигена и специфически с ним реагируют.
Иммуноглобулины состоят из полипептидных цепей. Можно проинтерпретировать как
длинный код, упорядоченный набор чисел.
<лимфоциты> ::= <
Т-лимфоциты > │< B-лимфоциты > │ <
NK-клетки >
Лимфоциты — это вид белых кровяных телец (клеток). Различают малые, средние и
большие лимфоциты. Малые лимфоциты имеют диаметр менее 8 мкм. Средние лимфоциты
имеют сходную с малыми структуру, размеры их 8-12 мкм. Большие лимфоциты имеют
диаметр 12-14 мкм. Лимфоциты составляют основную массу клеточных элементов лимфоидной
ткани, 95 % клеток лимфы и 30 % общего числа лейкоцитов крови.
< Т-лимфоциты >::= <Тn> │ <Т-хелперы> │ <Т-киллеры>│ <Т-памяти>│ <Т-супрессоры>
< Тn >
::= <Т-наивный>
Т-лимфоциты — это средние лимфоциты. Незрелые лимфоциты
покидают костный мозг и попадают в кровяное русло. Некоторые из них направляются
к тимусу (вилочковой железе), расположенному у основания шеи, где происходит их
созревание. Прошедшие через тимус лимфоциты известны как Т-лимфоциты, или
Т-клетки (Т от «тимус»). Зрелые Т-лимфоциты представлены в организме различными
типами: Т-хелперы, Т-киллеры, Т-памяти, Т-супрессоры . Роль этих клеток поясним при описании алгоритма ответа иммунной
системы.
< B-лимфоциты >::= <Вn>
│<В-памяти> │< плазматические клетки>
<Вn> ::= <В-наивный>
B-лимфоциты — это малые и средние
лимфоциты. В экспериментах на цыплятах было показано, что часть незрелых
лимфоцитов закрепляется и созревает в сумке Фабрициуса – лимфоидном органе
около клоаки. Такие лимфоциты известны как В-лимфоциты, или В-клетки (B от bursa
– сумка). У человека и других млекопитающих В-клетки созревают в лимфатических
узлах и лимфоидной ткани всего организма. Зрелые В-лимфоциты представлены в
организме различными типами: В-наивные, В-памяти и плазматические клетки. Роль
этих клеток выяснится при описании алгоритма ответа иммунной системы.
Антигенраспознающий рецептор
(порт для приема/передачи информации) и функциональные потенции приобретаются
лимфоцитами в процессе их развития. При этом срабатывают механизмы,
обеспечивающие невозможность формирования на клетке более, чем одного типа
рецепторов. В результате каждый созревающий лимфоцит имеет рецепторы,
уникальные по специфичности [7,8].
NK-клетки - большие лимфоциты, известные как естественные киллеры.
<цитокины> ::= < интерлейкины >│< интерфероны >│< факторы некроза опухолей >│
< колониестимулирующие факторы >
< интерлейкины >::= <IL-2>│<IL-3>│<IL-4>│<IL-12>│…
< интерфероны >::= <INF-гамма>│…
< факторы некроза опухолей >::=<FNO-α>│<FNO-β>│…
< колониестимулирующие факторы >::=<ГМ-КСФ>│…
Цитокины - это небольшие белки (мол. масса от 8 до 80 КДа), действующие аутокринно
(т.е. на клетку, которая их продуцирует) или паракринно (на клетки,
расположенные вблизи). Образование и высвобождение этих высокоактивных молекул
происходит кратковременно и жестко регулируется. Все клетки ИмС производят
цитокины или, по крайней мере, готовы принять сообщение-цитокин через свой порт
(рецептор) на мембранной поверхности. Вся совокупность цитокинов определяет
трафик обмена информацией внутри организма. Код, упорядоченный набор чисел.
<фагоциты>::=
<макрофаги>│<дендритные клетки>│<тучные
клетки>│…
Макрофаги — это вид белых кровяных
телец лейкоцитов, известных как фагоциты, получившие свое название от греческого
phago —«есть» и cyt — «клетка». Они постоянно стремятся «съесть», уничтожить
чужеродных «захватчиков», таких, как микроорганизмы, пылинки в легких, патогенные грибки, загрязняющие
вещества из дыма и многое другое, что они могут распознать как нагрузку,
нежелательную для здоровья организма.
Дендритные клетки (DENDRITIC CELLS) - тип клеток иммунной системы, имеющих длинные,
похожие на щупальца, ответвления, которыми они захватывают чужеродные объекты.
Тучные клетки — одна из
основных клеточных форм соединительной ткани.
<система
комплемента>::= < комплементные белки>│< МАК >
< комплементные белки>
::= <C1>│. . . │<C9>│<фактор
В>│ . . .
< МАК > ::=
<мембранный атакующий комплекс>
Система комплемента - это совокупность более 25 белков сыворотки крови, циркулирующих в
неактивном состоянии. При попадании в ткани (кровь) активаторов (иммунных
комплексов <антиген+антитело>) происходит активация системы - каскадное
взаимодействие белков системы комплемента с образованием повреждений в мембране
клеток-мишеней. Последовательная активация всех компонентов системы комплемента
имеет ряд последствий. Во-первых, происходит каскадное усиление реакции, почти
каждый последующий этап реакции активации комплемента является ферментативным,
при котором продуктов реакции образуется несравнимо больше, чем исходных
реагирующих веществ. Во-вторых, на поверхности бактерии фиксируются компоненты
комплемента, резко усиливающие фагоцитоз этих клеток, то есть сродство их к
фагоцитирующим клеткам организма. В-третьих, при ферментативном расщеплении
белков системы комплемента образуются фрагменты, обладающие мощной
воспалительной активностью. И, наконец, при включении в комплекс
антиген-антитело последнего компонента комплемента этот комплекс приобретает
способность ''продырявливать'' клеточную мембрану и тем самым убивать чужеродные
клетки.
В составе параметров
процедуры “ответ ИмС” выделим те из
них, которые непосредственно связывают и устраняют вторжения. Назовем эти параметры
эффекторами ИмС.
К этим параметрам относятся:
1.
<фагоциты>
- клетки, которые при встрече с антигеном захватывают его без учета специфичности
и пытаются переработать внутри клетки,
2.
<cистема
комплемента> - набор белков, которые при встрече с комплексом <антиген+антитело>
активируются без учета специфики антигена и разрушают данный комплекс, либо
клетку, если данный комплекс закреплен на ее поверхности.
3.
<антитело>
- белок, который при встрече с соответствующим
антигеном взаимодействует с ним, образуя иммунный комплекс <антиген+антитело>,
4.
<Т-киллеры>
- клетки, которые при встрече с клетками, на мембране которых размещен соответствующий антиген и код
несоответсвия клетки данному организму (молекула МНС I), атакуют клетку-мишень,
вводя внутрь клетки лизирующее (растворяющее) вещество.
Одной из ключевых функций
иммунной системы является управление синтезом эффекторов ИмС и регулирование их
численности.
Условие запуска процедуры “ответ ИмС”
Для запуска иммунного ответа на новое (ранее не встречавшееся) вторжение необходима локализация следующих условий [4,5,6,7]:
1.
имеется
поверхность (мембрана) антигенпрезентирующей клетки - АПК (макрофага или дендритной
клетки или В-лимфоцита ),
2.
на
поверхности АПК зафиксирован пептид с антигенной детерминантой (эпитопом),
3.
на
поверхности АПК зафиксирована молекула МНС II - идентификатор организма-хозяина,
4.
с
этой поверхности стартует (экспрессирует) цитокин-сообщение ( IL-2), которое, в
частности, подтверждает события 1,2,3.
Коротко условие запуска
процедуры запишем так:
< АПК >&<
молекула МНС II >&< антиген > ![]()
< АПК >::=<антингенпрезентирующая
клетка>│<макрофаг>│<B-лимфоцит>│<дендритная
клетка>
Данное событие связано с
передачей информации о локализации вторжения и о специфике антигена. Эта
информация передается ближайшему подходящему
“наивному” Т-лимфоциту. Получивший информацию Тn активируется. Начинается
процесс деления (пролиферации) активированной Т-клетки. При этом может быть
произведено от 500 до 1000 клеток. Вся вновь возникшая популяция поступает в
поток циркуляции жидкостей организма, чтобы добраться до тимуса и там завершить
свое развитие.
< АПК >&<
молекула МНС II >&< антиген > ![]()
![]() , (1)
, (1)
где ![]() - активная “наивная” Т-клетка, обладающая информацией об антигене, знак
“
- активная “наивная” Т-клетка, обладающая информацией об антигене, знак
“![]() ” означает необходимое преобразование понятия слева от
стрелки в понятие справа от стрелки при исполнении заданного условия.
” означает необходимое преобразование понятия слева от
стрелки в понятие справа от стрелки при исполнении заданного условия.
Событие (1) указывает на то,
что вторжение обнаружено! Информация о
локализации вторжения и его коде (или часть этой информации) записана в клетке ![]() .
.
Событие (1) также говорит о
том, что в окружении АПК нет эффекторов ИмС.
В результате события (1)
формируется клон клеток ![]() [15]. Обозначим
клон клеток как
[15]. Обозначим
клон клеток как ![]() .
.
Синтез эффекторов иммунной системы
Созревание клеток ![]() связано с
развитием конкретных рецепторов (портов) и
конкретных функциональных потенций (дифференцировка) клеток.
связано с
развитием конкретных рецепторов (портов) и
конкретных функциональных потенций (дифференцировка) клеток.
Из конкретной ![]() может созреть
либо <Т-киллер>, либо
<Т-хелпер>, либо <Т-супрессор>, либо остановиться в развитии
в виде <Т-памяти>.
может созреть
либо <Т-киллер>, либо
<Т-хелпер>, либо <Т-супрессор>, либо остановиться в развитии
в виде <Т-памяти>.
< Т-хелпер > ::= ![]() &<рецептор CD4>
&<рецептор CD4>
< Т-памяти > ::= ![]() &<рецептор памяти>
&<рецептор памяти>
< Т-супрессор > ::= ![]() &<рецептор торможения>
&<рецептор торможения>
<Т-киллер > ::= ![]() &<рецептор CD8> │<ЦТЛ>
&<рецептор CD8> │<ЦТЛ>
<ЦТЛ> ::= < цитотоксический Т-лимфоцит>
Количественное распределение
производных типов клеток от клона ![]() - вопрос требующий
специального рассмотрения.
- вопрос требующий
специального рассмотрения.
Если в результате созревания
клеток из клона ![]() популяция Т-киллеров не пуста, то одна из
промежуточных задач ответа ИмС решена – синтезирован (ы) специализированный
эффектор для переработки вторжения (1) -
популяция Т-киллеров не пуста, то одна из
промежуточных задач ответа ИмС решена – синтезирован (ы) специализированный
эффектор для переработки вторжения (1) - ![]() .
.
Синтез других эффекторов ИмС
связан с дальнейшим развитием Т-хелперов [6].
< Т-хелпер > ![]() < Тh клеточной
активности>│
< Тh клеточной
активности>│![]()
< Т-хелпер >![]() < Тh гуморальной
активности>│
< Тh гуморальной
активности>│![]() (от лат. humor – жидкость)
(от лат. humor – жидкость)
Клетки ![]() и
и ![]() являются
генераторами своего (отличающегося) набора цитокинов. Если популяция
являются
генераторами своего (отличающегося) набора цитокинов. Если популяция ![]() от клона
от клона ![]() не пуста, то
стимулируется активность фагоцитов и ЦТЛ, подтверждая информацию о событии
(1). Под активностью соответствующих клеток
следует понимать увеличение их числа в области вторжения.
не пуста, то
стимулируется активность фагоцитов и ЦТЛ, подтверждая информацию о событии
(1). Под активностью соответствующих клеток
следует понимать увеличение их числа в области вторжения.
![]()
![]() <активность фагоцитов и ЦТЛ>
<активность фагоцитов и ЦТЛ>
![]() ::=<цитокины_клеточной_активностью>│<IL2>│<IFN-γ>│<Il3>│<FNO-α>│<FNO-β>│<ГМ-КСФ>
::=<цитокины_клеточной_активностью>│<IL2>│<IFN-γ>│<Il3>│<FNO-α>│<FNO-β>│<ГМ-КСФ>
Если популяция ![]() от клона
от клона ![]() не пуста, то
стимулируется активность В-лимфоцитов и передается информация о событии (1).
не пуста, то
стимулируется активность В-лимфоцитов и передается информация о событии (1).
![]()
![]() <активность В-лимфоцитов>
<активность В-лимфоцитов>
![]() ::=<цитокины_гуморальной_активностью>│<IL4>│<IL5>│<IL3>│<IL6>│<IL9>│<IL13>│<ГМ-КСФ>
::=<цитокины_гуморальной_активностью>│<IL4>│<IL5>│<IL3>│<IL6>│<IL9>│<IL13>│<ГМ-КСФ>
Активность В-лимфоцитов
приводит к синтезу наиболее эффективных средств борьбы с вторжением (1) –
специализированных антител [13,14]. Информация от ![]() передается
ближайшему “наивному” В-лимфоциту. Образуется клон
передается
ближайшему “наивному” В-лимфоциту. Образуется клон ![]() , из которого созревают либо плазматические клетки, либо (и) клетки
В-памяти.
, из которого созревают либо плазматические клетки, либо (и) клетки
В-памяти.
<плазматическая
клетка>::=![]() &<рецептор антитела>
&<рецептор антитела>
< В-памяти > ::= ![]() &<рецептор памяти>
&<рецептор памяти>
Плазматическая клетка
обладает способностью к синтезу и выделению в жидкости организма антител,
необходимых для связывания антигена, обнаруженного при возникновении события
(1).
![]() &<рецептор антитела>
&<рецептор антитела>![]()
Знак “?” говорит о том, что
автору неизвестны условия освобождения белков ![]() .
.
Из всего выше сказанного
следует, что событие (1) порождает лавинообразный процесс синтеза эффекторов
иммунной системы. Любой из синтезированных эффекторов ИмС способен
ликвидировать единичный факт вторжения. Поэтому процедура “ответ ИмС” имеет
набор методов и средств сдерживания процесса синтеза эффекторов и уменьшения их
активности. Основным инструментом устранения избытка эффекторов ИмС является
процедура апоптоза. Термин "апоптоз" (с греч. — опадание листьев)
введен в научный обиход в 1972 г. для обозначения формы гибели клеток.
Апоптоз — это активная форма гибели клетки, являющаяся результатом реализации
ее генетической программы или ответом на внешние сигналы и требующая затрат
энергии и синтеза макромолекул de novo, проявляющаяся в уменьшении ее размера,
конденсации и фрагментации хроматина, уплотнении наружной и цитоплазматических
мембран без выхода содержимого клетки в окружающую среду.
Переработка вторжений
Переработку вторжений
выполняют синтезированные иммунной системой эффекторы, специализированные белки
и клетки, получившие информацию о вторжении. Ликвидация одного и того же
единичного вторжения может быть выполнена с помощью различных эффекторов ИмС
[5, 9, 10, 11, 12].
1.
Поглощение
антигена фагоцитом.
![]()
![]()
![]()
Если антиген успешно
перерабатывается внутри клетки фагоцита, то
процесс ликвидации единичного вторжения завершен, в противном случае возникает
событие (1).
2.
Разрушение
зараженной клетки цитотоксическим лимфоцитом.
![]()
![]()
![]()
![]()
![]()
Объектом атаки
специализированного Т-киллера ![]() являются клетки
(клетки-мишени), на поверхности которых размещены как
являются клетки
(клетки-мишени), на поверхности которых размещены как ![]() , так и молекула МНС I – фрагмент КПО, признак “не
свой”. Атака
, так и молекула МНС I – фрагмент КПО, признак “не
свой”. Атака ![]() завершается
введением внутрь клетки-мишени лизирующего (растворяющего) вещества. После
этого
завершается
введением внутрь клетки-мишени лизирующего (растворяющего) вещества. После
этого ![]() переходит к поиску
очередной жертвы.
переходит к поиску
очередной жертвы.
3.
Формирование
иммунного комплекса.
![]()
![]()
![]()
Встреча антигена с
соответствующим антителом с необходимостью приводит к образованию иммунного
комплекса ![]() , который сам по себе, в большинстве случаев, уже не
опасен для организма. Зафиксированный
на поверхности клетки-мишени иммунный комплекс
, который сам по себе, в большинстве случаев, уже не
опасен для организма. Зафиксированный
на поверхности клетки-мишени иммунный комплекс ![]() с
необходимостью приводит к активированию системы комплемента и разрушению
мембраны зараженной клетки.
с
необходимостью приводит к активированию системы комплемента и разрушению
мембраны зараженной клетки.
![]()
![]()
![]()
![]()
Все
результаты исполнения процедуры “ответ ИмС” (метаболиты), отторжения, образованные
в результате действий эффекторов ИмС,
локализуются на поверхности рАПП и покидают организм в твердом, жидком
или газообразном состоянии.
Выводы
1.
В
сложной биологической системе каждая клетка - структурно-функциональный элемент
(СФЭ) обладает признаком принадлежности данной системе. Этот признак доступен для контроля со стороны системы информационной
безопасности.
2.
Каждый
СФЭ может быть восстановлен двумя способами. Путем синтеза из одной (стволовой)
клетки. Аналог восстановления программы из исходных текстов. Либо путем самокопирования
(деление клеток).
3.
Каждый
СФЭ лоялен к системе информационной безопасности. Это выражается в инициативе выдачи сообщения о нарушении структуры
или исполняемых функций. Кроме того, СФЭ обладает способностью запускать
внутреннюю процедуру апоптоза.
4.
В
сложной биологической системе реализуется более одного способа удаления
вторжений.
5.
Возможно,
для каждого вторжения существует отторжение.
Литература
1.
Шмидт-Ниельсен
К. Размеры животных: почему они так важны?, М.,Мир,1987,-259с.
2.
Хэм
А., Кормак Д. Гистология, М., «Мир», т. 4, 344 с.
3. Marsh,S.G., Albert,E.D., Bodmer,W.F.,
Bontrop,R.E., Dupont,B., Erlich,H.A., Geraghty, D.E.,Hansen, J.A., Mach,
B.,Mayr, W.R.,Parham,P., Petersdorf, E.W.,Sasazuki, T.,Schreuder, G.M.,
Strominger, J.L., Svejgaard, A.,Terasaki, P.I.,2002. Nomenclature
for factors of the HLA system,2002.Tissue Antigens 60,407 –464.
4. Петров Р.В. Формы
взаимодействия клеток лимфоидных тканей: трехклеточная система иммуногенеза.
Успехи совр. биол. 194: 1208-1210. 1970.
5. Germain R.N., Castellino F., Han R. et al. Processing and presentation
of endocytically acquired protein antigens be MHC class II and class I
molecules. Immunol.Rev.151: 5-30.1996.
6. Madden D.R. The three-dimensional structure of peptide-MHC complexes.
Ann. Rev. Immunol.13: 587-622.1995.
7. Nicholson L.B., Kichroo V.K. T cell recognition of self and altered self
antigens Crit. Rev. Immunol. 17: 449-462.1997.
8. Cantrell D. T cell antigen receptor signal transduction pathways. Ann.
Rev. Immunol.12: 259-274.1996.
9. Хаитов Р.М., Алексеев Л.П.
Роль HLA-антигенов в клеточном взаимодействии. Иммунология. 5: 11-15. 1998.
10. Janeway C.A. The T cell receptor as a multicomponent signalling machine:
CD4/CD8 coreceptors and CD45 in T cell activation. Ann.Rev. Immunol.10:645-674.1992
11.
Moller G. The B-cell antigen receptor complex. Immunol. Rev. 132:1-206.
1993.
12. Zinkernagel R.M., Doherty P.C. The discovery of MHC restriction. Immunol.
Today.18: 14-17.1997.
13. Capra J.D. Germinal centers . Immunologist. 4: 84-86.1996.
14. Noelle R. B-cell differentiation and antibody production. Immuniologist.
3:219-220.1995.
15. Sprent J. T and B memory cells. Cell.- 1994.- Vol. 76.- P. 315-322.
16.
Тараканов
А., Дасгупта Д. Архитектура иммуночипа и ее эмуляция. Конференция НАСА/МО по эволюционируемой аппаратуре, EH-2002, с.
261-265. Александрия, Вирджиния, 15-18 июля 2002
17. Тараканов А.О. Формальные
иммунные сети: математическая теория и технология искусственного интеллекта. Теоретические основы и прикладные задачи
интеллектуальных информационных технологий (ред. Юсупов Р.М.). СПб, СПИИРАН, 1998, 65-70.
18. Tarakanov, A. O., Skormin, V. A., Sokolova, S. P. Immunocomputing: Principles and Applications. Springer, New York,
2003.
19. Блюм В.С., Заболотский В.П.
Иммунная система и иммунокомпьютинг. Математическая морфология. Электронный
математический и медико-биологический журнал. (Том 6. Выпуск 4. 2007).
FEATURES OF BIOLOGICAL SYSTEMS INFORMATION SECURITY
Blum V.
S.
The features of the human immune system as a
system of information security. Attempts to answer the questions as a biological
system ensures data integrity, confidentiality and availability of information
for monitoring and treatment. - Bibliography. 19 refs.
Key words: information security, the immune system,
immunocomputing.
|
№ |
Фамилия Имя Отчество автора
(полностью) |
Должность (сокращённо) |
Ученая степень |
Ученое звание |
Организация (сокращённо) |
|
1 |
Блюм Владислав Станиславович |
c.н.с. |
к.т.н. |
с.н.с. |
СПИИРАН |
Россия, С-Петербург, Санкт-Петербургский
институт информатики и
автоматизации РАН
СПИИРАН, 14-я линия ВО, д. 39, Санкт-Петербург, 199178
<vladblum7@gmail.com>